黄河滩枣大枣多糖胶囊的制备及其质量考察
赵忠熙,程惠玲,杨民,刘新权
(1.山东大学药学院,山东大学药物制剂与释药系统研究中心,山东济南250012;2.山东省立千佛山医院医学研究中心,山东济南250014)
黄河滩枣大枣多糖胶囊的制备及其质量考察
赵忠熙1Δ,程惠玲2Δ,杨民1,刘新权1
(1.山东大学药学院,山东大学药物制剂与释药系统研究中心,山东济南250012;2.山东省立千佛山医院医学研究中心,山东济南250014)
目的黄河滩枣大枣多糖胶囊制剂的制备及其质量考察。方法通过对所提取的大枣多糖的处方前性能评价以及多糖与辅料的配伍研究,开发了黄河滩枣大枣多糖的胶囊制剂;以验证过的苯酚-硫酸多糖测定法和所开发的体外溶出方法对胶囊制剂进行了大枣多糖的含量和体外溶出度分析测定;通过加速稳定性试验等研究技术,对所制备的大枣多糖胶囊制剂进行了较为全面的质量考察。结果研究结果表明所选用的辅料对大枣多糖含量测定无影响,所制备的大枣多糖胶囊制剂符合质量标准要求;所采用的苯酚-硫酸测定多糖法具有良好的线性(R2=0.9992)、良好的日内日间精密度以及回收率;3个批次的胶囊制剂经带有感应封口的药用聚乙烯塑料瓶包装后在40oC/75%RH条件下,3个月内主药含量及其他检查项目未见明显变化。结论所开发的黄河滩枣大枣多糖胶囊处方配方合理,制备方法简便易行,最终制剂产品质量稳定,易于产品质量控制。
黄河滩枣;多糖;胶囊制剂
黄河滩枣为鼠李科枣属植物枣树的果实,主产于陕晋交界黄河沿岸,栽培历史悠久,具有极高的营养价值。大枣含有三萜酸[1],黄酮类物质[2],氨基酸[3],酚酸[4],微量元素[5]和多糖[6]。大枣是一味传统中药,用于补中益气,养血安神,主治脾虚食少,乏力便溏,妇人脏躁[7]。现有研究表明,大枣多糖具有抗炎作用[8],抗肥胖[9],胃肠道保护作用[10],以及免疫活性[11]。大枣的生理活性和药理作用与其所含的多糖成分密切相关。
前期研究结果显示,从黄河滩枣中提取的多糖,由甘露糖,鼠李糖,阿拉伯糖,葡萄糖,半乳糖及半乳糖醛酸6种单糖组成[12]。其不仅具有抗氧化活性,抗肿瘤活性以及免疫促进活性,而且其对肝损伤的预防作用和治疗作用十分显著。可见将大枣多糖用于医药、保健产品或功能食品将具有广阔的市场前景和应用价值。因此,本文将从黄河滩枣中提取的多糖制成胶囊剂,以期提供一种给药形式,为大枣多糖的进一步活性研究以及大枣多糖制剂的剂型改进和发展提供一定的借鉴依据。
1 材料与方法
1.1 材料与仪器 黄河滩枣多糖(由本实验室制备[12],多糖含量以葡萄糖计为35.96%),大枣多糖颗粒(由本实验室制备,方法:取大枣多糖粉末2.0 g,无水磷酸氢钙粉末10.0 g,混合均匀,加入少量50%乙醇溶液制软材,过30目筛制粒,50℃干燥1 h后20目筛整粒,得到大枣多糖颗粒)。
苯酚(分析纯,国药集团化学试剂有限公司),硫酸(分析纯,莱阳经济技术开发区精细化工厂),无水磷酸氢钙(江苏宿迁化工,批号:20111208),硬脂酸镁(山东聊城阿华制药有限公司,批号:20120523),碳酸钙(国药集团化学试剂有限公司),交联聚维酮(德国BASF,批号:01644/20 U0),微晶纤维素(PH102,日本旭化城株式会社,批号:20C2),硫酸铜(分析纯,天津博迪化工股份有限公司),氢氧化钠(分析纯,国药集团化学试剂有限公司),D-葡萄糖(美国Sigma公司),α-萘酚(分析纯,上海金山亭新化工试剂厂),无水乙醇(分析纯,天津市富宇精细化工有限公司),茚三酮(成都市科龙化工试剂厂),4号胶囊(苏州胶囊有限公司),超纯水(Millipore)。
TU-1900双光束紫外可见分光光度计(北京普析通用仪器有限责任公司),圆周振荡器(IKA®MS 3 Basic),RC806D溶出试验仪(天津市天大天发科技有限公司)。
1.2 大枣多糖胶囊的制备
1.2.1 辅料的筛选:本文采用苯酚-硫酸法测定大枣多糖胶囊中多糖的含量。因此,以选用辅料不干扰苯酚-硫酸法测定大枣多糖含量为基本原则对辅料进行筛选。
取辅料无水磷酸氢钙、碳酸钙、交联聚维酮、微晶纤维素、乳糖、硬脂酸镁各20mg,分别溶于10mL水中,充分搅拌混匀,过滤,取滤液1.0mL,用苯酚-硫酸法显色。以1.0mL超纯水同法操作为空白对照,在490 nm波长处测定吸光度值。
1.2.2 原料药与辅料的相容性试验[13]:经过筛选,拟选取无水磷酸氢钙和硬脂酸镁为辅料,分别称取适量大枣多糖∶无水磷酸氢钙∶硬脂酸镁=1∶5∶0.05混合物,平铺于称量瓶中,分别置于高温(恒温60℃),高湿(相对湿度75%),强光(照度4500 lx±500 lx)条件下10 d,10 d后取样,考察多糖的外观性状,多糖含量及重量变化。
1.2.3 原料药及辅料粉体学性质考察:分别取适量大枣多糖粉末、辅料粉末和大枣多糖颗粒,测定松密度和振实密度。采用注入法测定粉末和颗粒的休止角。
1.2.4 原料药及辅料的吸湿性考察[14]:取干燥的具塞玻璃称量瓶,置于适宜的(25±1)℃恒温干燥器(底部放置硫酸铵饱和溶液)。24 h后,精密称定重量(m1)。取供试品适量,平铺于上述称量瓶中,精密称定重量(m2)。将称量瓶敞口,并与瓶盖同置于上述恒温恒湿条件下24 h。盖好称量瓶盖,精密称定重量(m3),计算增重百分率:增重百分率=(m3-m2)/(m2-m1)× 100%。
1.2.5 大枣多糖胶囊的制备:将制备的大枣多糖颗粒与1%的硬脂酸镁混合均匀,装入4号胶囊。
1.3 大枣多糖胶囊质量研究
1.3.1 鉴别:供试品溶液的配制:取胶囊若干,仔细倾出颗粒内容物,研磨粉碎。称取600.0mg,于100mL容量瓶中溶解定容,摇匀,过滤得到滤液供试品。
供试品水解液的制备:取上述供试品溶液加入适量浓硫酸至2mol/mL,密封,110℃水解8 h,用NaOH溶液中和后过滤,即得。
斐林试剂鉴别法:分别量取1.0m L供试品溶液和1.0 mL供试品水解液于试管中。另取1 mL NaOH溶液(0.1 g/mL)于试管中,加入4~5滴硫酸铜溶液(0.05 g/mL),立即混匀,加入含有供试品溶液的试管中,沸水浴中加热5 min。以蒸馏水和葡萄糖溶液(1 mg/mL)同法操作,分别为阴性对照和阳性对照。
Molisch反应:量取1.0mL供试品溶液于试管中,加入5%α-萘酚乙醇溶液2~3滴,充分摇匀,再沿试管壁缓缓加入0.5 m L浓硫酸。以蒸馏水和葡萄糖溶液(1mg/mL)同法操作,分别为阴性对照和阳性对照。
沉淀反应:量取1.0mL供试品溶液于试管中,煮沸。以蒸馏水和牛血清白蛋白溶液(1.0mg/mL)同法操作,分别为阴性对照和阳性对照。
双缩脲反应:量取1.0 mL供试品溶液于试管中,加入1.0 mL双缩脲溶液,混匀后,室温放置15min。以蒸馏水和牛血清白蛋白溶液(1.0mg/mL)同法操作,分别为阴性对照和阳性对照。
茚三酮反应:量取1.0mL供试品溶液于试管中,加入3~4滴茚三酮溶液加热煮沸5min,冷却后观察颜色变化。以蒸馏水和牛血清白蛋白溶液(1.0mg/mL)同法操作,分别为阴性对照和阳性对照。
1.3.2 含量测定
①溶液的配制
葡萄糖对照品溶液:精密称取经105℃干燥至恒重的无水葡萄糖10.0mg,于100mL容量瓶中加超纯水溶解,并用超纯水定容,然后摇匀,即得葡萄糖对照品溶液。
供试品溶液:取胶囊若干,仔细倾出颗粒内容物,研磨粉碎。称取120.0mg,于100mL容量瓶中加水溶解,并用超纯水定容,然后摇匀,即得大枣多糖胶囊样品溶液。
②专属性
精密称取处方量的空白辅料研磨均匀,取适量置于100mL容量瓶中,加超纯水溶解定容,混合均匀。过滤,取滤液1.0mL,按苯酚-硫酸法显色。同法处理大枣多糖胶囊。以1.0mL超纯水同法操作为空白对照,分别在200~700 nm范围内扫描紫外吸收图谱。
③标准曲线的绘制
分别精密量取葡萄糖对照品溶液1.0、2.0、3.0、4.0、5.0、6.0、8.0mL于10m L容量瓶中,加超纯水定容并摇匀,得一系列葡萄糖对照品标准溶液。浓度分别为10、20、30、40、50、60、80、100μg/mL。分别取各浓度溶液1.0mL于带塞玻璃试管中,分别加入5%苯酚溶液1.6 mL,充分混匀,再快速加入7.0 mL浓硫酸,涡旋混匀,置于冰水浴中10min,再于沸水浴中加热10min,冷却至室温。以超纯水同法操作为空白对照,在490 nm波长处测定吸光度值(A)为纵坐标,以葡萄糖浓度C(μg/mL)为横坐标,进行线性回归,绘制标准曲线。
④精密度
精密量取1.0mL供试品溶液,于6个不同带塞玻璃试管中,加入5%苯酚溶液1.6mL,充分混匀后,加入7.0mL浓硫酸,涡旋混匀,置于冰水浴中10min,再于沸水浴中加热10min,冷却至室温。以超纯水同法操作为空白对照,在490 nm处测定吸光度,连续测定5 d。分别计算日内精密度和日间精密度。
⑤稳定性
精密量取供试品溶液1.0 mL于带塞玻璃试管中,加入5%苯酚溶液1.6mL,充分混匀后,加入7.0 mL浓硫酸,涡旋混匀,置于冰水浴中10min,再于沸水浴中加热10min,冷却至室温。以超纯水同法操作为空白对照,分别于0、5、10、20、40、60、90、150min,在490 nm处测定吸光度,计算RSD值。
⑥加样回收率
精密量取供试品溶液适量,配置成低、中、高3个浓度的大枣多糖溶液,分别取6 mL于10 mL容量瓶中,加入标准溶液2mL,定容摇匀。分别取1.0mL于带塞玻璃试管中,加入5%苯酚溶液1.6mL,充分混匀后,加入7.0mL浓硫酸,涡旋混匀,置于冰水浴中10min,再于沸水浴中加热10min,冷却至室温。以超纯水同法操作为空白对照,在490 nm处测定吸光度,计算样品含量和加样回收率:加样回收率(%)=(测定量-样品量)/加入量×100%。
⑦含量测定
精密量取供试品溶液1.0 mL于带塞试管中,加入5%苯酚溶液1.6mL,充分混匀后,加入7.0 mL浓硫酸,涡旋混匀,置于冰水浴中10 min,再于沸水浴中加热10 min,冷却至室温。以超纯水同法操作为空白对照,在490 nm处测定吸光度,根据标准曲线计算大枣多糖含量(以葡萄糖计)。分别测定3批(批号为2014325、20140409和20140411),每批均平行测3次。
1.3.3 溶出度测定[15]:采用2010版中国药典溶出度测定法第三法(小杯法),以水为溶出介质测定大枣多糖胶囊的溶出度,测定3批大枣多糖胶囊(批次为20140325、20140409、20140411)的溶出。
在各溶出杯中加入100mL经脱气处理的溶出介质,温度设定为(37.0±0.5)℃,转速为75 r/min,分别取6粒大枣多糖胶囊,精密称定,置于各溶出杯中,立即启动并开始计时,分别在3、5、10、15、20、30、45、60min取样3.0mL,并及时补充等量等温溶出介质。过滤,取滤液1.0mL按苯酚-硫酸法显色。以超纯水同法操作为空白对照,在490 nm处测定吸光度,根据标准曲线计算大枣多糖含量(以葡萄糖计),计算药物累计溶出百分比,并绘制溶出曲线。
1.3.4 装量差异:取大枣多糖胶囊20粒,精密称定重量后,仔细倾出内容物,拭净胶囊壳,再精密称定胶囊壳重量,计算每粒胶囊内容物的装量和平均装量。将每粒的装量与平均装量相比较,装量差异限度不多于2粒。
1.4 加速试验 取大枣多糖胶囊3批,药用聚乙烯塑料瓶包装,在温度(40±2)℃,相对湿度(75±5)%的加速试验条件下,放置3个月,在0、1、2、3个月的月末分别取样,检测大枣多糖胶囊的各项指标。
2 结果
2.1 辅料筛选的结果 各辅料经苯酚-硫酸法显色后,在490 nm处测定吸光度值如表1所示。辅料的筛选依据不影响苯酚-硫酸法测定大枣多糖含量为原则,因此根据表中所测得吸光度值,选取无水磷酸氢钙为填充剂,硬脂酸镁为润滑剂。

表1 辅料的筛选Tab.1 Screening of the excipients
2.2 原料药与辅料的相容性试验结果 原料药与辅料的相容性试验结果如表2所示。
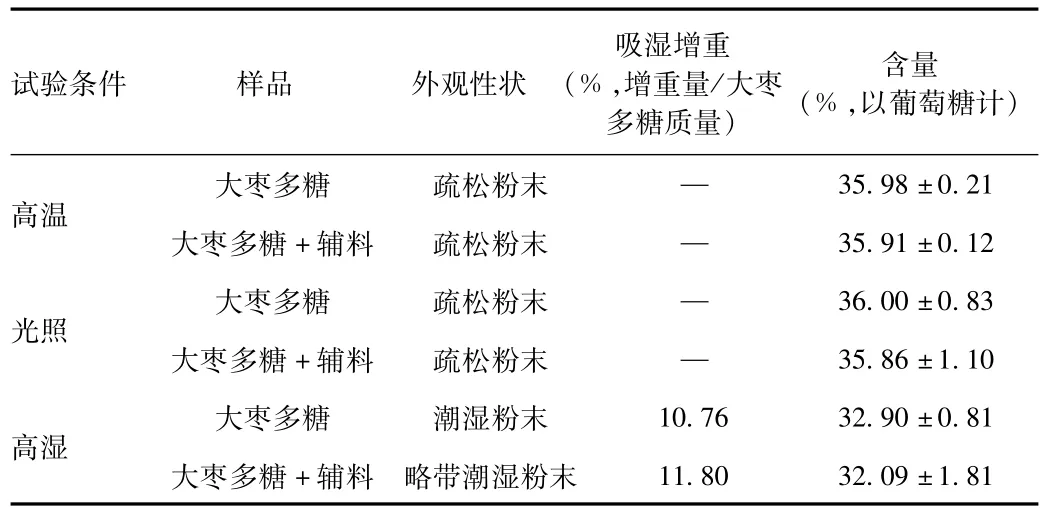
表2 相容性试验结果Tab.2 Test results of compatibility test
由表2可知,在高温60℃条件下,辅料对大枣多糖的外观没有明显影响,大枣多糖的含量没有明显变化。在强光照条件下,辅料对大枣多糖的外观没有明显影响,大枣多糖的含量没有明显变化。在相对湿度75%的高湿条件下,辅料的加入稀释了大枣多糖因而改善了外观,但是单纯的物理混合并没有改善大枣多糖的吸湿性。此外,辅料的加入没有使得大枣多糖的含量有明显变化。
综合以上结果,说明原料药大枣多糖与辅料相容性良好,辅料的加入对大枣多糖的含量和外观性状无影响。
2.3 原料药及辅料的粉体学性质研究结果 大枣多糖及辅料的松密度、振实密度和休止角测定结果如表3所示。压缩指数不仅反映了粉体的压缩成形性,同时也反映了粉体的流动性。一般的,当压缩指数[压缩指数=(振实密度-松密度)/振实密度×100%]小于20%时,粉体具有较好的流动性;压缩指数增大,粉体流动性随之下降,当压缩指数大于40%时,粉体的流动性较差。休止角直接反映了粉体的流动性,休止角越小说明流动性越好,一般认为休止角≤30°是流动性好,当休止角≤40°时可以满足生产过程中流动性的要求。因大枣多糖粉末和无水磷酸氢钙密度相差较大,在制备过程中易分层,宜制成颗粒。结合表3中数据可知,大枣多糖颗粒流动性较好,符合要求。
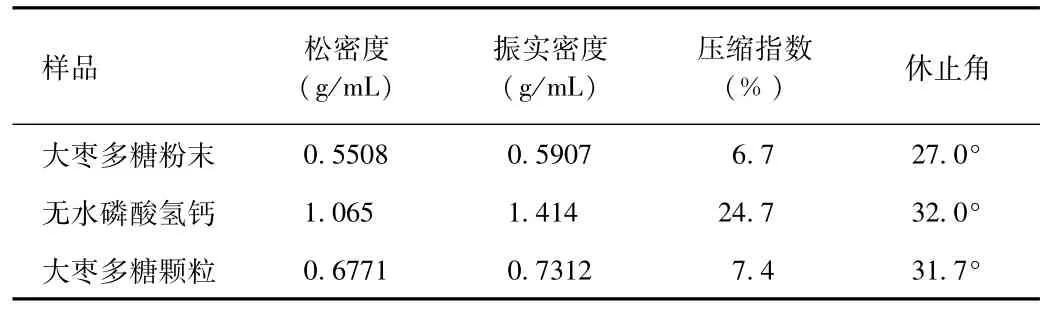
表3 粉体学性质Tab.3 Properties of powder
2.4 原料药及辅料的吸湿性考察结果 原料药及辅料的吸湿性考察结果如表4所示。由表中数据可知,大枣多糖粉末极具吸湿性,而无水磷酸氢钙无吸湿性。当大枣多糖和无水磷酸氢钙制成颗粒后,其吸湿性明显降低。
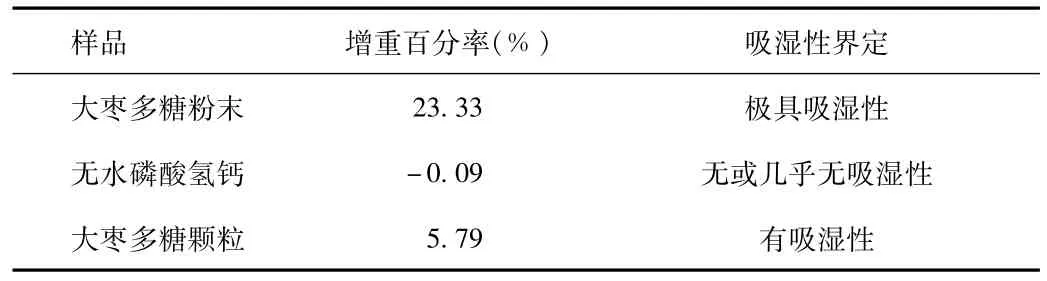
表4 吸湿性测定Tab.4 Determination of hygroscopicity
2.5 大枣多糖胶囊质量研究
2.5.1 鉴别:大枣多糖胶囊鉴别反应(斐林试剂反应和Molisch反应)的结果如表5所示。大枣多糖样品Molisch反应为阳性(+),说明含有糖类物质。大枣多糖样品斐林试剂反应呈阴性(-)说明不含游离还原性单糖,而水解液斐林试剂反应为阳性说明大枣多糖水解生成了还原性的单糖。
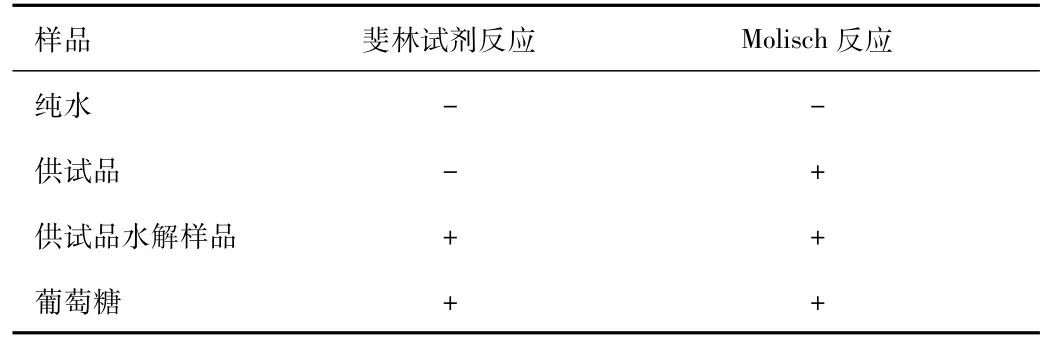
表5 多糖的鉴别Tab.5 Identification of polysaccharides
蛋白质鉴别反应(沉淀反应、双缩脲反应和茚三酮反应)的结果如表6所示。由表中结果可知,大枣多糖样品均为阴性结果,说明大枣多糖中不含蛋白质。

表6 蛋白质的鉴别Tab.6 Identification of proteins
2.5.2 含量测定
①专属性
空白辅料和大枣多糖胶囊内容物的溶液经苯酚-硫酸法显色后,紫外吸收图谱如图1所示,可见在200~700 nm范围内,空白辅料无明显吸收,对大枣多糖胶囊中大枣多糖的含量测定无影响,专属性良好。
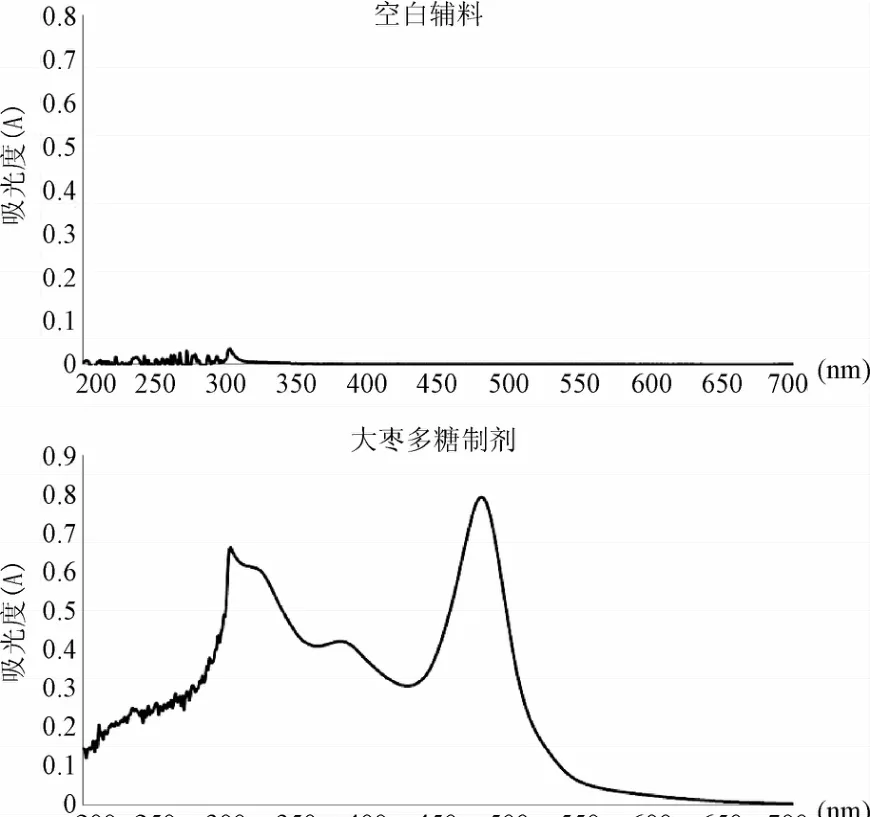
图1 空白制剂与大枣多糖胶囊的紫外吸收图谱Fig.1 UV spectra of the placebo formulation and jujube polysaccharide capsules
②标准曲线
将不同浓度的葡萄糖对照品溶液,按苯酚-硫酸法显色,在490 nm处测定吸光度值,吸光度值(Y)为纵坐标,样品浓度(X)为横坐标进行线性回归,得浓度-吸光度曲线的回归方程:Y=0.0076X+0.0097,R2=0.9992。如图2所示,在葡萄糖浓度为10~100μg/mL浓度范围内线性良好。
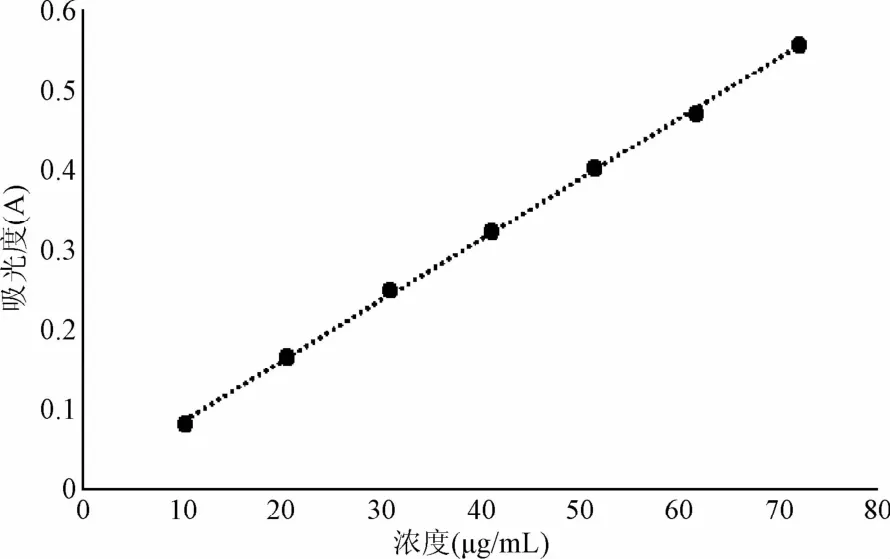
图2 标准曲线Fig.2 Calibration curve
③精密度
日内精密度和日间精密度结果如表7所示。结果表明,日内精密度和日间精密度RSD分别为0.84%和2.00%,符合要求。
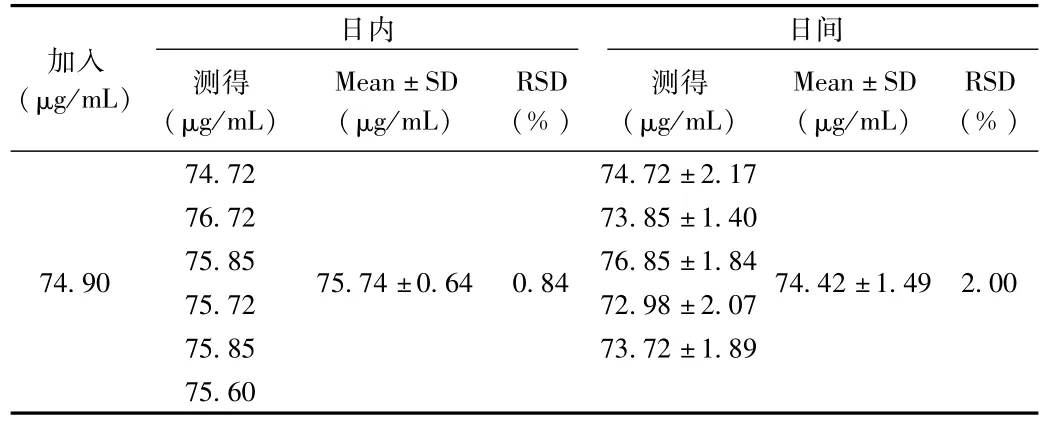
表7 精密度结果Tab.7 Precision within a day and between days
④稳定性
稳定性结果如表8所示,可知在大枣多糖胶囊内容物溶液在经苯酚-硫酸法显色后,样品在150 min内稳定,RSD为1.49%。
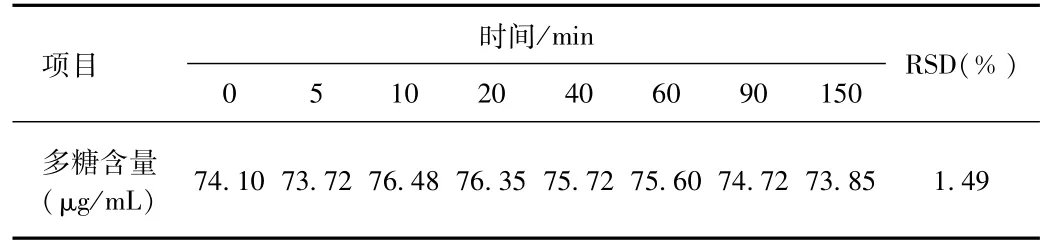
表8 稳定性结果Tab.8 Results of sample stability
⑤加样回收率
加样回收率结果如表9所示。结果表明加样回收率在99.94%~104.17%范围之内,加样回收率符合要求。
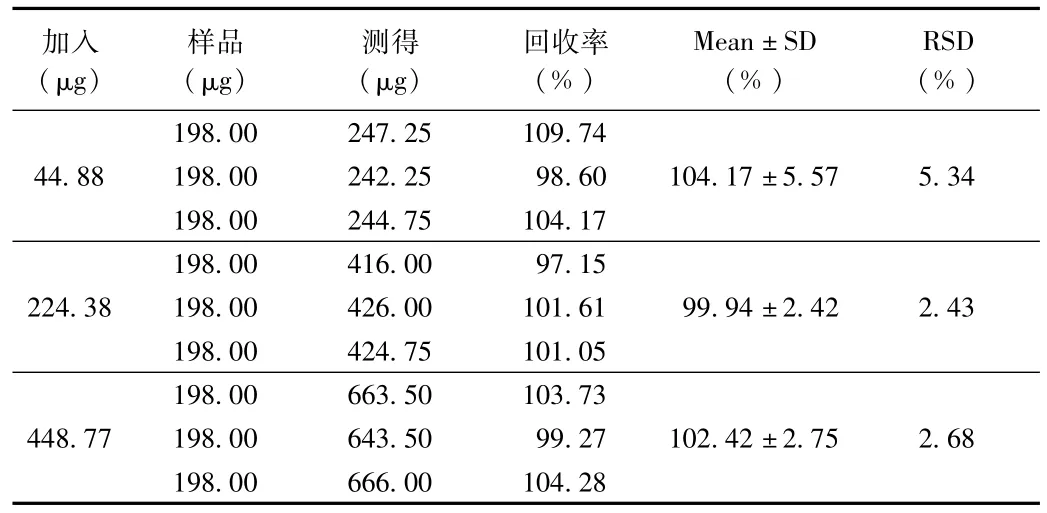
表9 加样回收率结果Tab.9 Results of recovery
⑥含量测定
通过苯酚-硫酸法测定了3批大枣多糖胶囊中的大枣多糖含量(以葡萄糖计),所得结果如表10所示,批次为2014325、20140409和20140411的大枣多糖的含量分别为标示量的99.08%、100.51%和101.54%。

表10 3批大枣多糖胶囊含量Tab.10 Contents of jujube polysaccharides in three batches
2.5.3 溶出度:溶出结果如图3所示。结果显示,大枣多糖在20min的溶出度均超过85%。
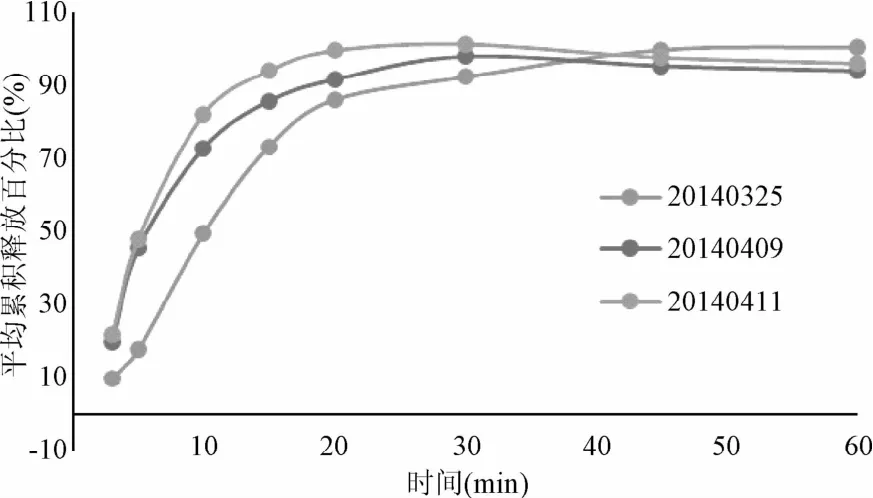
图3 大枣多糖胶囊溶出度曲线Fig.3 Dissolution curves of jujube polysaccharide capsules
2.5.4 装量差异:所取20粒大枣多糖胶囊,装量差异均未超出差异限度,平均装量(120.8±1.3)mg,RSD为1.1%,符合要求。
2.6 加速实验结果 检测结果表明3个批次大枣多糖胶囊的外观与鉴别均合格,其大枣多糖含量和溶出度结果如表11所示。由表可知,各项稳定性指标基本无变化,表明大枣多糖胶囊稳定性良好。
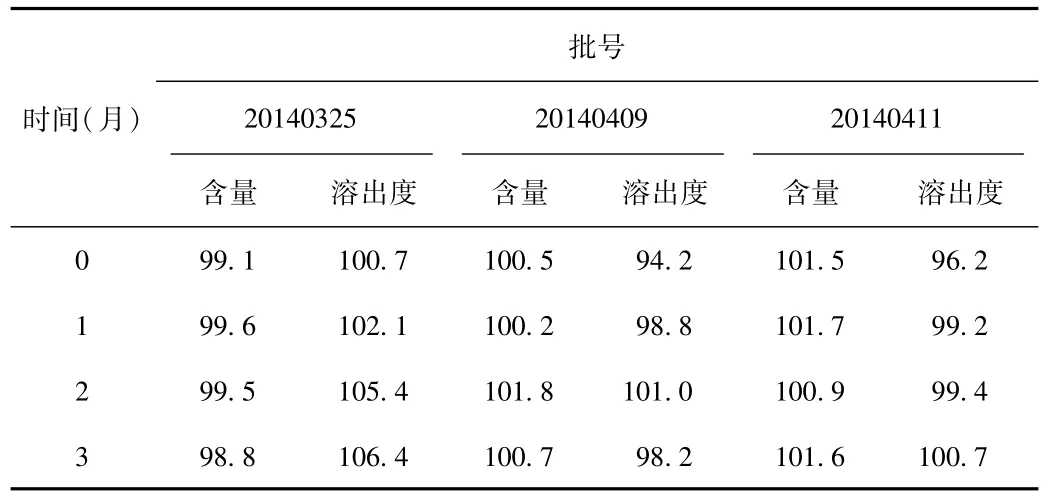
表11 加速稳定性试验结果(%)Tab.11 Results of accelerated stability testing(%)
3 讨论
我国枣资源十分丰富,具有极高的食用和药用价值。其中,大枣多糖具有突出的生物活性,揭示了其良好的应用前景。目前已上市的枣类产品多为粗加工保健食品,对大枣多糖剂型的研究报道较少。本实验将大枣多糖和适宜的辅料制备得到了黄河滩枣大枣多糖提取物的胶囊制剂,该制剂具有方便携带,服用方便,顺应性好的优点,为黄河滩枣大枣多糖的给药提供了可靠途径。
此外,本实验还对大枣多糖的质量控制和稳定性进行了初步研究。所采用的苯酚-硫酸测定法对大枣多糖的含量分析操作简单,精密度高,重复性好,精确可靠。处方前实验结果表明,从黄河滩枣中提取的大枣多糖对光照和高温稳定,但易吸湿,因此需要筛选合适的辅料、制剂工艺以及最终制剂的包装和储存。本实验选用无水磷酸氢钙为主要辅料制备了黄河滩枣大枣多糖胶囊,该胶囊制剂制备方法简单,且价格低廉。因其所选用的辅料不具有吸湿性,使得大枣多糖制剂颗粒的吸湿性大大降低。经过带有干燥剂的、感应封口的药用聚乙烯塑料瓶包装后,3批胶囊制剂的加速稳定性试验结果证明所开发的黄河滩枣大枣多糖胶囊符合多糖制剂要求,为黄河滩枣大枣多糖制剂进一步的产业化开发奠定了坚实的制剂研究基础。
[1]Guo S,Duan JA,Qian D,etal.Rapid Determination of Amino Acids in Fruits of Ziziphus jujuba by Hydrophilic Interaction Ultra-High-Performance Liquid Chromatography Coupled with Triple-Quadrupole Mass Spectrometry[J].J Agric Food Chem,2013,61(11):2709-2019.
[2]Pawlowska AM,Camangi F,Bader A,et al.Flavonoids of Zizyphus jujuba L.and Zizyphus spina-christi(L.)Willd(Rhamnaceae)fruits[J].Food Chem,2009,112(4):858-862.
[3]Guo S,Duan JA,Qian D,et al.Rapid Determination of Amino Acids in Fruits of Ziziphus jujuba by Hydrophilic Interaction Ultra-High-Performance Liquid Chromatography Coupled with Triple-Quadrupole Mass Spectrometry[J].JAgric Food Chem,2013,61(11):2709-2719.
[4]Gao QH,Wu PT,Liu JR,et al.Physico-chemical properties and antioxidant capacity of different jujube(Ziziphus jujuba Mill.)cultivars grown in loess plateau of China[J].Sci Hortic,2011,130(1):67-72.
[5]Li J,Fan L,Ding S,et al.Nutritional composition of five cultivars of chinese jujube[J].Food Chem,2007b,103(2):454-460.
[6]Zhao Z,Liu M,Tu P.Characterization of water soluble polysaccharides from organs of Chinese Jujube(Ziziphus jujuba Mill.cv.Dongzao)[J]. European Food Res Technol,2007,226(5):985-989.
[7]中华人民共和国国家药典委员会.中国药典[S].一部.北京:化学工业出版社,2010:21-22.
[8]Yu L,Jiang BP,Luo D,et al.Bioactive components in the fruits of Ziziphus jujuba Mill.against the inflammatory irritant action of Euphorbia plants[J].Phytomedicine,2012,19(3-4):239-244.
[9]Kubata H,Morii R,Kojima Yuasa A,et al.Effect of Zizyphus jujuba extract on the inhibition of adipogenesis in 3T3-L1 preadipocytes[J]. Am JChin Med,2009,37(3):597-608.
[10]Wang B.Chemical characterization and Ameliorating effect of polysaccharide from Chinese jujube on intestine oxidative injury by ischemia and reperfusion[J].Int J Biol Macromol,2011,48(3):386-391.
[11]Zhao Z,Li J,Wu X,et al.Structures and immunological activities of two pectic polysaccharides from the fruits of Ziziphus jujuba Mill.cv.jinsixiaozao Hort[J].Food Res Int,2006,39(8):917-923.
[12]郝蕾蕾,张典瑞,赵忠熙,等.柱前衍生化HPLC法测定黄河滩枣多糖的单糖组成[J].中国生化药物杂志,2012,33(6):740-743.
[13]国家食品药品监督管理局.药物研究技术指导原则[M].北京:中国医药科技出版社,2006.
[14]中华人民共和国国家药典委员会.中国药典[S].二部.北京:化学工业出版社,2010:附录208.
[15]中华人民共和国国家药典委员会.中国药典[S].二部.北京:化学工业出版社,2010:附录85.
(编校:王俨俨)
Preparation and characterization of capsule formulations of polysaccharides from Zizyphus Jujuba cv.Huanghetanzao
ZHAO Zhong-xi1Δ,CHENG Hui-ling2Δ,YANGMin1,LIU Xin-quan1
(1.School of Pharmaceutical Sciences,Shandong University;Center for Pharmaceutical Research&Drug Delivery Systems,Shandong
University,Jinan 250012,China;2.Medical Research Center,Shandong Provisional Qianfoshan Hospital,Jinan 250014,China)
ObjectiveTo prepare capsule formulations containing polysaccharides extracted from Zizyphus Jujuba cv.Huanghetanzao and evaluate the characteristics of the newly prepared capsules.MethodsPreformulation properties of the isolated polysaccharides and their compatibilitywith suitable excipients were first evaluated.Appropriate capsule formulations were then developed for the jujube polysaccharides isolated from Zizyphus Jujuba cv.Huanghetanzao.The contents and in-vitro dissolution of the polysaccharides in the capsules were determined by using a phenol-sulfuric acid method and newly developed dissolutionmethod,respectively.The analytical characterization and accelerated stability study of the capsuleswere also conducted.ResultsThe phenol-sulfuric acid method used for the polysaccharide analysis was found to have a good linearity(R2=0.9992),within-day and between-day precision and appropriate recovery.The analytical characterization results indicated that the incompatibility issues between the selected excipients and jujube polysaccharideswere notobserved.The newly prepared polysaccharide capsule formulations conformed to the quality standards.The finished capsuleswere packaged in pharmaceutical-grade high density polyethylene bottles with induction seals and undergone the accelerated stability testing.The stability testing results indicated that in the final productswere stable for at least3months under the standard accelerated conditionsof40oC/75%RH.Conclusion The capsule formulations for the polysaccharides extracted from Zizyphus Jujuba cv.Huanghetanzao developedingwith appropriate composition and preparing processes in the work.The capsule preparing process is simple and robust for large scale manufacturing.The final capsule products are found to be stable and controllable.
Zizyphus Jujuba cv.Huanghetanzao;polysaccharides;capsules
R944.5
A
1005-1678(2014)08-0162-06
国家重点基础研究发展计划(2012CB126315)
刘新权,男,研究生,研究方向:药物新剂型与新技术,E-mail:muyoulxq@163.com;程惠玲,通信作者,副主任药师,研究方向:免疫学检验,E-mail:chenghuiling2006@163.com;赵忠熙,通信作者,教授,博士生导师,研究方向:药物分析学,E-mail:zxzhao@sdu.edu.cn。

