采煤塌陷区鱼塘浮游植物群落特征及变动规律
田功太,巩俊霞,杜兴华 许国晶,张金路,张明磊 (山东省淡水渔业研究院,山东 济南 250013)
栗明,李敏 (上海海洋大学生命学院,上海 201306)
马亚梅 (山东省鱼台县渔业技术推广站 ,山东 鱼台 272300)
段登选,王春生 (山东省淡水渔业研究院,山东 济南 250013)
采煤塌陷地是宝贵的国土资源,对其进行有效复垦和改造利用是关系到矿区生态环境安全、失地农民就业、社会综合发展等多方面的重要问题。目前,山东省济宁、枣庄等市因地制宜,根据不同塌陷类型,对采煤塌陷地进行了池塘、湿地、大水面等多种形式的渔业改造和利用。采煤塌陷地区域是一个独特的生态系统,尤其在进行渔业改造之后,其在生物、生态、理化因子等诸方面都有了显著的变化,但目前还缺乏这方面深入系统的研究。浮游植物是采煤塌陷区养殖水域生态系统的重要组成部分和主要初级生产者,对塌陷区水域生态系统的物质循环、能量流动、信息传递等都起着至关重要作用[1-3]。本研究对塌陷地改造而成的养殖鱼塘浮游植物群落组成和变动规律进行了调查,从水体微生态系统的结构特征及变化特点方面进行了探讨,以期为今后这些宝贵国土资源的高效渔业利用提供参考。
1 材料与方法
1.1 采样地点和时间
池塘水样采自于山东济宁鱼台浩洋生态有限公司草鱼成鱼养殖池。采样时间为2013年7月16日至10月16日,每10d左右采样1次,共采样9次。
1.2 样本采集和处理
样本采集按照《淡水浮游生物研究方法》[4]及Hillebrand等[5]的方法进行。用4L采水器取池塘表层0.5m深处水3~4次置于水桶中,混匀后取1000ml放于塑料瓶中,加入15ml鲁哥试剂固定,摇匀后在实验室静置48h,取30ml沉淀浓缩液;计数时将浓缩液摇匀,取0.1ml置于0.1ml计数框中,在光学显微镜下观察50个视野,每个水样观察2片,每片数值不超出其均值的±15%,否则计第3片,将所得数值换算成每升水体中浮游植物个数和重量。浮游植物鉴别方法按韩茂森等[6]和胡鸿钧等[7]的方法进行。
1.3 生物指数计算方法
为避免单一指数造成误差,采用以下多种生物指数进行评价。

浮游植物优势种的确立方法:根据罗民波等[11]方法进行,即据某一浮游植物物种的出现频率及个体数量来确定优势种,用优势度 (Y)表示。公式如下:Y=fi×ni/n
式中:N为同一样品藻类个体总数,S为藻类总种数,ni为第i种藻类个体数,Y为优势度,fi为样品中某个种属的出现频率,当Y≥0.02时为优势种。各生物指数计算采用Excel2003进行。
2 结果与分析
2.1 塌陷地池塘浮游植物种类组成
共检出浮游植物8门69种 (属)。其中蓝藻门 (Cyanophyta)10种 (属),占总种 (属)的14.49%,以席藻 (Phormidium)、尖头藻 (群体)(Raphidiopsis)、色球藻 (Chroococcus)、蓝纤维藻(Dactylococcopsis)数量较多;绿藻门 (Chloophyta)34种 (属),占49.27%,较多的有卵形衣藻(Platymonas subcordiformis)、小球藻 (Chlorella vulgaris)、四尾栅藻 (Scenedesmus)、尖细栅藻(Scenedesmus acuminatus)、四足十字藻 (Crucigenia tetrapedia)、胶带藻 (Gloeotaeniumloitelsbergerianum)、韦氏藻 (Westlla botryoides)、月牙藻 (Selenastrum bibraianum)等;硅藻门 (Bacillariophyta)5种 (属),占7.25%,以小环藻 (Cyclotella)、针杆藻 (Synedra)、菱形藻 (Nitzschia)等较多;隐藻门 (Cryptophyta)3种,占4.35%,以蓝隐藻 (Chroomonas)、啮蚀隐藻 (Cryptomons erosa)为主;甲藻门 (Dinophyta)3种,占4.35%,以裸甲藻 (Gymnodinium aerucyinosum)、光甲藻 (Glenodinium)为主;金藻门 (Chrysophyta)3种,占4.35%,以聚球藻 (Synechococcus)、卵形单鞭金藻 (Chromulina ovalis Klebs)常见;黄藻门 (Xanthophyta)仅见1种具针刺棘藻 (Centritractus belonophorus),占1.45%;裸藻门 (Euglenophyta)10种 (属),占14.49%,以膝曲裸藻 (Euglena geniculata)、梭形裸藻 (Euglena acus Ehrenberg)、剑尾陀螺藻 (Strombomonas ensifera)、爪形扁裸藻 (Phacus onyx Pochm)、圆形扁裸藻 (Phacus orbiculanis)、绿色裸藻 (Euglena viridis Ehrenberg)等常见 (表1)。

表1 塌陷地鱼塘浮游植物种属组成
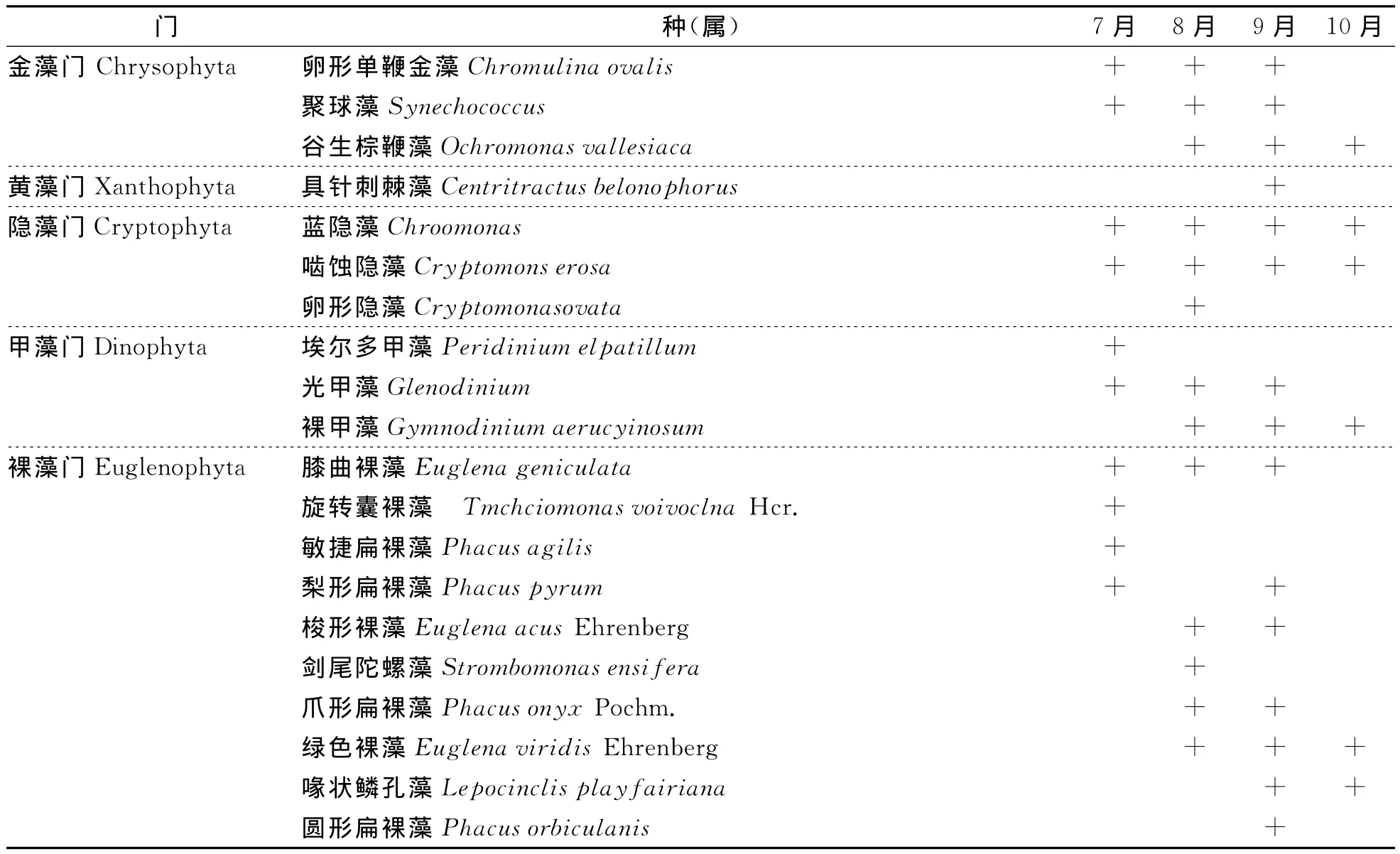
续表1
2.2 浮游植物优势种属及变化
7~10月共出现优势种15个,其中蓝藻门中的席藻、尖头藻、蓝纤维藻、色球藻占据较大优势,在9次采样中,除了10月1次尖头藻未形成优势种之外,其他皆为优势种群,而且优势度都较大;绿藻门中小球藻优势明显,在9次样品中有8次形成优势种,其他种类如卵形衣藻、四足十字藻、简单衣藻、波吉卵囊藻,虽然可以形成优势种群,但形成次数较少,仅在7月或9月或10月形成1~3次;隐藻中的啮蚀隐藻、蓝隐藻在7、8、9月皆可形成优势种群;硅藻中的小环藻可在7、8、9月形成优势种,针杆藻在8、9月形成优势种;金藻门中仅聚球藻可在8月形成1次优势种群 (表2)。
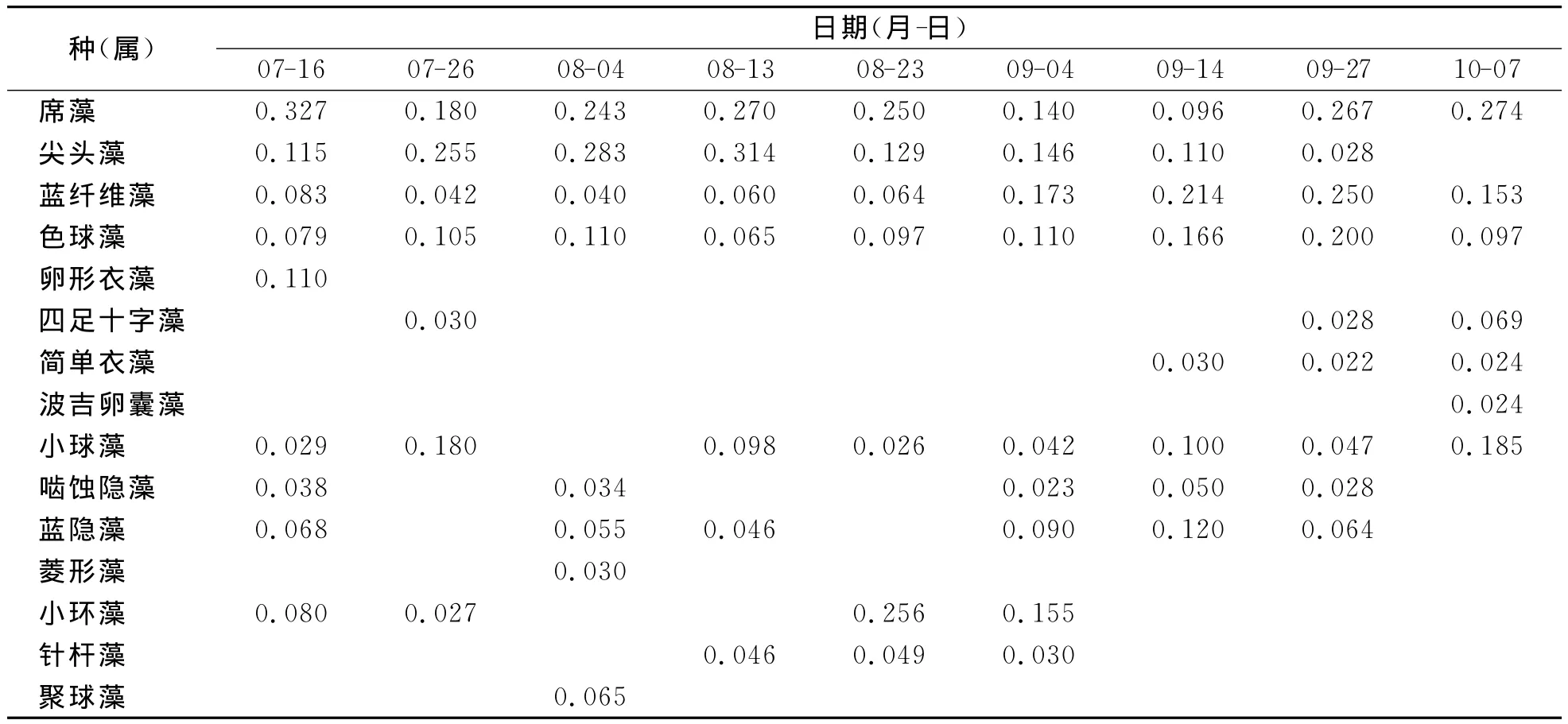
表2 浮游植物优势种属及优势度
2.3 塌陷地池塘浮游植物丰度动态变化
从藻类种类来看,7~9月份皆以蓝藻丰度最高,变化范围在0.0832~5.7469×107ind.·L-1,所占比例也最高,在48.02%~65.68%之间,其次为绿藻、硅藻、隐藻;金藻数量较低,变化范围在0.0224~0.1040×107ind.·L-1之间,比例在0.23%~2.79%之间;隐藻数量随月份波动较大,在0.0630~1.3510×107ind.·L-1之间,比例在4.43%~13.94%之间;甲藻相对变化较小,数量在0.0064~0.0980×107ind.·L-1之间,比例在0.18%~1.02%之间;裸藻变化范围也较小,数量在0.0114~0.1298×107ind.·L-1之间,比例在0.80%~2.65%之间;黄藻仅在9月出现,数量和比例都很少。
从不同月份来看,以9月浮游植物丰度最高,平均为9.6927×107ind.·L-1;其次为8月,平均丰度为6.65×107ind.·L-1;再次为7月,平均丰度为3.7218×107ind.·L-1;以10月最低,平均丰度为1.4227×107ind.·L-1(表3)。
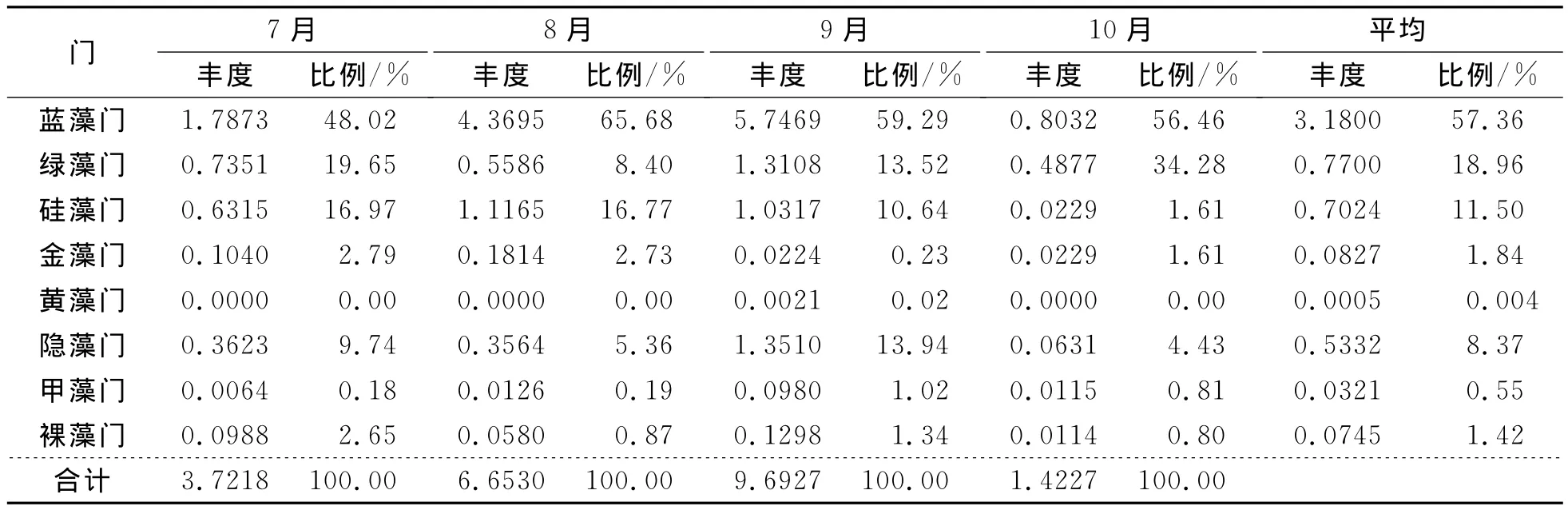
表3 各月份浮游植物丰度
2.4 塌陷地池塘浮游植物生物量动态变化
各种藻类生物量在不同月份的变化为:7月份隐藻、硅藻、绿藻生物量相近且较大,分别为2.72、2.58、2.06mg·L-1,分别占总生物量的25.68%、24.36%、19.45%;蓝藻、裸藻生物量相近,分别为1.33、1.35mg·L-1,分别占总生物量的12.56%和12.75%;黄藻、金藻、甲藻生物量较小,分别为0.00、0.17、0.38mg·L-1,所占比例较低,分别占总生物量的0.00%、1.61%、3.59%。8月硅藻生物量明显上升至第1位,达10.34mg·L-1,比例为42.62%;裸藻、甲藻、金藻上升明显,生物量分别为5.59、0.89、0.89mg·L-1,分别占总生物量的23.04%、3.67%、3.67%;而绿藻与7月相比有明显下降,生物量为1.21mg·L-1,比例为4.99%;隐藻变化不大。9月份黄藻首次出现,生物量为0.03mg·L-1,比例为0.07%;裸藻、隐藻、绿藻、甲藻生物量明显上升,分别为11.26、10.27、2.95、7.09mg·L-1,分别占总生物量的25.08%、22.87%、6.57%、15.79%;金藻生物量下降为0.25mg·L-1,比例为为0.56%;硅藻、蓝藻变化不大。10月份藻类生物量总体大幅下降,但绿藻、蓝藻、甲藻、金藻比例上升,分别占总生物量的17.69%、13.27%、22.6%、1.72%,尤其是甲藻上升特别明显,占优势地位;硅藻、隐藻、裸藻比例下降,分别占总生物量的7.13%、14.99%、22.60%;黄藻消失。
7~10月期间,各门藻类生物量变化范围分别是蓝藻0.54~2.78mg·L-1,月均1.8350mg·L-1,平均占8.75%;绿藻0.72~2.95mg·L-1,月均1.7350mg·L-1,平均占8.28%;硅藻0.29~10.34mg·L-1, 月 均 5.87mg·L-1, 平 均 占 28.01%;金 藻 0.07~0.89mg·L-1, 月 均0.3450mg·L-1,平均占1.65%;黄藻0.00~0.03mg·L-1,月均0.0075mg·L-1,平均占0.04%;隐藻0.61~10.27mg·L-1,月均4.0630mg·L-1,平均占19.38%;甲藻0.38~7.09mg·L-1,月均2.32mg·L-1,平均占11.08%;裸藻0.92~11.26mg·L-1,月均4.78mg·L-1,平均占22.81%。7~10月各门藻类月均生物量大小排序为硅藻门>裸藻门>隐藻门>甲藻门>蓝藻门>绿藻门>金藻门>黄藻门 (表4)。
浮游植物总体生物量在不同月份的表现特点为:7月份浮游植物总生物量为10.59mg·L-1,8月份明显上升,达24.26mg·L-1L,9月份迅速上升达最大值44.9mg·L-1,10月份大幅下降为4.07mg·L-1,不同月份间浮游植物总生物量大小排序为9月>8月>7月>10月,且各月份总生物量之间差异显著 (P≤0.01)(表4)。
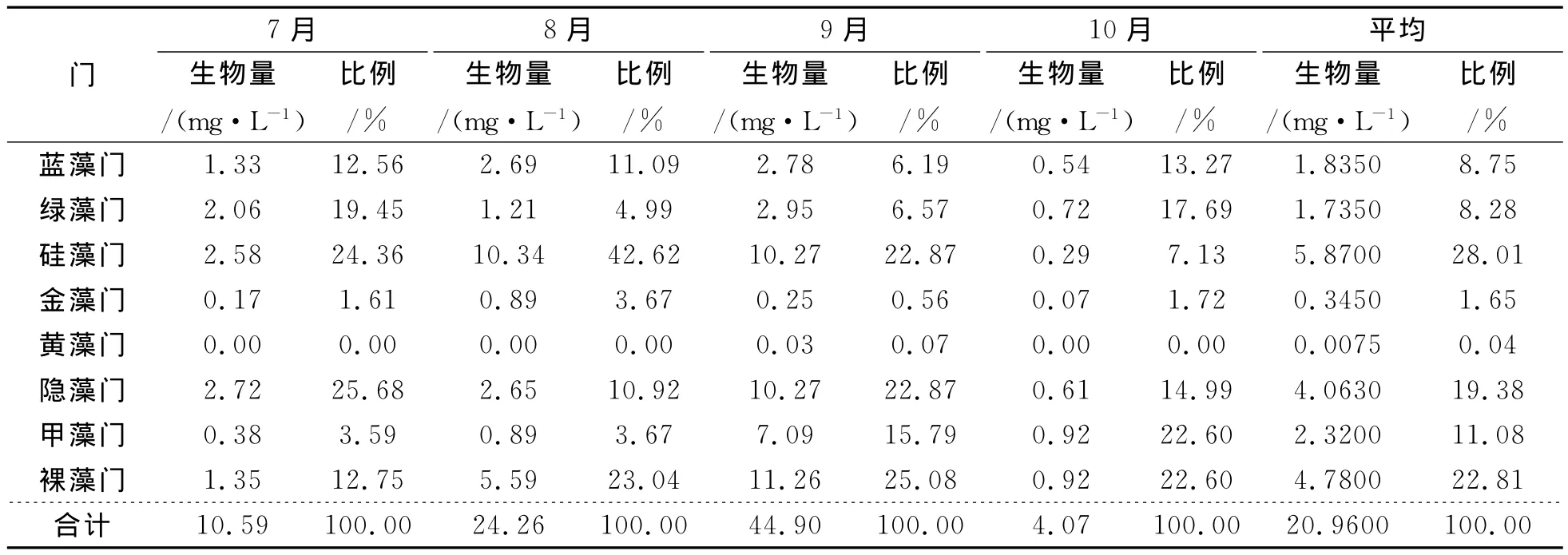
表4 各月份浮游植物生物量
2.5 浮游植物多样性变化
7~10月浮游植物多样性指数H′的变化范围为3.11~3.34,以8月份最低,为3.11;10月份最高为3.34;7、9月相近。物种丰富度指数D的变化范围为3.82~4.53,其中以9月份最低,为3.82;10月份最高,为4.53;7、8月数值相近。物种均匀度指数J的变化范围为0.6305~0.7105,以8月最低,为0.6305,10月最高,为0.7105;7、9月数值相近。各月份多样性指数H′与物种均匀度指数J的变化趋势一致,而与物种丰富度指数D的变化趋势有一定差异 (表5)。
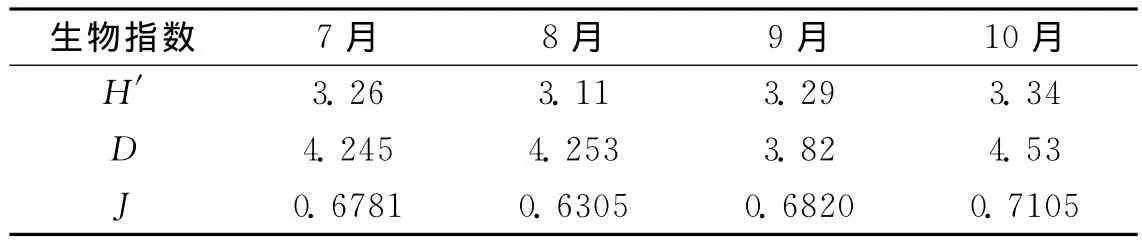
表5 浮游植物多样性指数
3 讨论与结论
3.1 采煤塌陷地池塘浮游植物群落特征及变化
从浮游植物种类组成来看,浮游植物共计8门69种 (属),共出现优势种属15个。其中以绿藻门最多,共34种属,占总种 (属)数的49.27%,优势种属5个,占总优势种属的33.33%,其中卵形衣藻、四足十字藻、简单衣藻、波吉卵囊藻可在7、9、10月形成优势种,小球藻在7、8、9、10月皆可形成优势种;蓝藻门10种 (属),占总种 (属)的14.49%,优势种属4个,占总优势种属的26.67%,其中席藻、尖头藻 (群体)、色球藻、蓝纤维藻优势度明显,7~10月皆可形成优势种群;裸藻门10种(属),占总种 (属)数14.49%,以膝曲裸藻、梭形裸藻、剑尾陀螺藻、爪形扁裸藻、圆形扁裸藻、绿色裸藻等常见,但未形成明显的优势种群;硅藻门5种 (属),占总种 (属)数7.25%,其中小环藻、针杆藻、菱形藻可在7~9月形成优势种群;隐藻门3种,占总种 (属)数4.35%,优势种2个,占优势种的13.33%,其中蓝隐藻、啮蚀隐藻可在7~9月形成优势种群;甲藻门3种,占总种 (属)数4.35%,以裸甲藻、光甲藻常见,但未形成优势种群;金藻门3种,占总种 (属)数4.35%,其中聚球藻仅在8月形成优势种;黄藻门仅1种具针刺棘藻,占1.45%。巩俊霞等[12]研究了利津陈庄重盐碱地南美白对虾养殖池中的浮游植物,共检出藻类8门147种,藻相种类结构为绿藻占46%,蓝藻占14%,裸藻占14%,硅藻占12%,隐藻占3%,甲藻占5%,金藻占5%,黄藻占1%。虽然浮游植物总种类数与该研究结果差别较大,但藻相比例结构却与该研究结果比较相近,其中原因尤其是决定藻相结构的关键因子有待今后深入研究。据姚宏禄[13]对综合养鱼高产池塘的研究结果,高产池塘浮游植物主要是由隐藻 (Cryptophyta)、膝口藻 (Gonyostomum)、蓝裸甲藻 (Gymnodinium eucyaneum Hu)、角甲藻 (Ceratium)、裸藻、空球藻 (Eudorina)、衣藻 (Chlamydomonas)、棕鞭藻 (Ochromonas sp.)等鞭毛藻类和硅藻、大型绿球藻等优势种属交替形成水华,各型鱼塘浮游植物群落的共同特点均是以隐藻为主的鞭毛藻类为优势种属。该研究中出现的鞭毛藻优势种属有卵形衣藻、简单衣藻、蓝隐藻、啮蚀隐藻4种,占优势种的26.67%,另外裸藻中的一些鞭毛种类如膝曲裸藻、梭形裸藻、剑尾陀螺藻、爪形扁裸藻、圆形扁裸藻、绿色裸藻,虽然是池塘中的常见种属,但未形成优势种群。从优势种属的浮游植物组成来看,该研究中鞭毛藻优势种类数偏低,这可能与池塘条件、养殖方式等多方面因素有关。
从浮游植物丰度来看,以蓝藻最大,丰度为3.18×107ind.·L-1,其次为绿藻,丰度为0.77×107ind.·L-1,再次为硅藻、隐藻,丰度分别为0.7024×107ind.·L-1和0.5332×107ind.·L-1,而黄藻、甲藻、裸藻、金藻丰度较小。蓝藻在含氮量高、有机质丰富的碱性水体中常见,特别是在高温季节易大量繁殖[14]。蓝藻生长的最适温度为25~35℃[15],这与山东地区7~9月鱼池较高的水温相契合,同时因为池塘中养殖了草鱼,每天都定量投喂人工饵料,鱼类的残饵粪便使得池水氮、磷水平增高,为蓝藻大量繁殖提供了条件。蓝藻的大量繁殖或者生长季节延长,是水体富营养化的一个标志[16]。目前对采煤塌陷区水域藻类演变规律相关研究报道很少,郭友红[17]对邹城采煤塌陷区的6种水体浮游植物进行了研究,结果显示对于同一水域不同种类浮游植物数量分布,平阳寺塌陷积水区、网箱区、北宿精养鱼塘均为蓝藻门>绿藻门>硅藻门,平阳寺精养鱼塘、北宿塌陷积水区、北宿网箱养殖区均为绿藻门>蓝藻门>硅藻门。其结果与本研究结果基本相同。
根据各藻类生物量大小来看,以硅藻、裸藻、隐藻3种藻优势较大,其月均生物量分别达5.87、4.78、4.063mg·L-1,分别占总体生物量的28.01%、22.81%、19.38%。之所以硅藻、隐藻、裸藻生物量较大,除了与池塘水质条件有关之外,还与藻类习性、其他环境条件等因素密切相关。硅藻、隐藻、裸藻都是普生性种类,对温度适应性很强,隐藻对光照不敏感,一年四季皆可形成优势种,裸藻喜欢生活在有机质丰富的投饵性鱼池水体中,在阳光充足的季节常大量繁殖形成优势种[14]。隐藻之所以能有较大的生物量还与其具有较高的繁殖率有关,其世代时间很短,在0.8~3d之间[18]。姚宏禄[13]对青草鱼并重型高产鱼池中浮游植物的研究结果显示,其生物量组成为:隐藻8~16mg·L-1,占26.32%;裸藻8~16mg·L-1,占26.01%;绿球藻3.6mg·L-1,占9.33%;蓝藻3~6mg·L-1,占9.28%;硅藻2~4mg·L-1,占6.26%;其他绿藻及甲藻、金藻7~12mg·L-1,占22.8%。其中隐藻、裸藻等鞭毛藻类生物量约占总生物量的52.33%,明显高于本研究隐藻、裸藻类生物量比例(42.19%)。而本研究中硅藻生物量比例最高,裸藻次之,隐藻再次之,三者生物量约占70.20%,说明该采煤塌陷地鱼池浮游植物群落属硅藻、裸藻、隐藻类型。
从不同月份来看,鱼塘中浮游植物种类数、优势种数量、藻类丰度、生物量皆以9月最高,其次为8月,再次为7月,最低为10月,这主要与水温、营养物质含量与季节的变化密切相关。因为温度是限制浮游生物密度的重要生态因子,环境条件的改变能直接或间接影响浮游生物群落结构[19]。6月份鱼池水温虽然比较适宜藻类生长,但池塘营养物质积累量不够,故一般藻类不会大量繁殖;7、8月份鱼池水温过高,限制了某些藻类快速生长和大量繁殖;9月份,水温从最高点下降至藻类繁殖生长的适宜范围,同时随着养殖时间的持续,各种营养盐也积累到较高程度,适宜大多数普生性藻类的快速生长和繁殖,从而形成较大的生物量;10月份虽然营养物质积累量较多,但水温下降比较明显,大多数藻类的生长繁殖受到较大抑制,故藻类生物量下降比较明显。
3.2 采煤塌陷地池塘的生物多样性
生物多样性是反应生物群落组成的特征参数,是衡量群落稳定的重要尺度之一,浮游植物多样性指数反映了生物的多样性程度,其值越高,说明物种的种类越多,群落越稳定[20]。物种丰富度指数反映了物种丰富程度,其值越大,说明物种丰富度越高[21-22]。由表5可知,7~9月浮游植物多样性指数H′的变化范围为3.11~3.34,物种丰富度指数D的变化范围为3.82~4.53,H′、D值皆处于较高的水平,说明该池塘浮游植物的种类较多,丰富度较高。郭友红[17]对邹城6个塌陷水域进行了研究,6个水域的H′值在0.73~1.00之间,物种丰富度指数D值的范围在0.253~0.315之间,认为6个水域在污染加重状态下,浮游植物种类较少,分布不均匀,优势物种所占比例逐渐增大。这说明,即使同为采煤塌陷地类型养殖水域,浮游植物多样性也会因其养殖方式、养殖时间、养殖品种等因素的不同而各有不同的表现特征。
3.3 采煤塌陷地池塘水质营养类型藻类生物学评价
在水质肥沃的水域或某些大型浮游植物形成优势种群的情况下,浮游植物数量与生物量表观不完全一致,在这种情况下仅用浮游植物数量不能够准确表示水体的营养状况,因此本研究利用浮游植物生物量对水质营养状况进行评价。据表4相关数据并结合况琪军等[23]的藻类生物学指标与评价标准 (表6),7、8、9月皆为极富营养类型,10月为中营养类型。
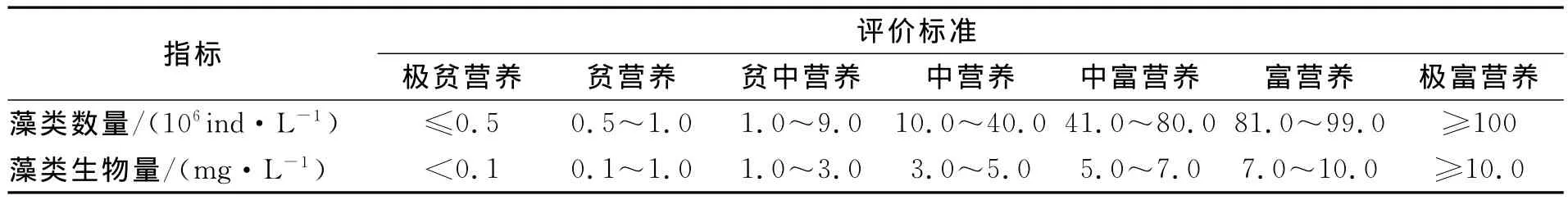
表6 水体营养类型评价的藻类生物学指标与标准
浮游植物的种类,也是反应水体营养状况的重要指标之一,某些藻类可作为水体营养状况的指示种[24];Nico等[25]也发现浮游植物优势种群的变化与湖泊的营养类型具有显著的相关性。7~9月份,浮游植物优势种和优势度几乎每次采样都以蓝藻优势最大,10月份蓝藻优势种数和优势度皆有明显减少,而绿藻优势种数和优势度皆有明显上升 (表2)。蓝藻被认为是水体富营养化的指示种类[26-27],7~9月份蓝藻占优势,说明水体富营养化态势明显。绿藻的大量出现并形成优势种群,一般被认为是中营养性类型[26]。10月份绿藻优势种数和优势度明显上升而蓝藻明显下降,说明水体已达中营养类型或正向中营养类型趋势过度。这与根据浮游植物生物量对水体营养状况的评价结果基本一致。
水体的营养类型与其N、P、K含量直接相关。因该采煤塌陷地池塘在塌陷之前为优质高产稻田,稻田经多年种植,其底泥中积累了丰富的N、P、K等营养元素,塌陷区经过改造成为养殖池塘后,泥土中的N、P、K等营养元素,会在养殖过程中逐渐释放,从而使得改造后的池塘水体呈现出较强的肥力。另外,由于该池塘主养了草鱼成鱼,每天定时人工投饵,鱼类的残饵、粪便也加剧了池塘水质的富营养化进程。且7~9月水温高,鱼类摄食量大,残饵粪便较多,N、P、K等营养元素含量丰富,池塘中的浮游生物生长快,浮游生物的数量和生物量自然就大,于是7~9月表现为极富营养状态;10月份水温开始下降,鱼类摄食量、投饵量减少,水体中的N、P、K等营养元素含量也随之降低。浮游植物受水温和营养两方面影响,生长速度大大减慢,其数量、生物量也相应降低,因此,水质相比7~9月有明显改善,表现为中营养类型。
[1]何志辉,李永涵.清河水库的浮游生物 [J].水生生物学集刊,1983,8(1):71-83.
[2]李敦海,李根宝,王高鸿,等.水花蓝藻生物质对沉水植物五刺金鱼藻生长的影响 [J].水生态学报,2007,31(5):689-692.
[3]张婷,宋立荣.铜绿微囊藻与三种丝状蓝藻间的相互作用 [J].湖泊科学,2006,18(2):150-156.
[4]张宗涉,黄祥飞.淡水浮游生物研究方法 [M].北京:科学出版社,1991.
[5]Hillebrand H,Dürselen C D,Kirschtel D,et al.Biovolume Calculation for pelagic and benthic microalgae [J].Journal of phycology,1999,35:403-424.
[6]韩茂森,束蕴芳.中国淡水生物图谱 [M].北京:海洋出版社,1995:2-129.
[7]胡鸿钧,魏印心.中国淡水藻类系统、分类及生态 [M].北京:科学出版社,2006:23-915.
[8]Shannon C E,Weaver W.The mathematical Theory of Communication [M].Urbana IL:University of Illinois Press,1949.
[9]Margale F R.Perspective In Ecologiceal Theory [M].Chicago:University of Chiago Press,1968.
[10]Pielou E C.Ecological Diversity [M].New York:Wiley Inters,1975.
[11]罗民波,陆健健,王云龙,等.东海浮游植物数量分布与优势种 [J].生态学报,2007,27(12):5076-5085.
[12]巩俊霞,段登选,王志忠,等.重盐碱地南美白对虾养殖池塘浮游植物的研究 [J].河北渔业,2009,(8):10-28.
[13]姚宏禄.综合养鱼高产池塘的浮游植物 [J].中国水产科学,1996,3(1):64-70.
[14]李永涵.淡水生物学 [M].北京:高等教育出版社,1993:19-41.
[15]李晓钰,于洪贤,马成学.松花江哈尔滨段浮游植物群落典范对应分析及生物多样性分析 [J].东北林业大学学报,2013,40(10):103-107.
[16]饶钦止,章宗涉.武汉东湖浮游植物的演变 (1956-1975年)和富营养化问题 [J].水生生物学集刊,1980,7(1):1-15.
[17]郭友红.采煤塌陷区水体生物多样性调查 [J].中国农学通报,2010,26(10):319-322.
[18]唐汇娟,谢平,刘丽,等.武汉东湖浮游植物群落结构的时空变化与环境因子的关系 [J].中山大学学报 (自然科学版),2008,4 (3):100-104.
[19]武发思,鄢金灼,蔡泽平,等.大、小苏干湖浮游藻类的群落组成特点研究 [J].水生生物学报,2009,33(2):264-270.
[20]邱小錝,赵红雪.宁夏沙湖浮游植物群落结构及多样性研究 [J].水生态学杂志,2011,32(1):20-25.
[21]陈燕琴,申志新,刘玉婷,等.澜沧江囊谦段秋季浮游植物群落结构的初步研究 [J].水生态学杂志,2012,33(3):60-67.
[22]郭沛涌.东平湖浮游植物与水质评价 [J].海洋湖沼通报,1997,(4):37-42.
[23]况琪军,马沛明,胡征宇,等.湖泊富营养化的藻类生物学评价与治理研究进展 [J].安全与环境学报,2005,5(2):87-91.
[24]刘宇,沈建忠.藻类生物学评价在水质监测中的应用 [J].水利渔业,2008,28(4):5-7.
[25]Nico S,Giuseppe M,FabioB,et a1.Phytoplankton as an indicator of the water quality of the deep lake ssouth of the Alps [J].Hydrobiologia,2006,563:167-187.
[26]裴国风,曹金象,刘国祥,等.尼洋河不同河段浮游植物群落多样性差异研究 [J].长江流域资源与环境,2012,21(1):24-29.
[27]高世荣,孙凤英,潘力军,等.利用水中的生物多样性评价水质 [J].中国环境卫生,2006,9(3):33-40.

