桑叶发酵前后总黄酮、总酚酸含量变化及抗氧化活性研究
1.辽宁中医药大学 药学院,辽宁 大连 116600; 2.清华大学 工程物理系,北京 100084
桑叶发酵前后总黄酮、总酚酸含量变化及抗氧化活性研究
王吉成1,2刘轩2唐劲天2翟延君1*
1.辽宁中医药大学 药学院,辽宁 大连 116600; 2.清华大学 工程物理系,北京 100084
目的:比较桑叶70%乙醇提取物液体发酵前后的抗氧化活性,并考察发酵前后总黄酮、总酚酸含量的变化。方法:利用冠突散囊菌在桑叶70%乙醇提取物的液体培养基中发酵培养,将得到的发酵液和未发酵的桑叶70%乙醇提取物以抗坏血酸和EDTA为阳性对照,针对指定指标(DPPH、ABTS、FRAP、OH·、螯合能力)进行体外抗氧化活性试验;并对发酵前后总黄酮、总酚酸含量进行测定。结果:未发酵桑叶70%乙醇提取物的抗氧化活性整体优于液体发酵后的抗氧化活性。其中未发酵桑叶70%乙醇提取物对DPPH、ABTS、螯合能力的IC50值分别为:4.69mg·ml-1、2.03mg·ml-1、20.89mg·ml-1,而液体发酵后的桑叶70%乙醇提取物三者的IC50值分别为:12.42mg·ml-1、2.65mg·ml-1、14.81mg·ml-1;同时含量测定结果显示,发酵后桑叶中总多酚含量较发酵前明显下降,而发酵后桑叶中总黄酮含量却明显高于发酵前总黄酮含量。其中发酵前桑叶中总黄酮、总酚酸含量分别为4.39mg·ml-1、3.95mg·ml-1,而发酵后桑叶中总黄酮含量高达8.53mg·g-1,总酚酸却下降为1.24mg·g-1。结论:桑叶70%乙醇提取物液体发酵前后体外均具有一定的抗氧化活性,但发酵前抗氧化作用较明显。此外通过微生物转化,显著性提高桑叶中总黄酮含量的同时,却降低了桑叶中总酚酸含量,因此可以推测,桑叶中起到抗氧化作用的主要成分并非是黄酮类化合物,而是非黄酮类的多酚类成分。
桑叶;冠突散囊菌;液体发酵;抗氧化;总黄酮;总多酚
冠突散囊菌,又称“金花”菌,是茯砖茶的优势菌种。它可以降低茶叶原料的涩味,同时自身带来的菌花香及发酵过程中产生的色素都增强了茶汤的品质[1]。在生产、储存和治疗评价中,将冠突散囊菌的质量和数量作为判断茯砖茶品质优劣的标志。
桑叶为桑科植物MorusalbaL.的干燥叶。始载于《神农本草经》,列为中品,历代本草均有收载。其性寒,味甘、苦,具有疏散风热、清肺润燥、清肝明目之功效,是常用中药之一[2]。桑叶中含有很多活性物质,如多酚类、黄酮类、生物碱类、多糖类、苯丙素类及甾醇类化合物[3]。近年来,有关桑叶的抗氧化活性的研究报道较多,但利用真菌液体发酵桑叶,并对其某一类活性物质含量以及抗氧化能力的研究未见报道。本试验利用从茯砖茶中分离得到的冠突散囊菌,对桑叶进行单一菌种的液体发酵,意在考察液体发酵对桑叶中抗氧化成分含量及能力的影响。
1 材料
1.1 原料与试剂 桑叶产自安徽(生产批号20130701),经辽宁中医药大学翟延君教授鉴定为桑科植物桑MorusabaL.的干燥叶;冠突散囊菌由清华大学工程物理系粒子技术与辐射成像教育部重点实验室分离获得并鉴定[4];马铃薯葡萄糖琼脂购自北京奥博星生物技术有限公司;芦丁购自成都曼斯特生物科技公司(纯度≥98%); 没食子酸购自成中国食品药品检定研究院(纯度≥98%);2,2’-连氨-(3-乙基苯并噻唑啉-6-磺酸)二氨盐(ABTS)购自Amresco公司;二苯代苦味酰基(DPPH)购自Alfa Aesar 公司;菲洛嗪购自A ALDRICH公司;水杨酸购自西陇化工股份有限公司;抗坏血酸购自共广州化学试剂厂;其余试剂均为分析纯;1.2 仪器与设备 VARIOSKAN FLASH型全波长扫描多功能读数仪为美国 Thermo Scientific 公司的产品;KQ 5200 DE型超声仪为昆山市超声仪器有限公司的产品;EYEL4旋转蒸发仪为日本EYELA公司的产品;Venticell烘箱为德国MMM公司的产品;DZE-6050型真空干燥箱为北京神泰伟业仪器设备有限公司;SVE-4A1型垂直流超净工作台为新加坡ESCO公司的产品;THZ-D型台式恒温振荡器为苏州培英实验设备有限公司的产品;AL204-IC型电子天平为梅特勒-托利多仪器(上海)有限公司的产品;SHZ-CB型循环水式真空泵为巩义市英峪予华仪器厂的产品;pH计为梅特勒-托利多仪器(上海)有限公司的产品;微量移液器为美国Thermo公司的产品;恒温培养箱为德国MMM公司的产品;NANOpure超纯水系统为美国Barnstead公司的产品;3-18K型超速离心机为美国Sigama公司的产品。
2 发酵处理方法
2.1 冠突散囊菌孢子悬液制备 参照本实验室前期研究茯砖茶中冠突散囊菌的分离纯化方法[4],将得到纯化后的冠突散囊菌在PDA平板培养基上培养,待4d后平板长满菌落,在无菌条件下,加5ml无菌水于平板上,用接种环将黄色闭囊壳刮下,悬浮于无菌水中,再将悬浮液吸入带有玻璃珠和95ml无菌水的三角瓶内,150r·min-1振摇30min,制成均匀的孢子悬液。调整孢子浓度为(5.0~6.0)×108cfu·mL-1。
2.2 桑叶液体培养基的制备 称取8g干燥桑叶于500ml锥形瓶内,加500ml 70%乙醇超声提取2次,每次45min。立即减压过滤,残渣用少量70%乙醇洗3次,合并滤液。浓缩至无醇味,加蒸馏水定容至1L。以邓放明[5]筛选的最优培养基配方作为参考,确定培养基成分为:含0.8%(m∶v)桑叶的浸提液,pH=5.5。配制好的培养基在120℃下高压蒸汽灭菌30min。
2.3 接种与发酵培养 将制备好的冠突散囊菌孢子悬液在无菌条件下接种到桑叶液体培养基中,使得接种量均为0.16(g∶ml)。以邓放明[5]筛选的最优培养基配方作为参考,发酵条件为30 ℃,120 r·min-1条件下培养7d。
3 桑叶中总黄酮、总酚酸含量测定
3.1 桑叶中总黄酮、总酚酸溶液的制备
3.1.1 未发酵桑叶中总黄酮、总酚酸溶液的制备 称取8g桑叶于500ml锥形瓶,加70%乙醇500ml超声提取2次,每次45min。立即减压过滤,残渣用少量70%乙醇洗3次,合并滤液,浓缩得浸膏。精密称取该浸膏0.2g(生药量),用3ml、70%乙醇超声提取20min,重复操作2次,最后用70%乙醇定容到10ml。制得0.02g·mL-1(生药浓度)的未发酵桑叶供试品溶液。
3.1.2 液体发酵7 d桑叶中总黄酮、总酚酸溶液的制备 将发酵7d的桑叶液体培养基抽滤,浓缩得浸膏。参照3.1.1方法中制备得到0.02 g·mL-1液体发酵7d桑叶供试品溶液。
3.2 总多酚含量测定
3.2.1 标准曲线绘制 参考文献[6],采用Folin-Ciocalteu比色法,稍作修改。吸取质量浓度为0.01~0.1mg·mL-1没食子酸标准溶液20μl于96孔板中,加入10%福林酚水溶液100μl,混匀,反应5min,加入7.5%碳酸钠溶液80μl,混匀,室温下反应60min,在765nm处测定吸光度值,绘制标准曲线:Y=5.8477X+0.0152,R2=0.9988。
3.2.2 样品总多酚含量测定 将发酵前后样品溶液按着3.2.1方法显色,测定吸光度。根据标准曲线方程计算样品中总多酚含量,结果表示为没食子酸当量(mg·g-1)。
3.3 黄酮含量测定
3.3.1 标准曲线绘制 参考文献[7],采用AlCl3显色法,略有修改。分别吸取质量浓度为0.4mg·mL-1、0.2mg·mL-1、0.1mg·mL-1、0.04mg·mL-1、0.02mg·mL-1、0.01mg·mL-1、0.005mg·mL-1的芦丁对照品溶液1ml,加2ml 0.1mol·l-1AlCl3和1ml醋酸-醋酸钠缓冲溶液(PH5.2),摇匀,40℃水浴10min,吸取200 μl反应液于96孔板中,在405nm处测定吸光度值。绘制标准曲线:Y=3.9748X-0.0032,R2=0.9996。
3.3.2 样品总黄酮含量测定 将发酵前后样品溶液按着3.3.1方法显色,测定吸光度。根据标准曲线方程计算样品中总黄酮含量,结果表示为芦丁当量(mg·g-1)。
4 体外抗氧化活性测定
供试品溶液制备:精密称取各样品0.5g(生药量),用2ml 70%乙醇溶解, 超声提取2次,最后用适量70%乙醇定容至5ml容量瓶中,制成质量浓度为100mg·ml-1样品溶液。用70%乙醇依次稀释,得到质量浓度为:20mg·ml-1、12.5mg·ml-1、5mg·ml-1、4mg·ml-1、2mg·ml-1、0.8mg·ml-1、0.16mg·ml-1、0.032mg·ml-1的供试品溶液。
4.1 对自由基清除能力的测定
4.1.1 DPPH自由基清除试验 采用Tagashira and Ohtake(1998)的方法略有改动。配置DPPH自由基测定液:称取7.88mg DPPH自由基,用无水乙醇溶解并定容与100 ml容量瓶中,配置成2×10-3mol·l-1的DPPH自由基溶液,于0~4℃避光保存,备用。测定:分别吸取各供试品溶液50μl于96孔板中,加入150μl DPPH自由基测定液,迅速混匀,37℃恒温反应30min,在510nm处测定吸光度。样品空白对照以无水乙醇代替DPPH自由基测定液,其余步骤与样品相同;阴性对照以70%乙醇代替样品溶液,其余步骤与样品相同。所有的测量值均做3个复孔取其平均值。Vc作为阳性对照。样品的抗氧化程度用对DPPH自由基的清除率表示,清除率越大,抗氧化活性越强,反之则弱。计算公式如下:
清除率=[1-(A1-A2)/A0]×100%
(A0为阴性对照组吸光度;A1为样品组吸光度;A2为样品空白对照组吸光度。)
4.1.2 ABTS+自由基清除试验 参考文献[8]和[9]的方法,并作适当修改。配制ABTS+自由基储备液:配制2.45mmol·l-1K2S2O8溶液和7.0mmol·l-1ABTS溶液,二者等体积混合,避光条件下静置16h,形成ABTS+自由基储备液。配制ABTS+自由基测定液:将ABTS+自由基储备液用溶剂稀释,使其吸光度在734nm波长处达到0.700±0.020。测定:吸取各供试品溶液50μl于96孔板中,加入150μl ABTS+自由基测定液,混匀,室温下反应30min,在734nm处测定吸光度。样品空白对照以水代替ABTS+自由基测定液,其余步骤与样品相同;阴性对照以70%乙醇代替样品溶液,其余步骤与样品相同。所有的测量值均做3个复孔取其平均值。Vc作为阳性对照。样品的抗氧化程度用对ABTS+自由基的清除率表示,清除率越大,抗氧化活性越强,反之则弱。样品对ABTS+自由基的清除率照下面公式计算:
清除率=[1-(A1-A2)/A0]×100%
(A0为阴性对照组吸光度;A1为样品组吸光度;A2为样品空白对照组吸光度。)
4.1.3 OH·自由基清除试验 参考文献[10]的方法,并作适当修改。制备OH·自由基体系:向5ml比色管中依次移取1.5ml硫酸亚铁溶液(2mmol·l-1)和1ml双氧水溶液(6mmol·l-1),混合均匀后用6mmol·l-1水杨酸溶液定容至刻度,36~37℃恒温水中反应15min后测定A值,即A0值。测定:在该体系中加入1ml各浓度的样品溶液,36~37℃恒温水中反应15min后测定A值,即为Ax值。样品空白对照以70%乙醇代替所有反应试剂。所有测定值均做3个复孔取平均值。样品的抗氧化程度用对OH·自由基的清除率表示,清除率越大,抗氧化活性越强,反之则弱。样品对OH·自由基的清除率照下面公式计算:
清除效率(%)=(A0-Ax)/A0×100%
4.2 对Fe2+还原能力、螯合能力的测定
4.2.1 铁离子的还原/抗氧化能力(FRAR法) 参照文献[11]的方法,略做改进。取各供试品溶液0.2ml,分别加入0.2ml磷酸盐盐缓冲溶液(pH=6.6,0.2mol·l-1)和0.2ml 1% K3Fe(CN)6溶液。上述混合物于50℃恒温反应20min后,冷却,加入0.2ml 10%的三氯乙酸水溶液终止反应,3000r·min-1离心10min。取上清液0.4ml,加0.4ml蒸馏水,加0.08ml 0.1%FeCl3溶液,混匀,吸取200μl在700nm处测定其吸光度A。样品空白对照以水代替K3Fe(CN)6,其余步骤与样品相同;阴性对照以70%乙醇代替样品溶液,其余步骤与样品相同。所有的测量值均做3个复孔取其平均值。
4.2.2 Fe2+-螯合能力测定 参照Dinis(1994)方法略有改动。取各供试品溶液100μl,加入25μl FeSO4·7H2O(2mmol·l-1),震荡混匀后加入25μl Ferrozine试剂(5mmol·l-1)。混合物在室温下震荡混匀,反应10min后于562nm处测定其吸光度值。吸光度越低表示与 Fe2+螯合能力越强。样品空白对照以水代替Ferrozine试剂,其余步骤与样品相同;阴性对照以70%乙醇代替样品溶液,其余步骤与样品相同。EDTA作为阳性对照。所有的测量值均做3个复孔取其平均值。计算公式如下:
螯合能力(%):[1-(A1-A2)/A0]×100%
(A0为阴性对照组吸光度;A1为样品组吸光度;A2为样品空白对照组吸光度。)
5 结果
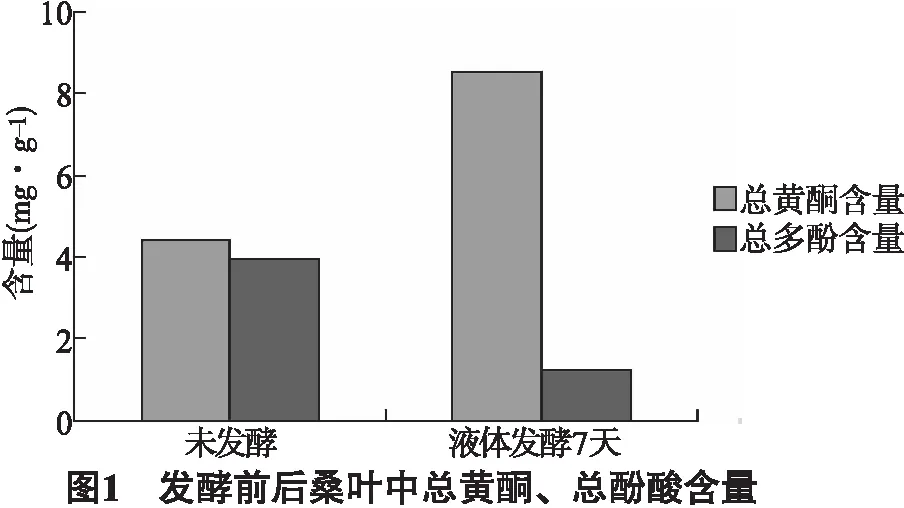
5.1 发酵前后桑叶中总多酚、总黄酮含量 发酵前后桑叶中总多酚、总黄酮含量见图1。结果发现,利用冠突散囊菌对桑叶进行液体发酵7天培养,能够明显改变桑叶中总多酚及总黄酮含量,其中发酵前桑叶中总黄酮、总酚酸含量分别为4.39mg·g-1、3.95mg·g-1,而发酵后变为8.53mg·g-1、1.24mg·g-1。表明利用真菌对桑叶进行液体发酵,能够明显改变其原有的化学成分种类与含量。
5.2 清除DPPH自由基作用 清除DPPH自由基能力的测定结果及IC50分别见图2和表1。从图2.中可以看出,发酵前后桑叶70%乙醇提取物对DPPH自由基均有一定的清除作用,并在实验浓度范围内呈现明显的量效关系。发酵前后桑叶70%乙醇提取物清除DPPH自由基的IC50分别为4.69mg·ml-1、12.64mg·ml-1,而阳性对照抗坏血酸IC50为0.028mg·ml-1。表明发酵后的桑叶70%乙醇粗提物对DPPH自由基的清除能力小于未发酵桑叶70%乙醇粗提物,且发酵前后桑叶70%乙醇粗提物对DPPH自由基清除能力远小于抗坏血酸。
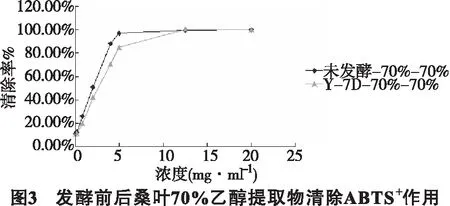
5.3 清除ABTS+自由基作用 ABTS法清除自由基能力的测定结果及IC50分别见图3和表1。发酵前后桑叶70%乙醇提取物对ABTS+自由基都表现出一定程度的清除能力,并在实验浓度范围内呈现明显的量效关系。发酵前后桑叶70%乙醇提取物清除ABTS+自由基的IC50分别为2.03mg·ml-1、2.65mg·ml-1,而阳性对照抗坏血酸IC50为0.025mg·ml-1。表明发酵后的桑叶70%乙醇粗提物对ABTS+自由基的清除能力略小于未发酵桑叶70%乙醇粗提物,且发酵前后桑叶70%乙醇粗提物对ABTS+自由基清除能力活性远小于抗坏血酸。
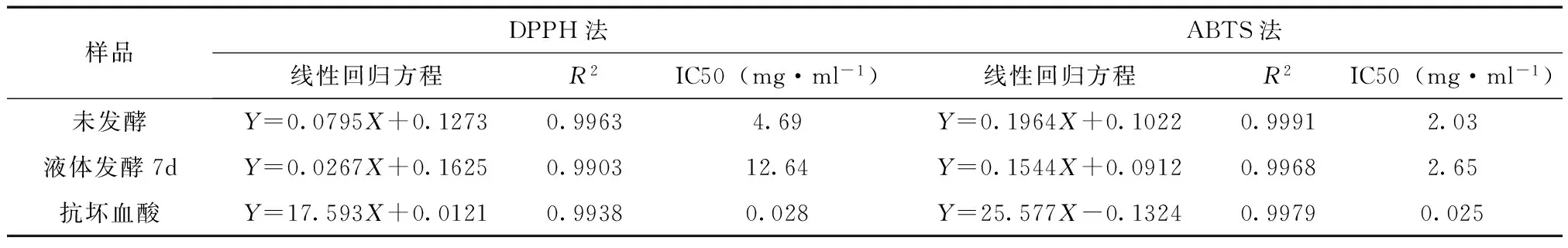
表1 发酵前后桑叶70%乙醇提取物清除自由基能力
注:DPPH:二苯代苦味酰基;ABTS:2,2’-连氨-(3-乙基苯并噻唑啉-6-磺酸)二氨盐。
5.4 清除OH自由基作用 清除OH自由基能力的测定结果中,发现发酵前后桑叶70%乙醇提取物对OH自由基的清除能力均比较低,在实验浓度为20mg·ml-1时,清除能力才达到20%左右。故发酵前后桑叶70%乙醇提取物对OH自由基具有很低的清除能力。
5.5 铁离子的还原/抗氧化能力(FRAR法) 对铁离子还原能力的测定结果见图4。发酵前后桑叶70%乙醇提取物具有一定的铁还原能力,并在实验浓度范围内呈现出量效关系。但两者的还原能力均明显低于抗坏血酸。

5.6 螯合能力 发酵前后桑叶70%乙醇提取物的铁离子螯合能力见图5和表2。发酵前后桑叶70%乙醇提取物与Fe2+有一定的螯合能力,并在实验浓度范围内呈现明显的量效关系。发酵前后桑叶70%乙醇提取物与Fe2+螯合能力的IC50分别为20.89mg·ml-1、14.81mg·ml-1,而阳性对照EDTA-NA2的IC50为0.14mg·ml-1。表明发酵后桑叶70%乙醇粗提物对Fe2+的螯合能力略高于发酵前,且发酵前后桑叶70%乙醇粗提物螯合能力远小于EDTA-NA2。
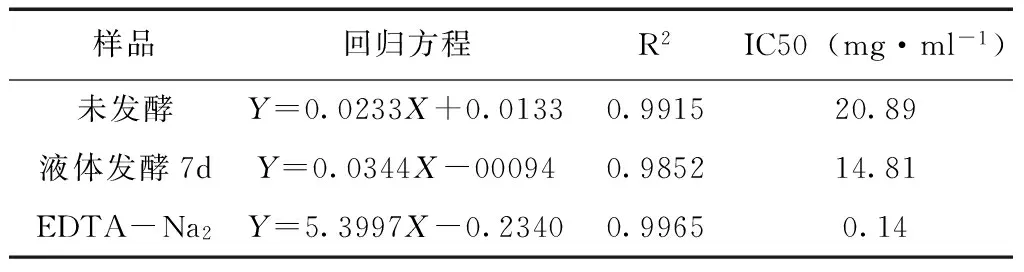
表2 发酵前后桑叶70%乙醇提取物对Fe2+的螯合能力
6 讨论
自由基是生物体新陈代谢过程中产生的一类可以单独存在的具有高度氧化活性的物质,其化学性质相当活跃[12]。过量的自由基诱发机体氧化反应,可损害机体的组织和细胞,进而导致衰老[13-14]。植物中多酚、黄酮等活性物质能够清除过剩的自由基,具有一定的抗氧化活性。
本次研究发现,利用冠突散囊菌对桑叶进行液体发酵,能够明显增加其总黄酮含量,但同时也显著性降低了桑叶中总多酚含量。同时结合体外抗氧化活性试验,可知发酵前后桑叶70%乙醇提取物对DPPH、ABTS+自由基具有一定的清除能力,对铁离子也具有一定的还原能力,而对OH自由基的清除能力较差,且发酵后的桑叶70%乙醇提取物对自由基清除能力及铁还原能力均较发酵前有所降低,暗示桑叶中发挥主要抗氧化作用的活性物质是酚类物质多非黄酮类的。但对于与Fe2+的螯合能力而言,发酵后桑叶70%乙醇提取物活性要略高于发酵前,也许是由于其抗氧化机制的不同,具体原因有待后续实验的进一步研究。
[1]黄婧,杨民和.茯砖茶中“金花”菌的研究进展及应用潜力[J].福建茶叶,2013,(01):7-12.
[2]高学敏主编.中药学.北京:人民卫生出版社,2000:309.
[3]刘利,潘一乐,叶文才.桑叶化学成分及其药理学作用[C]//中国蚕学会第四届青年学术研讨会会议论文集.2004.
[4]郝鹏飞.辣椒叶“金花”菌发酵产物及活性研究[D].北京中医药大学,2013.
[5]邓放明.茯砖茶中冠突散囊菌分离培养及其发酵液胞外多糖与应用酶学研究[D].长沙:湖南农业大学,2007.
[6]Singleton VL,Orthofer R,Lamuela-Raventos RM.Analysis of total phenols and oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent[J].Methods Enzymol,1999,299,152-178.
[7]Lin JY.Determination of total phenolic and flavonoid contents in selected fruits and vegetables as well as their stimulatory effects on mouse splenocyte proliferation[J].Food Chemistry,2007,101(1):140.
[8]Tagashira M,Ohtate Y.A new antioxidative1,3-benzodioxole from Melissa officinalis[J].Planta Med,1998,64:555.
[9]Pellegrini N,Ke R,Yang M,et al.Screening of dietary carotenoids and carotenoid-rich fruit extracts for antioxidant activities applying 2,2’-azinobis(3-ethylene benzothiazoline-6-sulfonic acid)radical cation decolorization assay[J].Methods in Enzymology,1999,299:379.
[10]马燕妮,张清华,刘玉红,等.桑叶黄酮与鬼针草黄酮组分配伍抗氧化协同作用研究[J].食品与药品,2013,15(3):160-161.
[11]潘乔丹,熊圆圆,陈文东,等.扁担藤不同极性抗氧化活性研究[J].中国实验方剂学杂志,2013,19(1):232.
[12]Halliwell B,Gulteridge MC.Oxygen toxicity,oxygen radicals,tranition metals and disease[J].Biochem J,18984,219:1.
[13]Harman D.Ageing:a theory based on free radical and radiation chemistry[J].J Gerontol,1956,11(3):298-300.
[14]Harman D.Free radical theory of aging:dietary implications[J].Am J Clin Nutr,1972,25(8):839-843.
Antioxidantactivitiesanddeterminationoftotalflavonoidsandtotalphenolicsinthefermentationandnon-fermentationproductsinMulberryleaf
WANG Ji-cheng1,2,LIU Xuan2,TANG Jin-tian2,ZHAI Yan-jun1*
1.College of pharmacy,Liaoning University of Traditional Chinese Medicine,Liaoning Province,Dalian 116600,China; 2.Department of Engineering Physics,Tsinghua University,Beijing 100084,China
ObjectiveTo investigate in vitro antioxidant activities of 70% ethanol extract from mulberry leaves between liquid fermentation and non-fermentation, as well as determine the total phenolics and flavonoid contents in them.MethodsThe activated eurotium cristatum were inoculated into the liquid medium that it was 70% ethanol extract from mulberry leaves and evaluated the antioxidant activities of its total extract(70% ethanol).With ascorbic acid and EDTA as positive controls,several in vitro experiments were conducted including DPPH assay,ABTS assay, OH radicals assay,ferric-reducing power(FRAP)assay and ion-chelating assay.At the same time,the contents of the total phenolics and flavonoid were determined before and after fermentation.ResultsThe 70% ethanol extract of non-fermented mulberry leaves showed stronger antioxidant activities than the fermented one.For example,the total extract of the non-fermented had capacities of scavenging DPPH 、ABTS+radicals and ion-chelating with IC50 values of 4.69,2.03,20.89mg·ml-1, respectively. Compared with the non-fermented, the fermented one had the three abilities with IC50 values of 12.42,2.65,14.81mg·ml-1,respectively. In the extract from the fermented mulberry leaves,the total phenolic content was significantly lower than the non-fermented one, while the total flavonoids content was increased more than 2-fold.Such as the total flavonoids and the phenolic contents of the non-fermented one were 4.39 and 3.95mg·ml-1,respectively ,which the fermented one were 8.53 and 1.24mg·g-1.ConclusionThe 70% ethanol extracts,whether fermented or non-fermented, show antioxidant activities .However, the antioxidant activity of the non-fermented mulberry leaves is stronger than the fermented one.Base on the increase of the total flavonoid and the decline of the total phenolics,we conclude that the principal active components are the phenolics, but not flavonoids.
Mulberry leaf;Eurotium cristatum;Liquid fermentation;Antioxidant activities;total flavonoids;total phenolic
翟延君,女,博士,教授,主要从事中药品质评价与鉴定方向研究。E-mail:lnzyzyj@sohu.com
R284.1
A
1007-8517(2014)23-0015-04
2014.09.02)

