冰温保存肾表皮细胞及其渗透特性的实验研究
梁飞,诸凯,2,王雅博
(1天津商业大学天津市制冷技术重点实验室,天津300134;2天津大学中低温热能高效利用教育部重点实验室,天津300072)
冰温保存技术[1-2]是一种新的生物低温保存方法。冰温是指从0 ℃开始到生物组织冻结温度(即冰点)为止的温度区域,在这个温度范围内保存细胞,细胞内外都不产生冰晶[3-4]。与目前临床医学广泛使用的生物冷冻保存方法相比,避开了冰晶对细胞造成伤害,而且有助于细胞机能的快速恢复。研究表明,当降温速率小到一定数值时[5],细胞内的水分有足够的时间能从细胞内渗透出来,从而降低胞内自由水含量,通过这种方法可以很好的抑制胞内冰的产生,对细胞的低温保存有促进作用[6-7]。
通常情况下,细胞保存前都会添加低温保护剂(cryoprotective agent,CPA),以有效的降低细胞冰点[8-10]。在加入一定浓度的CPA后,细胞膜内外会出现渗透压不平衡,导致水和CPA同时通过细胞膜进出细胞,细胞体积也随之改变,当细胞体积变化超越细胞膜所能承受范围,将会对细胞产生不可逆的损伤,即渗透损伤。决定细胞形态变化的参数[11-12]主要有两个,细胞膜水渗透系数(Lp)和细胞膜 CPA的渗透系数(Ps)。对这两个参数的研究有助于冰温保存细胞技术的发展。
细胞膜对水分的渗透特性可以通过细胞体积随外界环境(渗透压)的变化来反映。研究表明,细胞膜肾表皮细胞的相变温度在−5~−8 ℃,研究细胞冰温保存过程,就应在0 ℃附近温度范围中测定细胞膜的渗透特性。众多研究者利用多种方法对细胞膜的渗透特性进行了研究。Chen等[13]利用微型灌注设备,研究了鼠树突细胞在二甲基亚砜溶液中的渗透系数,得到了 22 ℃下水的渗透系数为 0.17 μm/(atm·min),CPA的渗透系数为0.63×10−3cm/min。Wang等[14]测量了4 ℃时牛卵母细胞在胚泡期和四分体时期的渗透参数,分别为0.08 um/(atm·min)、0.0011 cm/min 和 0.14 um/(atm·min)、0.0029 cm/min。Liu等[15]测量了常温时兔卵母细胞在二甲基亚砜、乙二醇和甘油溶液中的渗透参数。
本研究选取了–4 ℃为冰温保存温度,选取(现行临床使用的)4 ℃和0 ℃为对照实验,并称其为常温保存温度。主要研究内容是通过实验的方法测量肾脏表皮细胞的渗透特性,主要有细胞的等渗体积(Viso)、非渗透体积(Vb)、细胞膜对水的渗透系数(Lp)及其活化能(Ea),细胞膜对CPA的渗透系数(Ps)及其活化能(Ea),并且对细胞进行长时间保存,对比细胞的存活率,找出最优保存温度。
1 材料与方法
1.1 主要仪器及实验材料
仪器:光学显微镜,Olympus BX-51,日本;冷热台及控制系统,Linkam THMS600,英国;CCD图像采集装置;细胞培养箱;安全柜;Innovatis CASY®TT,Roche,瑞士。
实验材料:DMEM培养基、小牛血清、双抗、台盼兰染色剂、磷酸盐缓冲液(PBS)、二甲基亚砜(DMSO)、乙二醇(EG)、丙三醇(GLY)。
实验所用细胞为 293T细胞,将细胞放入完全培养基(90%DMEM培养基、10%小牛血清、1%双抗——除特殊说明,本文所提到的百分比均为体积分数)中生长,配置好后放入细胞培养箱中培养,培养箱中保持温度37 ℃、CO2体积分数为5%的环境。待细胞培养成熟后,将培养皿取出,在安全柜中操作将培养液吸入离心管,以800 r/min的转速离心5 min,然后利用血球计数板配置出4×105/mL细胞悬液。
1.2 实验方法
1.2.1 图像采集
细胞的精确控制温度通过一套冷热台及其控制系统实现,如图1所示。左侧a部分是该系统的控制部分,由冷热台(BCS-196)、CCD 图像数字采集系统、温度控制台(Linksys32)和PC端成像软件组成。样品池放置在显微镜(Olympas BX51)载物台上,可实现在–196~125 ℃范围内降温和加热,还可以实现以0.1~150 ℃/min的降温/升温速率精确控温。该冷台通过液氮流进行降温,通过电加热进行加热,并且通过铂电阻热电偶对其温度进行监测[16]。

图1 冷热台及其控温系统和细胞渗透原理图
图1右侧b部分是细胞渗透原理的示意图,为更清楚表达实验过程,将该部分的图形比例扩大表示,尤其是细胞的尺寸。如图所示,载玻片和盖玻片之间充满细胞悬液,由于液体表面张力的作用,是两玻片紧紧吸附,保证了玻片之间是单层细胞。高浓度的灌注液(冷冻保护液或 NaCl 溶液)从左侧导入,灌注溶液的浓度高于细胞培养液的浓度,其浓度差是驱动灌注液从左向右流动的动力,两者混合后从右侧流出平,最终细胞周围溶液的浓度会达到灌注液的浓度,细胞在此过程中,形态会产生变化,通过正上方的镜头传入a部分的计算机成像软件[17-18]。
1.2.2 图像处理方法
本研究通过显微镜观察法测量细胞的体积,假设细胞为理想球体模型,通过上述系统可得到实验过程中的细胞图片,通过测量细胞的二维投影面积,再经过计算可以推断细胞的体积。Image-Pro plus图像分析软件将细胞图片处理成灰度不同的像素点,在500倍镜下,每个像素点对应的面积为0.138 μm×0.138 μm,通过对像素点计数,可得到细胞的实际面积。每次选取3~5个细胞,测量3次,求平均值。低温显微镜得到的二维投影面积与体积的关系如式(1)。

1.2.3 细胞非渗透体积Vb的计算
将渗透压浓度为118 Osmoles/kg、185 Osmoles/kg、260 Osmoles/kg、302 Osmoles/kg、670 Osmoles/kg、863 Osmoles/kg、1349 Osmoles/kg、1583 Osmoles/kg、1741 Osmoles/kg、2252 Osmoles/kg、2682 Osmoles/kg、2800 Osmoles/kg、3186 Osmoles/kg 的 NaCl溶液,按上述方法进行细胞渗透试验。细胞分别会对以上溶液呈现出不同的相应,最终细胞的内外溶液会达到渗透平衡,细胞体积的变化过程由图像采集系统记录下来,其最终的平衡体积Veq可以表述为Boyle van’t Hoff关系式[19],如式(2)。
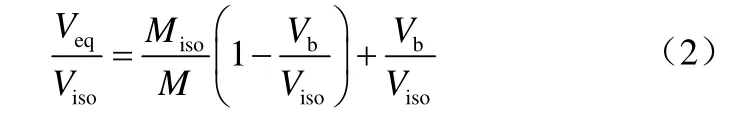
式中,Viso为细胞在等渗溶液中(即渗透压为Miso,mmol/kg)的体积,一般取细胞的初始体积,μm3;Veq为细胞在渗透压为M的溶液中的平衡体积,μm3;Vb为细胞的非等渗体积,μm3。
从式(2)可以看出,细胞的相对体积Veq/Viso与溶液的相对渗透压M/Miso的倒数呈线性关系,将实验数据作图并进行线性拟合,可以得到直线在y轴的截距即为细胞的非渗透体积比Vb/Viso。
1.2.4 细胞膜渗透参数(Lp、Ps)的测定
当溶液中只有非渗透性溶质(如NaCl)存在时,水的渗透系数可以利用一个描述水分传输率的微分方程得到,如式(3)。

在有可渗透性溶质(CPA)、不可渗透性溶质(NaCl)和溶剂(H2O)共存的三元溶液中,水的传输和CPA的渗透同时存在并且相互影响,可采用两参数模型(The two-parameter model)[20-21]来描述作为细细胞膜传输动力模型,模型由一对耦合的微分方程组成,式(4)表示细胞体积随时间的变化,式(5)表示胞内可渗透性溶质(CPA)的物质的量随时间的变化。

其中,Vs(t)与Ns(t)的关系如式(6)。

Lp、Ps的值可以通过将高渗CPA溶液灌注入细胞悬液后所获取的细胞体积变化数据进行最小二乘曲线拟合得到。
1.2.5 活化能Ea的计算
通过上面分析,Lp、Ps可以通过分析实验数据得到,同时,Lp、Ps所对应的活化能可以用阿伦尼乌斯关系式[22][式(7)]表示。

式中,P为细胞膜的渗透参数(Lp或Ps);P0为在参照温度下的值。
对式(7)取自然对数,整理得式(3)。

由此可知,ln(P)是关于1/T的方程,将计算值与温度值做线性拟合,其斜率为−Ea/R,由此可以得到活化能的值。
1.2.6 细胞存活率实验
为了研究冰温保存细胞的效果,将不同的冷冻保护剂加入细胞悬液中,放入冰温库进行长时间保存,利用细胞计数分析仪 Innovatis CASY®TT(Roche)检验细胞的存活率。
将细胞浓度为 4×105/mL的细胞悬液配置好之后,分别进行以下两组实验:①向细胞悬液加入15%的DMSO试剂,分别放入不同的环境温度中(4 ℃、0 ℃、–4 ℃),每12 h记录一次存活率,到48 h为止。②向细胞悬液中分别加入15%不同种类的低温保护剂二甲基亚砜(DMSO)、乙二醇(EG)、甘油(GLY),并放置于–4 ℃的环境温度中,每12 h记录一次存活率,到48 h为止。
2 结果与讨论
2.1 细胞非渗透体积的测量
当细胞在高渗溶液中时,细胞内水分外流,体积发生皱缩,当细胞内外渗透压相等时,细胞体积达到渗透平衡。在常温下,记录细胞在不同渗透压NaCl溶液内的渗透平衡过程的图像,利用上述图像处理方法对不同渗透压下的平衡体积进行处理。首先,测量细胞在等渗溶液中的体积,通过多次观察统计,肾表皮细胞的平均等渗体Viso=2472.58 μm3。然后,测定细胞在不同渗透环境中平衡后的体积数据,得到肾表皮细胞随渗透压变化规律,如图2所示,并进行最小二乘法线性拟合,得到Boyle van’t Hoff曲线,并且外延该直线至无限大浓度,即图2中y轴截距位置,可以得到细胞的非渗透体积Vb=0.22Viso,即Vb=543.9676 μm3,其拟合系数r2=0.96175。
2.2 细胞渗透系数的测量
细胞在高渗的 NaCl溶液中,在胞内外渗透压差的作用下,水分会通过细胞膜流出细胞。而 Na离子进出细胞需要消耗能量,它对细胞膜来说是一种非渗透性溶质,因此只有水分子通过细胞膜,如图3所示,在75 s以后,细胞体积下降到0.45Vb左右保持渗透平衡,在一定范围内保持稳定。这说明在整个渗透过程中只有水分进出,而 Na离子未转移。将细胞变化图片在软件中进行处理,得到细胞体积随时间变化的数据,利用Matlab(MathWorks,美国)软件进行处理,根据式(3)采用Levenberg-Marquard法进行曲线拟合,可得到水的渗透系数Lp,如表1列出了3种低温保护剂在不同温度时的渗透参数值。

图2 肾表皮细胞的Boyle van’t Hoff关系曲线
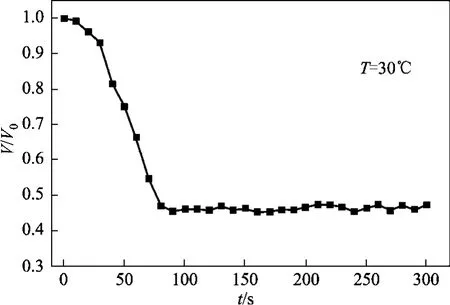
图3 细胞在NaCl溶液中时体积随时间的变化曲线
图4左图显示的是初始时刻,0 ℃时细胞在15%的二甲基亚砜溶液中的图像,右图显示的是左图方框中细胞在0~300 s内,各个时间点的体积变化图像,通过Image-Pro plus软件处理可得到细胞体积的数据。通过数据可以得到细胞在二甲基亚砜溶液中的体积变化曲线,如图5和图6所示。在50 s附近时,细胞体积降到最小值,在以后的时间内,细胞体积逐渐上升,该图与图3相比有很大区别。很显然在50 s前,细胞外溶液渗透压大于胞内,水分从细胞内流出,细胞体积急剧减小,在50 s左右达到平衡;在50 s之后,随着二甲基亚砜分子逐渐进入细胞,水分重新回到了细胞内,因此细胞体积有所回升。将细胞体积变化数据,根据式(4)~式(6)利用 Levenberg–Marquard方法进行曲线拟合,可得到水的渗透系数Lp和DMSO的渗透系数Ps,数据见表1。

表1 肾细胞在不同低温保护剂中的渗透参数

图4 15%的DMSO溶液中细胞图像

图6 –4 ℃时细胞体积变化曲线
图5是在0 ℃、4 ℃和–4 ℃下,细胞在15%的二甲基亚砜溶液中的体积变化曲线。观察可知,细胞体积变化趋势一致,都是细胞体积先急剧减小,然后逐渐变大。但是,在同一时间点上温度越低,细胞体积越大。同时,随温度的降低,细胞皱缩到最小体积的时间越长,这个最小体积也随温度的降低而增大。这是由于温度对低温保护剂的渗透系数影响所造成的,观察表1的数据可知,二甲基亚砜的Lp和Ps值均随温度的下降而减小,说明水和二甲基亚砜的渗透能力均随温度的下降而降低,尤其是在–4 ℃时,Lp和Ps值均比零上温度低一个数量级,这正说明了渗透参数受温度影响严重。
图6是细胞在二甲基亚砜、乙二醇和甘油溶液中的体积变化曲线,观察曲线可知,三者曲线变化趋势一致,在同一时间点上,甘油的体积最大,二甲基亚砜和乙二醇的体积相差不大。甘油的曲线下降的最慢,最小体积也是三者中最大的,二甲基亚砜和乙二醇的曲线比较相似,根据表1数据可知,二甲基亚砜和乙二醇在各个温度的渗透参数都比较接近,而甘油的渗透参数小于上述两者,可见甘油的渗透能力最下小。
2.3 渗透系数所对应的活化能
图7显示的是细胞在二甲基亚砜溶液中测得的水的渗透系数Lp与绝对温度T的倒数关系图,对其进行最小二乘法线性拟合,根据式(8)可以计算得到细胞对水的活化能。利用同样方法可得到其他CPA中活化能的数据,见表2。
2.4 细胞的存活率
在经过冰温保存过程中,细胞的质量会随着时间逐渐下降,细胞活性逐渐降低,直至变为死细胞,一般认为,当活细胞的存活率下降到50%以下时,生存环境恶化,组织将坏死。

图7 肾细胞对水的渗透系数的阿仑尼乌斯图

表2 肾细胞的活化能

图8 不同温度下肾细胞存活率曲线
通过上述方法,利用细胞计数分析仪Innovatis CASY®TT对冰温保存的细胞进行计数测量,得到细胞存活率数据。由图8可见,细胞在36 h之前,曲线小幅度平稳下降,说明细胞在这段时间没有经历太大变化,依旧保持活性;在36 h之后, 曲线出现大幅下降,说明细胞开始出现大量的坏死,在达到72 h的时候,存活率均低于50%,已经不能在进行培养。观察可知,0 ℃曲线在各个时间点基本都高于其他曲线,−4 ℃曲线的次之,4 ℃曲线最低,这说明相对其他两个温度来说,0 ℃的环境对细胞保存最有益,最佳保存温度在0~−4 ℃之间。图9显示了0 ℃时细胞在3种低温保护剂中保存后存活率的曲线,其变化趋势与图8的趋势相似,同样说明在36 h之前,细胞生长良好,能保持很高的活性,在36 h之后,细胞出现大量坏死。同时,3种冷冻保护剂中,甘油的曲线高于其他两曲线,在36 h之前,二甲基亚砜的曲线和甘油的曲线非常相似,乙二醇的曲线最低,这说明针对肾脏表皮细胞而言,3种低温保护剂对甘油和二甲基亚砜的保护作用较好,乙二醇相对较差。
3 结 论
本文利用显微数字图像采集系统,在冰温温度和常温温度下,对肾脏表皮细胞的渗透过程进行了研究。观察了细胞在非等渗环境中的渗透响应,得到了细胞的等渗体积Viso=2472.58 μm3,非渗透体积Vb=543.9676 μm3。并且根据细胞在CPA溶液中的渗透过程,得出了细胞膜对水的渗透系数(Lp)及细胞膜对 CPA的渗透系数(Ps)。最后进行保存,利用细胞计数分析仪测量了细胞存活率随时间变化趋势。得出如下结论。

图9 0 ℃时不同保护剂中细胞存活率曲线
(1)通过对比低温保护剂在不同温度下渗透系数的数据,发现渗透系数受温度影响较大,随着温度的减小,渗透系数逐渐小,其渗透能力也相应降低,即细胞在冰温环境下的渗透系数低于常温下的渗透系数。
(2)通过观察细胞在不同温度下的保存状况,发现肾表皮细胞的最佳保存温度范围在 0~−4 ℃之间,即细胞的冰温保存效果比现行临床常用的4~0 ℃范围的保存效果更好。同时根据实验数据发现,即使在精确控温的冰温库中保存的细胞,保存时间不宜超过36 h,超过以后细胞质量急剧下降,影响细胞功能。因此在实际临床应用上,保存时间更不宜超过24 h为好。
(3)通过观察细胞在不同类型低温保护剂中的保存情况,发现在36 h内,甘油、二甲基亚砜、乙二醇3种低温保护剂的保存效果,依次降低,但是三者的保存效果相差不大。
符 号 说 明
A——细胞投影面积,μm2
Ea——活化能,kcal/mol
Lp——水对细胞膜的渗透系数,μm/(atm·min)
M——摩尔渗透压浓度,Osmoles/kg
m——质量摩尔浓度,mol/kg
N——物质的量,mol
Ps——CPA对细胞膜的渗透系数,cm/min
R——气体常数,kcal/(mol·K)
T——绝对温度,K
t——时间,s
V——细胞体积,μm3
Vb——非渗透体积,μm3
下角标
c——总数
w——水
s——分渗透性溶质
n——渗非透性溶质
o——初始值
上角标
e——细胞外
i ——细胞内
[1]Yoichi M,Wei T,Kaibori M,et al.A novel conception for liver preservation at a temperature just above freezing point[J].Journal of Surgical Research,1999,81(2):216-223.
[2]Soltys K A,Batta A K.Successful nonfreezing,subzero preservation of rat liver with 2,3-butanediol and type Ⅰ antifreeze protein[J].Journal of Surgical Research,2001,96(1):30-34.
[3]Yang C Y,Lee P T,Lin T T et al.Effect of cooling rate and cryoprotectant concentration on intracellular ice formation of small abalone (Haliotis diversicolor) eggs[J].Cryobiology,2013,67(1):7-16.
[4]Mori Shoji,Choi Jeunghwan,Devireddy R V,et al.Calorimetric Bischof.Calorimetric.measurement of water transport and intracellular ice formation during freezing in cell suspensions[J].Cryobiology,2012,65(3):242-255.
[5]Varisli O,Scott H,Agca C,et al.The effects of cooling rates and type of freezing extenders on cryosurvival of rat sperm[J].Cryobiology,2013,67(2):109-116.
[6]Balasubramanian S K,Bischof J.C,Hubel A.Water transport and IIF parameters for a connective tissue equivalent.[J].Cryobiology,2006,52(1):62-73.
[7]Mazur P.Kinetics water loss from cells at sub zero temperature and the likelihood of intercellular freezing[J].Journal of General Physiology,1963,47(3):347-369.
[8]马学虎,范文霞,潘广生.冷冻保护剂导入细胞过程的模拟和优化[J].热科学与技术,2008,7(4):324-330.
[9]Yildiz C,Mullen B,Jarvi K,et al.Effect of different cryoprotectant agents on spermatogenesis efficiency in cryopreserved and grafted neonatal mouse testicular tissue[J].Cryobiology,2013,67(1):70-75.
[10]Liang Y Y,Srirattana K,Phermthai T,et al.Effects of vitrification cryoprotectant treatment and cooling method on the viability and development of buffalo oocytes after intracytoplasmic sperm injection[J].Cryobiology,2012,65(2):151-156.
[11]Agca Y,Liu J,McGrath J J,et al.Membrane permeability characteristics of metaphase Ⅱ mouse oocytes at various temperatures in the presence of Me2SO[J].Cryobiology,1998,36(4):287-300.
[12]Noiles E E,Mazur P,Watson P F,et al.Determination of water permeability coefficient for human spermatozoa and its activation energy[J].Biology of Reproduction,1993,48(1):99-109.
[13]Chen H H,Shen H,Heimfeld S,et al.A microfluidic study of mouse dendritic cell membrane transport properties of water and cryoprotectants[J].International Journal of Heat and Mass Transfer,2008,51(23-24):5687-5694.
[14]Wang X,Naib A.A,Sun D W,et al.Membrane permeability characteristics of bovine oocytes and development of a step-wise cryoprotectant adding and diluting protocol[J].Cryobiology, 2010,61(1):58-65.
[15]Liu J,Mullen S,Meng Q G,et al.Determination of oocyte membrane permeability coefficients and their application to cryopreservation in a rabbit model[J].Cryobiology,2009,59(2):127-134.
[16]Spindler R,Rosenhahn B,Hofmann N,et al.Video analysis of osmotic cell response during cryopreservation.[J].Cryobiology,2012,64(3):250-260.
[17]Taylor M J,Baicu S C.Current state of hypothermic machine perfusion preservation of organs:The clinical perspective[J].Cryobiology,2010,60(3):S20-S35.
[18]Gao D Y,Mcgrath J J,Tao J,et al.Membrane transport properties of mammalian oocytes - a micropipette perfusion technique[J].Reprod Fertil,1994 ,102(2):385-392.
[19]Peckys D,Mazur P.Regulatory volume decrease in COS-7 cells at 22 C and its influence on the Boyle van’t Hoff relation and the determination of the osmotically inactive volume[J].Cryobiology,2012,65(1):74-78.
[20]Kleinhans F W.Membrane permeability modeling:Kedem-Katchalskyvs.a two-parameter formalism[J].Cryobiology,1998,37(4):271-289.
[21]McGrath J J.Quantitative measurement of cell membrane transport:Technology and applications[J].Cryobiology,1997,34(4):315-334.
[22]Noiles E E,Thompson K A,Storey B T.Water permeability,Lp ,of the mouse sperm plasma membrane and its activation energy are strongly dependent on interaction of the plasma membrane with the sperm cytoskeleton[J].Cryobiology,1997,35(1):79-92.

