超临界二氧化碳相转化技术制备组织工程支架研究进展
杨丁柱 ,陈爱政 ,2,王士斌 ,2
(1华侨大学化工学院,福建 厦门 361021;2华侨大学生物材料与组织工程研究所,福建 厦门 361021)
组织工程的原理是将体外培养和扩增的高浓度功能相关组织细胞种植在一种生物相容性好,同时能够在被机体降解的材料上,即组织工程支架,形成材料-细胞复合物,将此复合物移植到机体内,达到修复受损组织或重建功能的目的。组织工程支架作为组织工程的三要素之一,为种子细胞提供了适合其生长、基质合成及发挥其他功能的生物学空间,克服了以往单一细胞移植中细胞不易成活、基质合成能力低等缺点[1-2]。
目前,制备组织工程支架的传统方法有:纤维粘结[3]、相分离/冻干法[4]、溶剂浇铸/颗粒沥滤[5]、气体发泡[6]等方法。然而,传统方法制备的组织工程支架普遍存在有机溶剂残留多、孔洞贯通性差、生长因子容易流失等问题。随着超临界流体技术的不断发展,其在多孔材料的制备领域研究广泛,涉及多孔微球[7-9]以及多孔支架的制备[10]。在组织工程支架的制备方面,基于SC-CO2传质性能的可调性,可以控制多孔支架的形貌;基于其和有机溶剂的高亲和性,可以强化传质速率,有效地去除有机溶剂,避免了上述问题的产生。因此,本工作从 SC-CO2作为非溶剂的角度,对利用 SC-CO2相转化技术制备组织工程支架的研究现状进行综述,并对目前存在的问题提出了可能的解决方案,最后对其未来的研究和发展方向进行了展望。
1 超临界二氧化碳相转化技术
超临界二氧化碳流体(supercritical carbon dioxide,SC-CO2)是指当温度,压力超过二氧化碳临界点(Tc=304.1 K,Pc=7.38 MPa)时的流体,其具有接近于液体的黏度和接近于气体的密度,这赋予了它较好的溶解性和扩散性;同时,由于CO2的介电常数较低,分子偶极矩为零,大多数高分子聚合物不易溶解在SC-CO2中[11-12]。SC-CO2相转化技术是指利用SC-CO2代替传统的非溶剂,当SC-CO2与聚合物均相溶液接触后,SC-CO2诱导均相体系从稳态转化成非稳态,随即发生相分离。
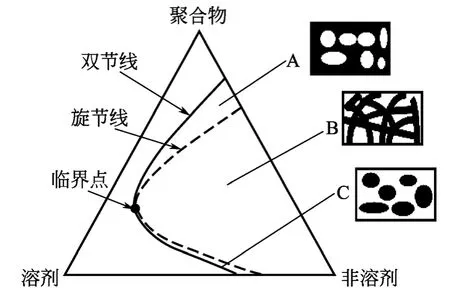
图1 溶剂/非溶剂/聚合物三元相图
对于溶剂/非溶剂/聚合物三元体系来说,依据相分离发生在三元相图(图1)的不同区域,可以形成不同的结构。当溶剂从聚合物溶液中扩散出去的速率大于非溶剂进入溶液的速率,在相分离发生之前,聚合物的浓度升高、固化,最终形成致密的无孔结构;当三元体系进入临界点上方的亚稳态区时,体系将发生聚合物贫相成核和生长的分相过程,随着聚合物富相的固化,形成孔洞结构(图1中A区域);当三元体系进入非稳态区时,溶剂从聚合物溶液中扩散出去的量大于非溶剂的进入量,随着聚合物富相的固化,形成两相贯通的连续孔洞结构(图1中B区域);当三元体系进入临界点下方的亚稳态区时,体系将发生聚合物富相的成核和生长,随着聚合物富相的固化,形成颗粒状结构(图1中C区域)[13-14]。同时,由于 SC-CO2的传质特性,能快速干燥聚合物,将相分离与干燥过程合二为一,避免了干燥过程容易发生的结构塌陷问题。通过改变操作条件,可以调节聚合物多孔结构的形貌和孔径,实现了过程的可控性。
2 SC-CO2相转化法制备组织工程支架
2.1 组织工程支架材料
2.1.1 非生物降解性高分子材料
非生物降解性高分子材料因其化学惰性、与体液接触后不会发生反应、力学性能不会因为长期植入体内而发生变化以及易于成型和加工等优点,广泛用于韧带、血管、人体脏器、骨等人体组织及器官的修复和制造。SC-CO2相转化技术最早应用在非生物降解性高分子材料多孔结构的制备方面。Kho等[15]和 Matauyama等[16]结合压缩抗溶剂沉淀法(precipitation with compressed antisolvent,PCA),以 SC-CO2作为非溶剂,将聚合物溶液均匀地涂布在支撑板上,随后浸没在SC-CO2中。由于SC-CO2与有机溶剂互溶而对聚合物不溶,可诱导混合体系发生相分离,形成多孔结构。同时,在对聚合物进行干燥处理时,随着操作压力的降低,多孔结构没有出现塌陷,保证了多孔结构的完整性。然而,大多数非生物降解性高分子材料生物活性较差,与组织不易牢固结合,限制了其在组织工程领域的应用。但是该方法的提出推动了 SC-CO2相转化技术制备组织工程支架的研究与发展。
此外,SC-CO2不仅可以作为非溶剂诱导聚合物溶液发生相分离,而且可以萃取分离一些有机化合物或作为化学反应的介质促进反应的发生。Kim等[17]将聚碳酸酯(polycarbonate,PC)与聚乙二醇(PEG200)溶解在二氯甲烷中,利用SC-CO2诱导体系发生相分离。由于PEG200在SC-CO2中具有一定的溶解度,利用SC-CO2可以将PEG200从体系中萃取去除,获得PC多孔膜。Barroso等[18]以甲基丙烯酸甲酯和甲基丙烯酸为聚合物单体,在SC-CO2中进行聚合反应,合成聚甲基丙烯酸甲酯-甲基丙烯酸(poly methyl methacrylate-comethacrylic acid,PMMA-co-PMAA)共聚物,随后将PMMA-co-PMAA溶解在丙酮中,利用SC-CO2相转化技术制备出具有 pH响应性的 PMMA-co-PMAA多孔膜。
2.1.2 生物降解性高分子材料
作为组织工程支架材料必须满足以下条件[19-20]:①具有三维立体结构、高孔隙率和适合的孔径,以保证植入细胞的粘附、增殖以及生长因子的渗入吸附;②可生物降解性,材料植入体内,在组织形成过程中逐渐降解,其降解速率应与组织形成速率相匹配;③生物相容性、细胞亲和性,与细胞和邻近组织直接或间接接触时能保持相对稳定、无免疫原性;④一定的机械强度,在组织再生过程中,提供临时支撑,从而使再生组织具有一定外形。
天然高分子材料具有良好的生物相容性、生物可降解性以及可被吸收利用等优点,被广泛用于组织工程支架材料。壳聚糖是一种碱性氨基多糖,其结构和性质与天然细胞外基质中的主要组成氨基多糖相类似。Duarte等[21]通过改变溶剂种类,成功制备出孔洞均匀的壳聚糖支架。但天然高分子生物材料大多力学性能较差,如果单独使用,可能达不到一些组织工程支架的要求。聚乳酸(polylactic acid,PLA)是典型的合成高分子生物材料,通过控制合成工艺,可以获得不同力学性能,拥有良好生物相容性和生物可降解性的 PLA材料[22]。此外,利用SC-CO2相转化技术制备组织工程支架时,将两种[23-25]或两种以上[26]不同生物材料进行复合使用,可以避免单一使用的缺陷;选择合适的复合材料以及混合比例或共载药物[27-28],可以调整和提高组织工程支架的性能。
2.2 组织工程支架形貌
在组织工程构建过程中,组织工程支架的尺度可以控制组织的生长发育过程[29-30]:①支架的整体尺度(mm~cm),决定了形成组织的大小和形状;②支架孔隙形貌和大小(μm),决定细胞的迁移、生长、营养物质的输运、代谢物的排出等;③支架材料表面化学以及立体微观结构(nm),能调节与其直接接触的细胞的粘附、迁移和基因表达过程。尤其是支架表面的粗糙度、孔洞的大小以及孔洞之间的贯通性会对蛋白质的吸附、细胞的形态、定向生长及细胞特异反应产生重要影响[31-33]。
2.2.1 致密无孔结构
在 SC-CO2诱导聚合物溶液发生相分离时,相分离体系的压力和温度不是瞬时达到的,如果在相分离发生之前聚合物固化,将形成致密无孔结构。Xu等[34-35]的研究发现,在氯仿/SC-CO2/聚-L-乳酸(poly-L-lactide,PLLA)体系中,由于氯仿与SC-CO2具有较高的亲和力,在SC-CO2诱导体系发生相分离之前没有发生液-液分层,从而形成致密无孔结构;同时,过高的聚合物浓度,也有助于形成致密无孔结构[36]或由颗粒形成的致密结构[37]。如果聚合物溶剂的沸点接近操作温度,相分离体系的升压过程可能会促进溶剂从聚合物溶液中蒸发出来,产生致密无孔结构[21]。
2.2.2 孔洞结构

图2 超临界二氧化碳相转化技术制得的无孔结构
Reverchon等[38]的研究结果表明,由于聚合物溶液均匀地涂布在支撑板上,其上表面可与SC-CO2快速、充分地接触,如果在 SC-CO2诱导体系发生相分离之前,溶剂从聚合物溶液中流出,将产生致密的表面,致密表面的形成阻挡了溶剂的扩散,而在聚合物溶液内部的 SC-CO2会诱导体系发生相分离,从而获得表面致密,其下多孔的非对称孔洞结构[图3(a)]。Matsuyama等[39]考察了 4种有机溶剂对乙酸纤维素(cellulose acetate,CA)多孔结构的影响。实验结果表明,当溶剂与 SC-CO2之间的亲和力降低时,多孔结构的孔隙率和孔径会增加。这是由于降低溶剂与 SC-CO2的亲和力,使溶剂扩散到 SC-CO2中的含量减少,延长了聚合物贫相成核和生长的时间,导致孔径的增大[40-43],形成如图3(b)所示的胞腔状孔洞结构[41]和图3(c)所示的隧道状孔洞结构[43]。Reverchon等[44]将 CA溶解在丙酮中,发现当降低聚合物浓度时,CA的形貌从致密无孔结构变成多孔结构,孔径从2 μm增大到50 μm。这是由于聚合物浓度降低时,减小了聚合物溶液的黏度,与 SC-CO2接触时分相较快,有利于形成较大的孔径;同时,提高了孔洞之间的贯通性,形成如图3(d)所示的连续孔洞结构。当增大SC-CO2体系的压力时,SC-CO2的密度和溶解度增加,导致进入聚合物贫相中的非溶剂量增加,分相加快,使得最终获得的平均孔径增大;而升高温度,一方面降低了溶液的黏度,容易形成大孔结构;另一方面,升温降低了 SC-CO2的溶解能力,导致分相速度减慢,聚合物贫相成核和生长缓慢,而聚合物富相的固化导致孔径减小。与溶剂种类、聚合物浓度以及压力相比,温度对多孔结构的影响较小[42-45]。
Tsivintzelis等[46]将改性的纳米蒙脱石颗粒添加到PLLA体系中,获得了PLLA纳米复合多孔支架,与未加入蒙脱石的PLLA多孔支架[41]相比,添加纳米颗粒会得到更均匀的孔洞结构和更大的孔径,这可能是由于纳米颗粒的存在影响了纳米复合材料的结晶行为。Huang等[37]以N,N-二甲基乙酰胺为溶剂,制得的聚偏二氟乙烯(poly vinylidene fluoride,PVF)具有胞腔状的孔洞结构,孔洞由PVF晶粒组成。这种颗粒状孔洞结构[图4(a)]和叶片状孔洞结构[图4(b)]可能是相分离体系中,液-液分层和结晶共同作用的结果[35,47]。
由于 SC-CO2与水之间的共混性较差,这限制了利用 SC-CO2相转化技术制备水溶性聚合物多孔支架的发展。为了改善此不足,Reverchon等[48]提出一种水溶性聚合物相分离的新技术,即将有机溶剂与CO2共混,操作条件高于CO2的临界点,但低于混合体系的临界点,这样既保证了有机溶剂对水的增溶作用,同时也保证了 SC-CO2对反应体系的可控性。通过此改进技术,使用助溶剂乙醇,可以获得孔径在0.5~4 μm之间的聚乙烯醇(polyvinyl alcohol,PVA)多孔结构。Temtem等[49]使用助溶剂乙醇,以 1%乙酸酸化的水为溶剂,制备出具有颗粒聚集结构和多孔结构的壳聚糖支架。间充质干细胞体外培养表明,这些结构可以支持细胞的粘附和增殖。

图3 超临界二氧化碳相转化技术制得的多孔结构

图4 超临界二氧化碳相转化体系中结晶作用形成的多孔结构
Reverchon等[50]研究了两种不同的载药方式,即药物悬浮于聚合物溶液和药物溶于聚合物溶液,对聚甲基丙烯酸甲酯(poly methyl methacrylate,PMMA)多孔结构的影响。实验结果表明,两种载药方式不影响多孔结构的原有形貌[图5(a)]。但是,在药物悬浮体系中,增加药物比例伴随着聚合物比例的下降;同时,药物的存在可能会阻碍聚合物富相的固化,从而形成孔径较大,表面粗糙的多孔结构[图5(b)]。Cardea等[51]也发现,药物的加入不会对多孔结构的形貌没有产生影响。但是,利用悬浮载药方式获得的共载阿莫西林的聚偏二氟乙烯-六氟丙烯(poly vinylidene fluoride-co-hexafluoropropylene,PVDF-HFP)具有更好的缓释效果。
2.2.3 三维纳米纤维结构
在组织工程支架内部,过小甚至闭合的孔洞[36,47]会限制细胞的迁移,从而导致细胞在支架边缘堆积,这种堆积又反过来限制营养物质和代谢废物的运输,进而形成坏死区。如果孔壁光滑[41]或孔径过大[43],会限制细胞的粘附,不利于细胞的生长。同时孔洞之间要具有贯通性,以便细胞可以更好的迁移、生长,并且保证生长因子在支架内部的流动。
Duarte等将淀粉与PLLA[24]、壳聚糖与PLLA[25]、淀粉与聚已内酯(polycaprolactone,PCL)[52]共混,验证了利用 SC-CO2相转化技术制备基于天然聚合物体系的多孔结构的可行性。三维多孔淀粉基聚合物具有粗糙的表面,内部具有微米以及大孔结构,这些微米结构能够强化传递性能和增加细胞的粘附和增殖;同时,这些多孔结构具有高贯通性[52-53]。将药物与多孔支架进行共载,这样多孔支架不仅可以起到物理支持的作用,而且可以控制药物的释放以及促进细胞的增殖和分化。共载有地塞米松的淀粉/PLLA混合支架,能够起到生骨介质的作用,直接促进干细胞朝着成骨分化[28]。生物活性玻璃具有良好的生物相容性和可加工性,其具有的表面活性可与人体骨组织形成生理结合[54]。Duarte等[26]将生物活性玻璃添加到淀粉基三维支架体系中。研究结果表明,生物活性玻璃的加入增加了材料表面的粗糙度,但没有对聚合物基质的孔隙率或多孔结构的贯通性产生影响。同时发现复合支架可以诱导磷灰石层的形成,促进骨组织的再生。

图5 超临界二氧化碳相转化体系中载药前后制得的多孔结构[50]

图6 超临界二氧化碳相转化体系中不同溶剂下制得的多孔支架表面形貌[55]
作者课题组[55]使用碳酸氢铵为支架的致孔剂,二氯甲烷、二氯甲烷/二氧六环、二氧六环为溶剂溶解 PLLA,将致孔剂与聚合物溶液混合均匀后进行压片处理,随后利用SC-CO2诱导体系发生相分离,制备出孔隙率高(>95%)、力学性能好(抗压强度>10 MPa)、有机溶剂残留量低(12 μL/L)以及大小孔洞并存,孔洞之间相互贯通的组织工程多孔支架。选择二氯甲烷作为溶剂时,在多孔支架内部会形成孔壁光滑、大孔壁上分布着小孔的三维孔洞结构[图6(a)]。然而,选择二氧六环作为溶剂时,在多孔支架内部会获得由纳米纤维相互交联形成的三维孔洞结构,即三维纳米纤维结构[图6(b)]。在组织工程构建过程中,由于材料表面的微环境与粘附的细胞直接接触,所以材料表面的微观拓扑结构对细胞行为有着非常重要的影响[56]。因此,制备出具有类似天然细胞外基质结构和功能的三维纳米纤维组织工程支架至关重要。
3 结 语
目前,使用 SC-CO2替代传统的非溶剂,可以成功制备出不同形貌的多孔结构,验证了 SC-CO2相转化技术制备组织工程支架的可行性。但是,仍然存在一些不足亟待完善:缺少 SC-CO2相转化技术制备多孔结构的理论研究,不能全面、科学地解释多孔结构的形成机理;在多孔支架内部无法形成复杂的三维结构,过小甚至闭合的孔洞尺寸会限制细胞的迁移,过大的孔洞尺寸不利于细胞的粘附;需要进一步提高组织工程支架的性能,为细胞的生长提供理想的生存环境。因此,针对 SC-CO2相转化技术具有的独特优势以及所面临的问题,今后的研究内容可以考虑从以下几个方面入手。①推动SC-CO2相转化技术制备多孔结构的热力学行为和传质机理的研究,一定程度上预测体系是否适合制备多孔结构以及判断多孔结构的最终形貌。②选择适合的材料及操作条件,控制相分离的发生过程,形成具有微米和纳米并存的多孔结构,实现功能互补。同时,保证孔洞之间的贯通性,以便生长因子在支架内部的流动。③加强制备具有类似细胞外基质结构和功能的复合材料支架的研究。例如,可以尝试将天然高分子材料、合成高分子材料以及无机生物材料复合使用,实现取长补短,相互补充。④由于支架材料表面的微环境对细胞的行为有着重要的影响,通过对支架材料进行改性处理,可以进一步促进支架材料与细胞之间的相互作用,诱导细胞分化从而实现器官修复和组织构建(作者课题组正在尝试使用新的致孔剂和材料,期望在纤维表面可以形成多孔或分层结构,提高纤维表面的粗糙度,以便促进细胞活动)。希望通过SC-CO2相转化技术制备出理想的组织工程支架,满足不同的组织构建要求,促进组织工程支架的研究和发展。
[1]Robert L,Vacanti J P.Tissue engineering[J].Science,1993,260(2):920-941.
[2]曹谊林,崔磊,商庆新,等.组织工程的研究现状与应用展望[J].中国医疗器械信息,2002,8(4):11-14.
[3]Mikos A G,Bao Y,Cima L G,et al.Preparation of poly (glycolic acid) bonded fiber structures for cell attachment and transplantation[J].Journal of Biomedical Materials Research,1993,27(2):183-189.
[4]Whang K,Goldstick T K,Healy K E.A biodegradable polymer scaffold for delivery of osteotropic factors[J].Biomaterials,2000,21(24):2545-2551.
[5]陈际达,崔磊,刘伟,等.溶剂浇铸/颗粒沥滤技术制备组织工程支架材料[J].中国生物工程杂志,2003,23(4):32-42.
[6]Oh S H,Kang S G,Kim E S,et al.Fabrication and characterization of hydrophilic poly (lactic-co-glycolic acid)/poly(vinyl alcohol) blend cell scaffolds by melt-molding particulate-leaching method[J].Biomaterials,2003,24(22):4011-4021.
[7]赵趁,陈爱政,王士斌,等.超临界二氧化碳流体技术制备多孔微球研究进展[J].科学通报,2012,57(36):3459-3466.
[8]Chen A Z,Zhao C,Wang S B,et al.Generation of porous poly-L-lactide microspheres by emulsion-combined precipitation with a compressed CO2antisolvent process[J].Journal of Materials Chemistry B,2013,1:3967-2975.
[9]Kang Y Q,Zhao C,Chen A Z,et al.Study of lysozyme-loaded poly-L-lactide (PLLA) porous microparticles in a compressed CO2antisolvent process[J].Materials,2013,6(8):3571-3583.
[10]Bhamidipati M,Scurto A M,Detamore M S.The future of carbon dioxide for polymer processing in tissue engineering[J].Tissue Engineering Part B:Reviews,2013,19(3):221-232.
[11]Raveendran P,Ikushima Y,Wallen S L.Polar attributes of supercritical carbon dioxide[J].Accounts of Chemical Research,2005,38(6):478-485.
[12]Nalawade S P,Picchioni F,Janssen L.Supercritical carbon dioxide as a green solvent for processing polymer melts:Processing aspects and applications[J].Progress in Polymer Science,2006,31(1):19-43.
[13]Van deWitte P,Esselbrugge H,Dijkstra P J,et al.Phase transitions during membrane formation of polylactides.Ⅰ.A morphological study of membranes obtained from the system polylactide-chloroform-methanol[J].Journal of Membrane Science,1996,113(2):223-236.
[14]Van deWitte P,Dijkstra P J,Van den Berg J W A,et al.Phase separation processes in polymer solutions in relation to membrane formation[J].Journal of Membrane Science,1996,117(1):1-31.
[15]Kho Y W,Kalika D S,Knutson B L.Precipitation of nylon 6 membranes using compressed carbon dioxide[J].Polymer,2001,42(14):6119-6127.
[16]Matsuyama H,Yano H,Maki T,et al.Formation of porous flat membrane by phase separation with supercritical CO2[J].Journal of Membrane Science,2001,194(2):157-163.
[17]Kim M S,Lee S J.Characteristics of porous polycarbonate membrane with polyethylene glycol in supercritical CO2and effect of its porosity on tearing stress[J].The Journal of Supercritical Fluids,2004,31(2):217-225.
[18]Barroso T,Temtem M,Casimiro T,et al.Development of pH-responsive poly(methylmethacrylate-co-methacrylic acid)membranes using scCO2technology:Application to protein permeation[J].The Journal of Supercritical Fluids,2009,51(1):57-66.
[19]Sachlos E,Czernuszka J.Making tissue engineering scaffolds work.Review:The application of solid freeform fabrication technology to the production of tissue engineering scaffolds[J].European Cell Materials,2003,5(29):39-40.
[20]Ma P X.Scaffolds for tissue fabrication[J].Materials Today,2004,7(5):30-40.
[21]Duarte A R C,Mano J F,Reis R L.The role of organic solvent on the preparation of chitosan scaffolds by supercritical assisted phase inversion[J].The Journal of Supercritical Fluids,2012,72:326-332.
[22]胡建军.聚乳酸合成技术研究进展[J].化工进展,2012,31(12):2724-2728.
[23]Temtem M,Casimiro T,Mano J F,et al.Preparation of membranes with polysulfone/polycaprolactone blends using a high pressure cell specially designed for a CO2-assisted phase inversion[J].The Journal of Supercritical Fluids,2008,43(3):542-548.
[24]Duarte A R C,Mano J F,Reis R L.Preparation of starch-based scaffolds for tissue engineering by supercritical immersion precipitation[J].The Journal of Supercritical Fluids,2009,49(2):279-285.
[25]Duarte A R C,Mano J F,Reis R L.Novel 3D scaffolds of chitosan-PLLA blends for tissue engineering applications:Preparation and characterization[J].The Journal of SupercriticalFluids,2010,54(3):282-289.
[26]Duarte A R C,Caridade S G,Mano J F,et al.Processing of novel bioactive polymeric matrixes for tissue engineering using supercritical fluid technology[J].MaterialsScienceand Engineering:C,2009,29(7):2110-2115.
[27]Temtem M,Pompeu D,Jaraquemada G,et al.Development of PMMA membranes functionalized with hydroxypropyl-βcyclodextrins for controlled drug delivery using a supercritical CO2-assisted technology[J].InternationalJournalof Pharmaceutics,2009,376(1):110-115.
[28]Duarte A R C,Mano J F,Reis R L.Dexamethasone-loaded scaffolds prepared by supercritical-assisted phase inversion[J].Acta Biomaterialia,2009,5(6):2054-2062.
[29]Flemming R,Murphy C,Abrams G,et al.Effects of synthetic micro-and nano-structured surfaces on cell behavior[J].Biomaterials,1999,20(6):573-588.
[30]Edelman E R.Vascular tissue engineering designer arteries[J].Circulation Research,1999,85(12):1115-1117.
[31]陈宝林,王东安,封麟先.组织工程材料表面拓扑结构对其细胞相容性的影响[J].中国组织工程研究与临床康复,2007,11(18):3653-3656.
[32]Murphy C M,Haugh M G,O’Brien F J.The effect of mean pore size on cell attachment,proliferation and migration in collagen-glycosaminoglycan scaffolds for bone tissue engineering[J].Biomaterials,2010,31(3):461-466.
[33]Yang D Y,Lü X Y,Hong Y,et al.The molecular mechanism of mediation of adsorbed serum proteins to endothelial cells adhesion and growth on biomaterials[J].Biomaterials,2013,34(23):5747-5758.
[34]Xu Q,Pang M Z,Peng Q,et al.Application of supercritical carbon dioxide in the preparation of biodegradable polylactide membranes[J].Journal of Applied Polymer Science,2004,94(5):2158-2163.
[35]Xu Q,Pang M Z,Peng Q,et al.Effect of different experimental conditions on biodegradable polylactide membranes prepared with supercritical CO2as nonsolvent[J].Journal of Applied Polymer Science,2005,98(2):831-837.
[36]Cao J H,Zhu B K,Ji G L,et al.Preparation and characterization of PVDF-HFP microporous flat membranes by supercritical CO2induced phase separation[J].Journal of Membrane Science,2005,266(1):102-109.
[37]Huang S R,Wu G Z,Chen S M.Preparation of microporous poly(vinylidene fluoride) membranesviaphase inversion in supercritical CO2[J].Journal of Membrane Science,2007,293(1):100-110.
[38]Reverchon E,Cardea S,Rapuano C.Formation of poly-vinyl-alcohol structures by supercritical CO2[J].Journal of Applied Polymer Science,2007,104(5):3151-3160.
[39]Matsuyama H,Yamamoto A,Yano H,et al.Effect of organic solvents on membrane formation by phase separation with supercritical CO2[J].Journal of Membrane Science,2002,204(1):81-87.
[40]Reverchon E,Cardea S.Formation of polysulfone membranes by supercritical CO2[J].The Journal of Supercritical Fluids,2005,35(2):140-146.
[41]Tsivintzelis I,Pavlidou E,Panayiotou C.Porous scaffolds prepared by phase inversion using supercritical CO2as antisolvent:Ⅰ.Poly(L-lactic acid)[J].The Journal of Supercritical Fluids,2007,40(2):317-322.
[42]Reverchon E,Rappo E S,Cardea S.Flexible supercritical CO2-assisted process for poly(methyl methacrylate) structure formation[J].Polymer Engineering & Science,2006,46(2):188-197.
[43]Temtem M,Casimiro T,Aguiar-Ricardo A.Solvent power and depressurization rate effects in the formation of polysulfone membranes with CO2-assisted phase inversion method[J].Journal of Membrane Science,2006,283(1):244-252.
[44]Reverchon E,Cardea S.Formation of cellulose acetate membranes using a supercritical fluid assisted process[J].Journal of Membrane Science,2004,240(1):187-195.
[45]石瑛君,贺高红,石文华,等.超临界 CO2法制备乙酸纤维素微孔膜[J].化工进展,2009,28(1):121-125.
[46]Tsivintzelis I,Marras S I,Zuburtikudis I,et al.Porous poly(L-lactic acid) nanocomposite scaffolds prepared by phase inversion using supercritical CO2as antisolvent[J].Polymer,2007,48(21):6311-6318.
[47]Reverchon E,Cardea S.PVDF-HFP membrane formation by supercritical CO2processing:Elucidation of formation mechanisms[J].Industrial & Engineering Chemistry Research,2006,45(26):8939-8945.
[48]Reverchon E,Cardea S,Schiavo Rappo E.Membranes formation of a hydrosoluble biopolymer(PVA) using a supercritical CO2-expanded liquid[J].The Journal of Supercritical Fluids,2008,45(3):356-364.
[49]Temtem M,Silva L,Andrade P Z,et al.Supercritical CO2generating chitosan devices with controlled morphology.Potential application for drug delivery and mesenchymal stem cell culture[J].The Journal of Supercritical Fluids,2009,48(3):269-277.
[50]Reverchon E,Cardea S,Rappo E S.Production of loaded PMMA structures using the supercritical CO2phase inversion process[J].Journal of Membrane Science,2006,273(1):97-105.
[51]Cardea S,Sessa M,Reverchon E.Supercritical phase inversion to form drug-loaded poly(vinylidene fluoride-co-hexafluoropropylene)membranes[J].Industrial & Engineering Chemistry Research,2010,49(6):2783-2789.
[52]Duarte A R C,Mano J F,Reis R L.Supercritical phase inversion of starch-poly(ε-caprolactone) for tissue engineering applications[J].Journal of Materials Science:Materials in Medicine,2010,21(2):533-540.
[53]Duarte A R C,Mano J F,Reis R L.Enzymatic degradation of 3D scaffolds of starch-poly-(?-caprolactone) prepared by supercritical fluid technology[J].Polymer Degradation and Stability,2010,95(10):2110-2117.
[54]杨春蓉,王迎军,陈晓峰.生物活性玻璃-胶原-磷酸丝氨酸复合支架的调控矿化和生物反应[J].中国科学:生命科学,2012,42(3):240-245.
[55]Deng A H,Chen A Z,Wang S B,et al.Porous nanostructured poly-L-lactide scaffolds prepared by phase inversion using supercritical CO2as a nonsolvent in the presence of ammonium bicarbonate particles[J].The Journal of Supercritical Fluids,2013,77:110-116.
[56]Beachley V,Wen X.Polymer nanofibrous structures:Fabrication,biofunctionalization,and cell interactions[J].Progress in Polymer Science,2010,35(7):868-892.

