不同温度下微生物燃料电池的运行特性
赵煜,薄晓,马彦,王俊文,王彦平,李婷,刘平,常瑜
(太原理工大学洁净化工研究所,山西 太原 030024)
随着人口数量的增多和人类活动消耗的增加,生活废水排放量急剧增加。作为水体的重要污染源,它会造成水体的富营养化,加剧水资源尤其是饮用水资源的供需矛盾,危害极大[1]。生活污水处理逐渐成为必须要解决的重大环保课题。目前,处理生活废水的方法有生物处理法、化学处理法、物理处理法、生物接触氧化法等,但这些传统的污水处理方法能耗大、成本高,有些还会造成二次污染。微生物燃料电池(microbial fuel cell,MFC)技术[2]是一种融合废水处理和生物发电的新型技术,具有操作条件易调控、连续、安全、原料多样、生物相容性好等优点,能在处理废水的同时产生电能,因此受到越来越多的关注。
在微生物燃料电池中,微生物以有机燃料作为能量来源,其降解有机物所产生的电子从阳极经过外电路抵达阴极,体系产生外电流;同时分解有机物产生的质子从阳极室透过质子膜到达阴极。MFC体系中,微生物作为生物催化剂,是微生物燃料电池的核心。目前,关于电子向阳极的传递机理有两种理论:直接电子转移机理和间接电子转移机理。直接电子转移机理指电子直接从外部的细胞膜转移到电极上;间接电子转移机理指需要中介体充当“电子穿梭体”而传递电子,因此依据电子传导方式将生物燃料电池分为直接型和间接型。本实验所采用的生活污水电池体系勿需添加中介体,属于直接型微生物燃料电池。MFC应用于生活废水处理,能自身产生处理废水所需耗能,有望改变高成本处理废水的现状[3-5]。
目前关于 MFC的研究更多集中于微生物产电机理、电池构型、电极材料等方面,而运用交流阻抗、循环伏安等电化学方法探讨电池电化学特性的研究则相对较少。本研究考察了体系温度分别为18 ℃、25 ℃、32 ℃、39 ℃、46 ℃时,MFC处理生活废水的电化学性能。
1 实验部分
1.1 MFC装置和材料
MFC装置如图1所示。阴极室和阳极室的几何尺寸相同,均是3.5 cm×4.5 cm×5.5 cm,两室间由Nafion 212质子交换膜分隔开,膜面积是1 cm2,阳极是4 cm2碳毡,阴极是1 cm2铂网,阴极和阳极间距是2.5 cm。阴极与阳极间外电路由铜线连接,在导线和电极连接处涂抹上环氧树脂密封,以防止铜离子对细菌的毒害。同时能起到绝缘作用,防止漏电,外电路接上1000 Ω恒外阻。阳极室用胶带密封用以隔绝空气,保持细菌的厌氧环境。
碳毡,来自上海骐杰碳素材料有限公司,厚度是0.28 mm。使用前先于0.5 mol/L HCl中浸泡2 h,再在0.5 mol/L NaOH中浸泡2 h,最后用蒸馏水浸泡5 h。

图1 生物燃料电池装置图
Nafion 212膜,购自美国杜邦公司,使用前依次在 3%(质量分数)H2O2、去离子水、0.5 mol/L H2SO4、去离子水各处理1 h,最后保存在去离子中待用。
Pt网电极,购自天津艾达,纯度99.99%,网径为0.335 mm,规格为1 cm×1 cm。
1.2 MFC工作原理
微生物燃料电池是一种电化学反应装置,微生物作为其催化剂氧化分解有机物质,将有机物蕴含的化学能转化为电能。在厌氧条件下,阳极室里的微生物在分解有机物产生电子与质子,一些电子通过一组呼吸酶在细胞内传递,以三磷酸腺苷形式为细胞提供能量;另一些电子通过外电路传递到阴极,被电子受体接受;质子通过质子膜传递到阴极与电子和氧结合生成水,从而形成一个闭合回路。
1.3 阴、阳极液组成
混合菌来自太原杨家堡生活污水处理厂的缺氧池。
阴极液由0.10 mol/L磷酸钠盐缓冲溶液和0.10 mol/L铁氰化钾溶液组成,最后将pH值调至7。
阳极液的组成为葡萄糖5.56×10−3mol/L、硫酸铵 4.20×10−3mol/L、硫酸锰 1.20×10−4mol/L、硫酸镁 8.00×10−4mol/L、氯化铵 5.80×10−3mol/L、氯化铁 3.70×10−6mol/L、氯化钾 1.70×10−3mol/L、氯化钙 1.40×10−4mol/L、碳酸氢钠 3.70×10−2mol/L、二水合磷酸二氢钠6.17×10−2mol/L、十二水合磷酸氢二钠3.80×10−2mol/L,溶剂是缺氧池生活污水,最后把pH值调为7.0。
生活污水成分:硫化物125 mg/L、氨氮42.90 mg/L、含磷量4.40 mg/L。
阴、阳极液的体积均为50 mL。
本实验考察了体系温度分别为18 ℃、25 ℃、32 ℃、39 ℃、46 ℃时,MFC处理生活废水时电池的产电性能。实验温度是通过恒温培养摇床(上海申贤恒温设备厂FLY-100C)建立和保持的,过程中用温度计进行校验,以确保温度的准确性。
运行前,通入20 min氮气除去阳极室中溶解氧以确保阳极厌氧环境。
1.4 MFC运行和测试
1.4.1 MFC运行
实验采用在线驯化法形成成熟的生物膜[6],即将电池接入到一个闭合回路,采用间歇运行方式,每隔五天更换一次阳极液,连续运行5个周期,污泥中的产电菌在电化学环境下,通过最初的接种及生长,最终粘附在阳极上而形成成熟的生物膜,这也是产电菌电化学活性逐渐增强并且适应产电的过程,然后考察体系在各温度条件时电池电化学性能。由于阳极液中的葡萄糖在生物电化学催化过程中会生成许多复杂的中间产物,如乙酸、丙酸、乳酸等挥发性脂肪酸及醇等[7]。阳极体系中的生物催化反应比较复杂,反应机理有待进一步探讨。如果葡萄糖完全氧化为二氧化碳,则阳极室中的化学计量关系为式(1)。
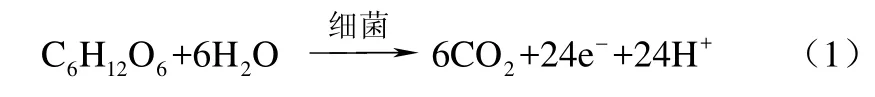
阴极室中氰化铁离子循环利用反应如(2)、式(3)所示。

燃料电池系统中,葡萄糖氧化和铁还原的总化学计量关系如式(4)所示。

1.4.2 MFC的测定分析
以阳极室中碳纤维毡作工作电极,阴极室中铂网作为辅助电极,以饱和甘汞电极(Hg/Hg2Cl2)作为参比电极,组成三电极测试系统。用多通道电化学工作站测试电池电化学性能。相邻电化学测试间隔2 h,以确保电池体系在平稳后再进行新的测试。循环伏安测试参数设定:电势扫描速度为5 mV/s,扫描范围为−0.6~0.8 V,测试时间约为50 min;电化学阻抗谱测试参数设置:正弦激励信号频率扫描范围100 kHz~5.000 MHz,振幅±10 mV,测试时间约为60 min。数据由EC-lab采集,绘制奈奎斯特图,应用Zsimp Win 3.10(Echem,US)电化学软件等效拟合EIS谱图。极化曲线测定设定扫描速度为1 mV/s,测试时间约为60 min。MFC的阴阳极之间连接电阻箱,在10~10 000 Ω连续改变外阻,用万能表记录随外阻变化时电压电流值。由功率P=IE,电流密度和功率密度由阳极电极面积计算得出。由公式(5)知,当外阻与内阻值相同时,所得功率密度最大[8]。

公式中电池的功率输出与 MFC内阻与外阻和的平方成反比。式中,P为功率密度,mW/m2;r为内阻,Ω;R为外阻,Ω。
2 结果与讨论
2.1 不同温度下循环伏安曲线
图2表示5个不同温度下的循环伏安曲线。循环伏安法用来确定氧化还原活性物质的氧化还原电位,可以用来阐明微生物菌落的电化学活性。由图2能够看出:循环伏安曲线有明显的氧化峰和还原峰,表明生活废水中的产电菌能够通过自身产生电子传递媒介的方式产电[9-10]。体系温度从 18~32 ℃,随着温度升高,氧化还原峰越来越明显。循环伏安曲线内所包围的面积越大,表明基质越多氧化还原反应也越强烈,体系的电化学活性越好。当温度继续升高时,循环伏安图的氧化还原峰出现回落,可见温度过高无助于体系产电,可能是由于温度过高不利于产电菌的生长,使产电细菌的产电能力下降。

图2 生物燃料电池的循环伏安曲线
2.2 MFC运行中的阳极阻抗测试
电化学阻抗(EIS)测试可以用来分析微生物燃料电池阳极室内部阻抗的组成和变化 。图3是不同温度下电池阻抗图谱,其由高频区的半圆形和低频区的短直线部分组成,分别代表传荷阻抗和扩散阻抗。采用图4所示等效电路图{Rs[Q(RctW)]}进行拟合,其中Rs代表溶液欧姆电阻,由电解质里的质子或离子和电子通过溶液传递时受到阻力引起的;Q为常相位元件,常用来拟合分散电容的非理想行为[11];Rct是电荷传递阻抗;W为Warburg扩散阻抗,由界面电荷分布状态的变化而引起,出现在低频端,属于平面无限扩散过程。极化内阻电化学反应时的电荷传递和活化能引起的,即电化学反应所必须克服的活化能能垒引起的。微生物形成的生物膜是氧化反应的催化剂,生物膜是细菌生长形成的细菌团块与细胞外基质的复合体。生物膜好,说明细菌团块活性强,这有利于电子的传导,因此阻抗也就小。驯化细菌结果的好坏是导致产电性能变化的直接原因。生物膜的好坏是通过细菌的循环伏安氧化还原峰的强弱体现的,循环伏安氧化还原峰越明显说明驯化形成的生物膜越好,电极表面电化学反应阻力越小,阳极的极化内阻也就越小。表1为拟合等效电路图中的各阻抗值。由表可知,体系温度为18 ℃、25 ℃、32 ℃、39 ℃、46 ℃时对应的传荷阻抗分别为 341.1 Ω、47.06 Ω、12.2 Ω、40.93 Ω、660.4 Ω,溶液内阻分别为 7.01 Ω、8.95 Ω、13.56 Ω、3.90 Ω、2.57 Ω,传荷阻抗Rct在阳极内阻中占的比例分别为 97.99%、84.02%、47.36%、91.30%、99.61%。体系在各温度中,32 ℃时传荷阻抗最小,且和其溶液内阻大小最为接近,这表明通常传荷阻抗与其他阳极阻抗比占主要份额,减小传荷阻抗是内阻下降的关键,对提高电化学反应有决定性的影响。传荷阻抗主要是由于细菌新陈代谢和电子传递引起的。微生物电化学活性越好,参与化学反应的细菌就越多,反应阻力和阳极内阻也越小。32 ℃时,细菌活性最强,此时的传荷阻抗最小,其他温度下细菌活性不如32 ℃时,所以内阻也大些。
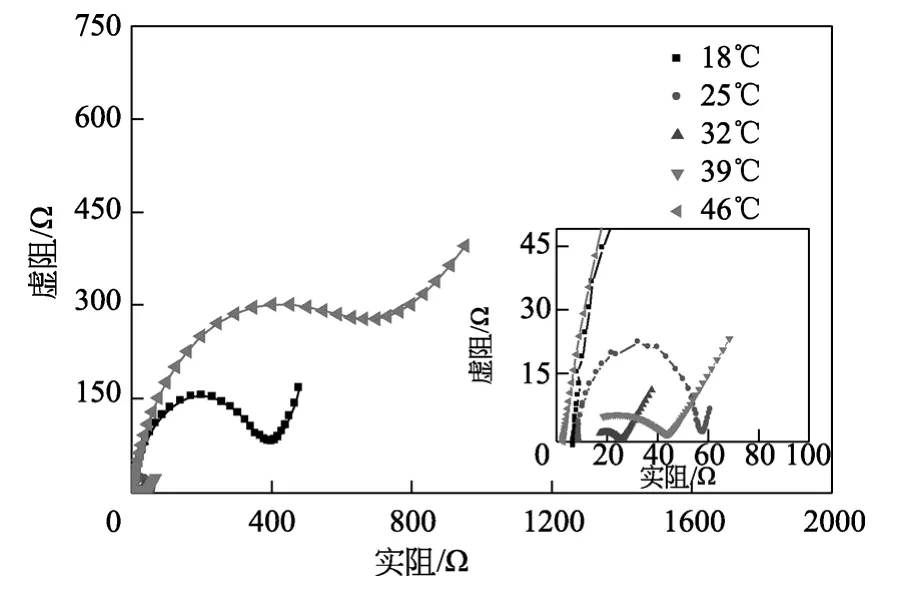
图3 不同温度下微生物燃料电池的阻抗谱图

图4 MFC阳极等效电路图
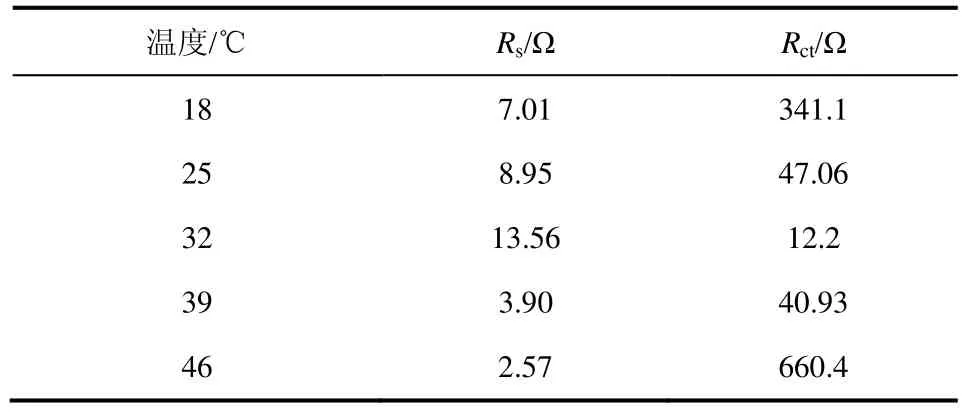
表1 不同温度下阻抗拟合数据
根据式(6),由传荷阻抗可计算得到动力学参数——交换电流密度I0[12]。

式中,n为1 mol葡萄糖氧化转移的电子摩尔数;Rg是普适气体常数;T为温度,℃;Rct为极化阻抗,Ω;F是法拉第常数。
表2列出了不同温度下的各组的交换电流密度。电池温度为 32 ℃时的交换电流密度最大。说明此温度下体系反应速率最大。
2.3 不同温度下功率密度与电流密度关系曲线
在实际应用过程中,微生物燃料电池的输出功率是判断电池性能的一个重要指标。图5是微生物燃料电池体系在不同温度下的功率密度随电流密度的变化关系。温度从18 ℃上升到32 ℃的过程中,电池的产电功率密度一直在增加,但当温度超过32 ℃以后,功率密度开始逐渐下降,最大功率密度出现在32 ℃时,达到156.2 mW /m2。电池产电能力和系统内阻和外阻和的平方成反比,因此 32 ℃时电池内阻最小。电池内阻包括阳极电解液阻力、阳极膜上传荷阻力、质子交换膜阻力、阴极电解液阻力和阴极电化学反应阻力。温度上升,有利于阴、阳极液中分子的扩散,有助于离子迁移。离子的迁移速率变快,电解液的传导能力变强,电解液和传质阻力下降。同时,阴极的电荷转移速率也会升高,阴极铂催化剂上的还原反应变快。由前面阻抗分析可知,生物膜上的传荷阻抗在阳极内阻中占绝对份额,内阻主要是传荷阻抗构成。32 ℃时菌落电化学活性最强,传荷阻抗最小,从而整个体系内阻最低,有利于系统发电,和Manohar等[13]的结论相一致。

表2 不同温度下的交换电流密度

图5 功率密度曲线随电流密度变化关系曲线
2.4 不同温度下的极化曲线
图6为不同温度下阳极过电位与电流密度关系曲线。在MFC中电极的过电位来自3部分:活化损失、细菌的新陈代谢引起的损失和传质损失。活化损失是由最初的氧化反应或还原反应引起的能量损失,以及电子从细胞终端蛋白或酶传递到阳极表面引起的能量损失。活化损失体现在图6的低电流密度区。由图6可知,相对同一电流密度值,32 ℃时的阳极电极电势最低。温度升高,电子的传递能力增强,传递效率提高,阳极电位降低。阳极电势越低,越有利于细菌产电。温度过高又会影响驯化出的产电菌数量,不利于产电效率的提高。
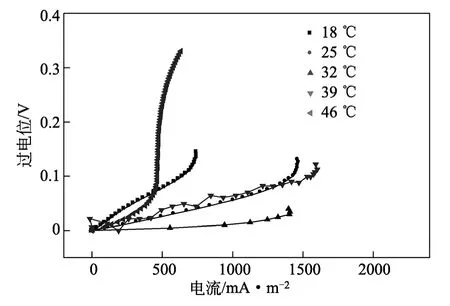
图6 不同温度下的极化曲线
3 结 论
(1)在一定温度范围内,提高温度有利于微生物生长和繁殖,能有效提高细菌的电化学活性和产电能力。研究发现在 32 ℃时,生物膜的电化学活性最好。
(2)传荷阻抗在阳极内阻中占绝对份额,MFC是传荷过程控制下的电化学反应体系。生物膜的电化学活性对电池的产电能力起着至关重要的作用。
(3)体系在 18 ℃、25 ℃、32 ℃、39 ℃和46 ℃对应的交换电流密度分别为 1.67×10−6mA/m2、1.68×10−5mA/m2、8.02×10−5mA/m2、3.01×10−5mA/m2、2.20×10−6mA/m2。温度为 32 ℃时的交换电流密度最大;反应速率也最大。
(4)微生物的产电活性高,有利于电子的传导,减小阳极过电位。在同一电流密度下,温度为32 ℃时的阳极过电位最低。
(5)微生物燃料电池的内阻越小,阳极电势越低,对电池功率的输出越有利。在温度为 32 ℃时具有最大的功率密度156.2 mW/m2。
[1]Liu H,Ramnarayanan R,Logan B E.Production of electricity during wastewater treatment using a single chamber microbial fuel cell[J].Environ.Sci.Technol.,2003,38:2281-2285.
[2]Mohan S V,Mohanakrishna G,Reddy B P,et al.Bioelectricity generation from chemical wastewater treatment in mediatorless(anode) microbial fuel cell (MFC) using selectively enriched hydrogen producing mixed culture under acidophilic microenvironment[J].Biochemical Engineering,2008,39:121-130.
[3]Logan B E,Regan J M.Microbial fuel cell challenges and applications[J].Environ.Sci.Technol.,2006,40(17):5172-5180.
[4]张辉,胡勤海,吴祖成,等.城市污泥能源化利用研究进展[J].化工进展,2013,32(5):1145-1151.
[5]Rozendal R A,Hamelers H V,Rabaey K,et al.Towards practical implementation of bio- electrochemical wastewater treatment[J].Trends in Biotechnology,2008,26(8):450-459.
[6]郗名悦,孙彦平.介体型MFC内微生物催化剂的在线驯化[J].太原理工大学学报,2008,39(6):554- 558.
[7]张歆.直接氧化型葡萄糖燃料电池的研制[J].中山大学学报,1998,37:61-64.
[8]尤世界,赵庆良,姜珺秋.废水同步生物处理与生物燃料电池发电研究[J].环境科学,2006,27(9):1786-1790.
[9]Hernandez M E,Kappler A,Newman D K.Phenazines and other redox-active antibiotics promote microbial mineral reduction[J].Appl.Environ.Microbiol.,2004,70:921-928.
[10]Gralnick J A,Newman D K.Extracellular respiration[J].Mol.Microbiol.,2007,65:1-11.
[11]Ramasamy R P,Ren Z Y,Mench M M,et al.Impact of initial biofilm growth on the anode impedance of microbial fuel cells[J].Biotechnology and Bioengineering,2008,101(1):101-108.
[12]Jong B C,Kim B H,Chang I S,et al.Enrichment,performance,and microbial diversity of a thermophilic mediatorless microbial fuel cell[J].Environ.Sci.Technol.,2006,40(20):6449-6454.
[13]Manohar A K,Mansfeld F.The internal resistance of a microbial fuel cell and its dependence on cell design and operating conditions[J].Electrochimica Acta,2009,54:1664-1670.

