ZrO2-Al2O3复合载体对镍基催化剂甲烷化性能的影响
杨霞,田大勇,孙守理,孙琦
(北京低碳清洁能源研究所,北京 102209)
天然气由于具有清洁、高热值等优点在全球能源消费结构中所占份额逐年扩大,已成为能源消费结构中的重要角色。我国“富煤,缺油,少气”的资源结构导致天然气供求矛盾突出,据统计,2012年国内天然气供需缺口已高达394亿立方米[1],随着我国国民经济的快速发展和环保要求的日益提高,未来天然气的供需缺口将逐年增大。而我国煤炭资源相对丰富,将煤依次通过气化、水煤气变换、甲烷化等工艺来生产合成天然气(SNG)不但可以实现煤资源洁净转化,还能有效补充国内的天然气供应,缓解天然气供需失衡的压力。煤制天然气的核心技术是甲烷化工艺,由于煤气化所制得粗煤气中H2/CO 比通常处在 0.3~1.8[2],为满足甲烷化反应(CO + 3H2—→CH4+ H2O)的需要并避免催化剂的快速失活,在传统工艺中原料气进入甲烷化装置前需预先进行水煤气变换以调变H2/CO比。若能开发出一种在低H2/CO比条件下仍能保持较好活性与稳定性的甲烷化催化剂,则可省去水煤气变换工艺,这将在一定程度上简化工艺流程与系统设备,降低投资成本。
早在 20世纪初,Sabatier和 Senderens[3]发现Ni是非常有效的甲烷化催化剂,时至今日,Ni基催化剂依然被大多数研究者所选用[4-10]。Ni基催化剂具有较高的催化活性,对甲烷选择性好,价格相对便宜,目前处于工业开发阶段的甲烷化催化剂的活性组分几乎均采用Ni。Ni基催化剂的主要缺点是容易积炭和硫中毒,积炭所造成的催化剂孔道堵塞、表面活性位被覆盖或活性组分流失是导致催化剂失活的主要原因[11-13],因此具有良好工业应用前景的甲烷化催化剂不仅要求其甲烷化活性高、稳定性好,还要求其具备较佳的抗积炭性能。近年来,甲烷化反应机理以及积炭的产生均已得到较深入的研究。目前普遍认为 CO甲烷化反应机理为碳化物机理[14-15],即吸附态的CO首先解离形成表面碳物种(C*),表面C*与活化H(H*)作用逐步生成CH4,当所产生的C*不能及时充分地得到H*供应,便以一定速度扩散迁移到Ni体相中形成炭沉积。因此在低H2/CO比下的甲烷化过程中,Ni基催化剂更易形成积炭,这也对催化剂的配方设计提出了更高的要求。
目前处于工业应用的甲烷化催化剂大多以γ-Al2O3为载体,Al2O3具有比表面积大和价格低廉等优点,γ-Al2O3表面上的Al3+和O2−离子具有很强的剩余成键能力,可与Ni2+相互作用形成较强的离子键,有利于NiO在γ-Al2O3表面上均匀分散。然而经高温焙烧后,部分Ni2+向Al2O3体相扩散,进入Al2O3晶格内部,形成难以被还原的镍铝尖晶石(NiAl2O4)[16],导致活性物种的有效利用率降低,因而催化剂的制备条件以及助剂的选择甚为关键。ZrO2是一种颇有特色的氧化物,其表面同时具有氧化还原性和酸碱性,且表面和内部均易产生氧空位,用作催化剂载体或助剂时可提高活性组分的分散度,促进催化剂还原,改善催化剂的稳定性,但由于 ZrO2比表面积小且价格昂贵,限制了其普遍使用。将ZrO2引入其他氧化物中制备成复合载体不仅可兼具各单一氧化物的优点,还具有一些独特的物理化学性质,因而近年来已引起广泛的研究兴趣。胡雪娟等[17]和Cai等[18]采用复合载体ZrO2-Al2O3负载Ni催化剂,发现该催化剂比以单一Al2O3载体负载的Ni催化剂更易于还原,金属组分的分散度有所提高,从而表现出更好的催化性能。Wang等[19]考察了Ni/ZrO2-SiO2催化剂的甲烷化性能,发现负载于复合载体上Ni的分散度和还原度较负载于SiO2上明显提高,ZrO2的引入有助于减小 Ni颗粒的尺寸,增加活性中心数目,提高催化剂的甲烷化活性。
本文采用浸渍法制备ZrO2-Al2O3复合氧化物载体和负载Ni基催化剂,在固定床微反装置上考察催化剂在低H2/CO比原料气中的甲烷化催化活性,利用 N2物理吸附、XRD、H2-TPR、H2-TPD和 TPO等表征手段,探讨 ZrO2助剂对催化剂微观结构和CO甲烷化性能的影响。
1 实验部分
1.1 催化剂的制备
ZrO2-Al2O3复合载体采用浸渍法制备。称取计量的ZrO(NO3)2·2H2O溶于去离子水,加入γ-Al2O3(德国Sasol公司,比表面积213 m2/g,粒径0.2~0.5 mm)载体,室温下搅拌4 h后,用旋转蒸发仪于 60 ℃下将水快速蒸干。旋蒸后的样品置于110 ℃的烘箱中干燥过夜,然后在马弗炉中650 ℃下焙烧5 h,即制得ZrO2-Al2O3复合载体。其中,ZrO2质量分数分别为0、5%、10%、15%和20%。
将上述复合载体浸渍于 Ni(NO3)2·6H2O 溶液中,搅拌4 h后移至旋转蒸发器中快速蒸干,然后在110 ℃下干燥过夜,干燥后的样品于550 ℃下焙烧5 h。所得的样品经研磨筛分,取粒径为40~60目的颗粒备用。其中,金属Ni的负载量均为12%(质量分数)。各催化剂根据载体中ZrO2质量分数不同,分别标记为Ni/Al、Ni/5Zr-Al、Ni/10Zr-Al、Ni/15Zr-Al和 Ni/20Zr-Al。
1.2 催化剂的表征
催化剂的比表面积和孔结构在 Micromeritics ASAP 2010C吸附仪上用N2吸附法测定,样品在测定前于 200 ℃下真空脱气处理 2 h。XRD表征在Bruker D8 Advance型X射线衍射仪上进行,辐射源为CuKα(λ= 0.15406 nm),管电压40 kV,管电流40 mA,步长0.02°。程序升温还原(H2-TPR)和程序升温脱氢(H2-TPD)测试在自制的程序升温装置上进行,200 mg样品首先在氧气气流(40 mL/min)中升温至 550 ℃预处理30 min,然后降至室温,切换为5%H2/Ar(体积分数)混合气,待TCD基线稳定后,以10 ℃/min升温至950 ℃进行程序升温还原,还原结束后,催化剂在还原气氛中降至室温,再切换为 Ar气。待热导基线稳定后,以10 ℃/min的速率升温至850 ℃进行H2-TPD实验。尾气经冷阱(−85 ℃)脱水后用TCD检测H2含量变化。催化剂上的积炭类型和积炭量用程序升温氧化(TPO)在Mettler-Toledo TGA/SDTA 851e热分析仪上进行,样品装填量20~30 mg,采用空气气氛(50 mL/min),以10 ℃/min的升温速率将样品从室温升到800 ℃。
1.3 催化剂的活性评价
在内衬石英管(d= 8 mm)的固定床微型反应器上进行催化剂活性评价。催化剂的填装量为 500 mg。反应前,催化剂在 50 mL/min的还原气(10%H2/Ar,体积分数)中800 ℃下还原2 h。反应原料为H2与CO的混合气(H2/CO = 1.06∶1),空速(GHSV)为24000 mL/(g·h)。产物经冷凝除水后进入安捷伦 7890A型气相色谱仪(TCD检测器TDX-01色谱柱,柱长1 m)进行在线检测。
2 结果与讨论
2.1 结构性质
表1列出各催化剂的结构参数。可以看出,随着载体中ZrO2载量的增加,催化剂的比表面积和孔容逐渐减小,平均孔径逐渐增加,这可能是由于ZrO2和NiO沉积在催化剂表面,堵塞了部分微孔。
2.2 物相分析
图1为各Ni/Zr-Al催化剂的XRD谱图。由图1可以看到,各催化剂在2θ= 31.8°、37.2°、45.3°和66.5°处有明显的衍射峰,且峰形均较宽化。镍铝尖晶石 NiAl2O4(JCPDS 10-0339,2θ= 31.4°,37.0°,45.0°,65.5°)与γ-Al2O3(JCPDS 10-0425,2θ=31.9°,37.6°,45.9°,67.0°)的特征衍射峰较为接近[20-21],NiAl2O4的最强衍射峰出现在37°附近,γ-Al2O3的最强衍射峰出现在67°附近,因此上述所检测到的衍射峰可归属为 Al2O3和NiAl2O4衍射峰的重叠。Ni/Al催化剂的XRD谱中可辨认出微弱的 NiO衍射峰,而 Ni/5Zr-Al与Ni/10Zr-Al催化剂中没有观察到NiO的特征峰,说明NiO在5Zr-Al和10Zr-Al载体上分散性较好;继续增加ZrO2载量至15%(质量分数)以上,催化剂中可以观察到明显的NiO衍射峰,且随ZrO2载量的增加,NiO的衍射峰变得更加尖锐。此外,当ZrO2载量的提高至 10%(质量分数),即可观察到四方相ZrO2的特征衍射峰,并随ZrO2载量的增加,ZrO2衍射峰强度逐渐增加。以上结果表明添加适量ZrO2助剂可有助于促进镍物种的分散,但ZrO2载量过高会导致催化剂比表面积大幅下降,表面NiO的结晶度提高,Ni晶粒尺寸增加,分散性变差。

表1 催化剂的结构性质

图1 Ni/ZrO2-Al2O3催化剂的XRD图
2.3 H2-TPR分析
Ni/Al2O3催化剂体系中,可还原的 Ni物种按TPR还原峰温一般可分为3种类型:与载体有弱相互作用的α型(还原峰温 290~470 ℃)、与载体有强相互作用的 β型(470~740 ℃)和具有镍铝尖晶石结构的γ型(740~890 ℃)[22]。图2给出了各Ni/Zr-Al催化剂的H2-TPR图,并通过高斯方程对各还原峰进行分峰拟合。Ni/Al的H2-TPR谱图上可观察到主要有两个还原峰,峰温为 691 ℃和765 ℃,分别归属于与载体具有强相互作用的NiO的还原和镍铝尖晶石的还原,高温还原峰的峰面积明显大于低温峰,说明Ni/Al催化剂中Ni物种与载体Al2O3间存在强相互作用,大部分Ni2+进入Al2O3晶格内部,形成难以还原的尖晶石结构。随着ZrO2的加入,催化剂的还原峰明显向低温方向移动,且峰型宽化,这说明ZrO2的添加使活性组分与载体的相互作用减弱。

图2 Ni/ZrO2-Al2O3催化剂的H2-TPR图

表2 Ni/ZrO2-Al2O3催化剂的H2-TPR数据
催化剂中各还原峰温与还原峰面积定量计算结果如表2所示。从表2可以看到,随着ZrO2载量的提高,β型和γ型的峰温均逐渐向低温方向移动,且 β型的还原峰所占比例逐渐增加,这说明 ZrO2的添加显著地抑制了NiAl2O4的生成,促进了镍物种的还原。同时催化剂的还原度也随ZrO2的载量逐渐增大,这说明ZrO2的存在提高了活性镍物种的还原能力。这可能是由于ZrO2与Al2O3存在一定的相互作用[17,23],通过形成Zr—O—Al键或渗入对方晶格中形成固溶体[24],阻碍Ni进入Al2O3晶格中形成镍铝尖晶石,从而提高活性物种的有效利用率。
2.4 H2-TPD分析
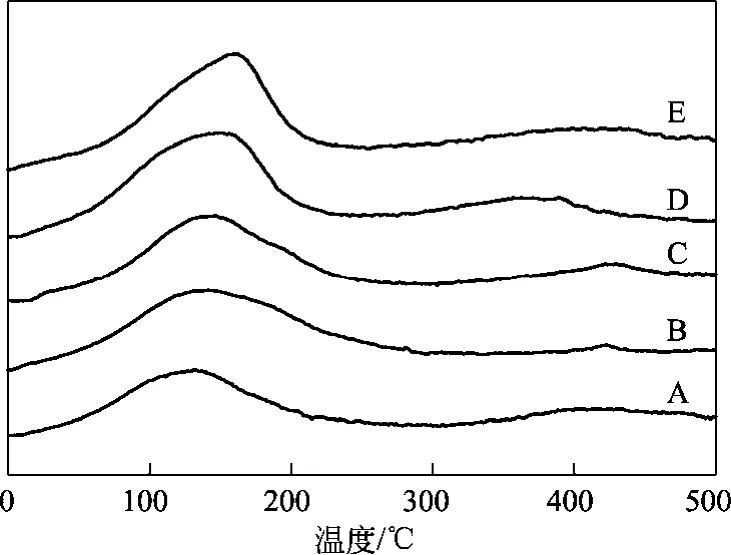
图3 Ni/ZrO2-Al2O3催化剂的H2-TPD图
为了进一步考察还原后催化剂表面 Ni粒子的结构特征,对各催化剂进行了H2-TPD分析,结果如图3所示。从图3可以看到各样品在低温区(50~200 ℃)和高温区(350~450 ℃)均有H2脱附峰,且最主要的脱附峰出现在低温区。低温区的脱附峰可归属为吸附于催化剂表面Ni0活性位点的H2的脱附,一般认为该脱附峰面积与活性中心数相关联[25]。随着 ZrO2的添加,低温脱附峰中心向高温方向移动,当ZrO2载量从0增加到20%(质量分数),低温脱附峰从129 ℃提高到159 ℃,这表明ZrO2的添加增强了催化剂对H2的吸附能力。高温区的脱附峰(350~450 ℃)归属为吸附于金属次表层或溢流氢的脱附,可以看到各催化剂的高温脱附峰均较微弱。通过对脱附峰面积进行定量计算,ZrO2载量为 0、5%、10%、15%、20%(质量分数)时,H2脱附量分别为 0.09 mmol/g、0.10 mmol/g、0.12 mmol/g、0.13 mmol/g、0.13 mmol/g,这说明ZrO2载量越高,暴露在表面的Ni活性位数目越多,使得催化剂表面具有更多的H2吸附位点。
2.5 催化剂的反应性能
在不同反应温度下,Ni/Al、Ni/10Zr-Al和Ni/20Zr-Al催化CO甲烷化反应的结果如图4所示。由图4(a)可以看出,反应温度低于 450 ℃时,CO转化率随反应温度的升高而增加,在450 ℃时达到最大值,在此温度下,Ni/Al、Ni/10Zr-Al和Ni/20Zr-Al催化剂的 CO转化率分别为 75.4%、79.9%和71.3%。继续升高反应温度,CO转化率逐渐降低。由图4(b)可以看到,反应温度为300 ℃时,CH4的选择性较低,气体产物中除CH4和CO2外,还检测到C2H6和C3H8等副产物。随着反应温度升高,CH4选择性逐渐增加,在反应温度高于400 ℃后,CH4选择性增加幅度变缓,在 650 ℃时 CH4选择性接近50%。CO甲烷化反应为强放热反应,低温有利于CO的转化,但反应温度过低会减慢反应速率,为了发挥催化剂的最佳性能,反应需要在适宜的温度范围内进行。在本实验条件下,400~500 ℃范围内是较适宜的反应活性温区。

图4 ZrO2载量对Ni基催化剂甲烷化性能的影响
通过比较各催化剂的甲烷化性能可以看出,在相同反应温度下,Ni/10Zr-Al催化剂的CO甲烷化活性要高于其他两个催化剂。H2-TPR分析结果显示,添加ZrO2后催化剂的还原度得到了一定程度的提高,且还原度随 ZrO2载量的增加而增加。然而ZrO2载量的增加会降低催化剂的比表面积和孔容,导致NiO在Al2O3表面团聚形成晶相颗粒,从而影响催化剂表面Ni物种的分散程度,进而影响催化剂的反应性能。因此,Ni/10Zr-Al催化剂具有良好的催化性能可能归因于催化剂中负载活性组分有较好的还原度与分散性。
2.6 催化剂的稳定性与积炭分析
为了进一步考察 ZrO2助剂对催化剂稳定性与抗积炭性能的影响,对各催化剂进行了稳定性测试,反应结果如图5所示。由图5可以看到,在测试的12 h内,各催化剂的CO转化率均随时间逐渐降低,说明Ni基催化剂在低H2/CO条件下进行甲烷化反应较易失活。ZrO2载量对催化剂的稳定性有较大影响,Ni/10Zr-Al催化剂的稳定性相对较佳,经12 h反应后 Ni/Al催化剂的 CO转化率下降约 9.9%,Ni/10Zr-Al催化剂的CO转化率下降约5.6%。

图5 不同ZrO2载量的催化剂的稳定性测试
为了分析催化剂表面的积炭性质,收集反应后的样品进行了TPO表征,结果如图6所示。由图6可以看到,Ni/Al催化剂上有 3个明显的耗氧峰,分别位于292 ℃、456 ℃和587 ℃,其中高温段耗氧峰所占面积最大。催化剂表面积炭根据不同反应活性可分为Cα、Cβ和Cγ3种类型。其中Cα气化温度较低,在反应中很容易消除,是生成甲烷的前体;而Cβ和Cγ气化温度相对较高,Cβ会随着时间、温度的变化转化为不易被消除的Cγ;Cγ为石墨化程度较高的非活性碳物种,会聚集在催化剂表面或孔道内部,是造成催化剂积炭失活的主要碳物种。根据以上分析,图6中 290 ℃附近的低温峰可归属为Cα的氧化,450 ℃附近的峰可认为是 Cβ的氧化,位于580 ℃左右的积炭物种可归属为Cγ。Ni/Al催化剂上Cβ和Cγ占主要部分,说明该催化剂上主要生成了活性较差的积炭。与Ni/Al催化剂相比,添加ZrO2后催化剂上Cβ和Cγ所占比例均明显减少,载体中ZrO2载量增加到10%(质量分数)以上,催化剂上只有两个明显的放热峰,对应于 Cα和 Cγ,其中 Cγ峰面积显著降低,表明催化剂中添加 ZrO2后可有效地抑制低活性碳物种的生成。此外,反应后催化剂表面的积炭量通过失重曲线进行分析,Ni/Al、 Ni/5Zr-Al、 Ni/10Zr-Al、 Ni/15Zr-Al 和Ni/20Zr-Al催化剂上的积炭量分别为 0.172 g/g、0.083 g/g、0.121 g/g、0.039 g/g和0.033 g/g催化剂。可以看到,添加ZrO2后催化剂的积炭量明显减少,这可能是由于ZrO2的引入促进了催化剂对H2的吸附与活化,有利于活性碳物种进行加氢反应生成甲烷,从而在一定程度上抑制了表面碳物种向体相扩散形成沉积炭。此外,Ni/10Zr-Al相比其他Ni/Zr-Al催化剂形成较多积炭的可能原因是该催化剂的甲烷化活性最高,催化剂表面具有加氢活性的碳物种向惰性碳物种的转变也同时加快,因而产生了更多的积炭。

图6 使用后催化剂的TPO曲线
3 结 论
采用分步浸渍法制备的 Ni/ZrO2-Al2O3催化剂对CO甲烷化反应表现出较好的活性、稳定性和抗积炭性能。ZrO2助剂的引入减弱了活性组分与载体间的相互作用,抑制难还原的镍铝尖晶石的生成,提高了镍物种的还原能力。适量ZrO2的添加还有利于镍物种在载体表面的分散,提高催化剂对H2的吸附强度,减少催化剂表面的碳沉积。特别值得指出的是,本文使用低H2/CO比和高空速来测试催化剂的CO甲烷化性能,所制备的Ni/ZrO2-Al2O3催化剂仍表现出较稳定的催化活性,显示出一定的应用前景。
[1]国家发展和改革委员会.2012年天然气行业运行简况[EB/OL].(2013-01-28)[2013-08-25].http://www.sdpc.gov.cn/jjxsfx/t20130128_524028.htm.
[2]唐宏青.现代煤化工新技术[M].北京:化学工业出版社,2009:45-114.
[3]Sabatier P,Senderens J B.New synthesis of methane[J].Hebdomadaires des Seances del Academie des Scrences,1902,134:514-516.
[4]Araki M,Ponec V.Methanation of carbon monoxide on nickel and nickel-copper alloys[J].Journal of Catalysis,1976,44(3):439-448.
[5]Dalla Betta R A,Piken A G,Shelef M.Heterogeneous methanation:Steady-state rate of CO hydrogenation on supported ruthenium,nickel and rhenium[J].Journal of Catalysis,1975,40(2):173-183.
[6]Bartholomew C H,Pannell R B,Butler J L.Support and crystallite size effects in CO hydrogenation on nickel[J].Journal of Catalysis,1980,65(2):335-347.
[7]Alstrup I.On the kinetics of Co methanation on nickel surfaces[J].Journal of Catalysis,1995,151(1):216-225.
[8]Takenaka S,Shimizu T,Otsuka K.Complete removal of carbon monoxide in hydrogen-rich gas stream through methanation over supported metal catalysts[J].International Journal of Hydrogen Energy,2004,29(10):1065-1073.
[9]Mcarthur D P,Linda Y.Thermally stable nickel-alumina catalysts useful for methanation and other reactions:US,4191664[P].1980-03-04.
[10]张成.CO与CO2甲烷化反应研究进展[J].化工进展,2007,26(9):1269-1273.
[11]Gierlich H H,Fremery M,Skov A,et al.Deactivation phenomena of a Ni-based catalyst for high temperature methanation[J].Studies in Surface Science and Catalysis,1980,6:459-469.
[12]Bartholomew C H.Carbon deposition in steam reforming and methanation[J].Catalysis Reviews Science and Engineering,1982,24(1):67-112.
[13]Inui T,Hagiwara T,Takegami Y.Prevention of catalyst deactivation caused by coke formation in the methanation of carbon oxides[J].Fuel,1982,61(6):537-541.
[14]Mccarty J G,Wise H.Hydrogenation of surface carbon on alumina-supported nickel[J].Journal of Catalysis,1979,57(3),406-416.
[15]陈刚,朱卓群.J105Ni催化剂上CO歧化反应的过渡应答研究[J].催化学报,1990,11(1):1-9.
[16]宋一兵,余林,郝志峰,等.CH4、CO2与 O2制合成气用Ni-Ce/γ-Al2O3催化剂的制备与催化活性的关系[J].应用化学,2001,18(11):903-907.
[17]胡雪娟,石秋杰,谌伟庆,等.Ni/ZrO2-Al2O3制备表征及催化性能的研究[J].化学研究与应用,2008,4:378-381.
[18]Cai M,Wen J,Chu W,et al.Methanation of carbon dioxide on Ni/ZrO2-Al2O3catalysts:Effects of ZrO2promoter and preparation method of novel ZrO2-Al2O3carrier[J].Journal of Natural Gas Chemistry,2011,20(3):318-324.
[19]Wang Y,Wu R,Zhao Y.Effect of ZrO2promoter on structure and catalytic activity of the Ni/SiO2catalyst for CO methanation in hydrogen-rich gases[J].Catalysis Today,2010,158(3/4):470-474.
[20]Xu Z,Li Y,Zhang J,et al.Bound-state Ni species - a superior form in Ni-based catalyst for CH4/CO2reforming[J].Applied Catalysis A:General,2001,210(1/2):45-53.
[21]Li G,Hu L,Hill J M.Comparison of reducibility and stability of alumina-supported Ni catalysts prepared by impregnation and co-precipitation[J].Applied Catalysis A:General,2006,301(1):16-24.
[22]Zhang J,Xu H,Jin X,et al.Characterizations and activities of the nano-sized Ni/Al2O3and Ni/La–Al2O3catalysts for NH3decomposition[J].Applied Catalysis A:General,2005,290(1/2):87-96.
[23]Iriondo A,Cambra J F,Güemez M B,et al.Effect of ZrO2addition on Ni/Al2O3catalyst to produce H2from glycerol[J].International Journal of Hydrogen Energy,2012,37(8):7084-7093.
[24]梁健,黄惠忠,谢有畅.共沉淀法制备 ZrO2-Al2O3纳米复合氧化物的物相表征[J].物理化学学报,2003,19(1):30-34.
[25]Velu S,Gangwal S K.Synthesis of alumina supported nickel nanoparticle catalysts and evaluation of nickel metal dispersions by temperature programmed desorption[J].Solid State Ionics,2006,177(7/8):803-811.

