藏药五脉绿绒蒿不同部位红外光谱的识别
赵庆帅 ,周玉碧,孙胜男,卢学峰,叶润蓉,彭 敏,孙 菁*
1中国科学院西北高原生物研究所,青海省青藏高原特色生物资源研究重点实验室,西宁 810008;2中国科学院大学,北京 100049
五脉绿绒蒿(Meconopsis quintuplinervia Regel.)是罂粟科(Papaveraceae)绿绒蒿属(Meconopsis Vig.)多年生草本植物,青藏高原特有种[1],是藏族传统用药“欧贝完保”的原植物之一。主要集中分布于青藏高原地区,多生长于海拔3200~3800 m 的高山草甸和阴坡灌丛,所含活性成分以生物碱类、黄酮类化合物等为主[2]。全草镇静熄风,定喘,清热解毒,具有重要的药用价值[3]。
中药红外光谱宏观指纹分析法是中药学与分析化学相结合的产物,是一种基于中药红外光谱宏观指纹特征的综合分析方法[4],对以多组分整体用药的中医和藏医理论来说,单个或多个目标成分的检测和控制不能全面的反映原药材的质量,红外光谱的变化反映药材这一混合物体系化学成分上的变化和差别,可以作为评价药材质量的一项关键指标,因此具有快速、高效、宏观整体特征性强等特点的红外光谱在质量控制方面逐渐显示出其优势[5,6]。本文采用傅立叶变换红外光谱(FT-IR)法对五脉绿绒蒿不同部位进行了分析鉴别,为五脉绿绒蒿药材资源的综合开发利用提供基础研究资料。
1 材料与方法
1.1 材料与仪器
五脉绿绒蒿样品于2014 年7 月(花果期)采自青海省祁连县冰沟大阪。采集30 株样品,带回实验室后,将五脉绿绒蒿阴干,其中20 株按花、叶、花梗分开,剩下10 株做全草,各部位研磨后过200 目筛,待分析用。原植物标本由中国科学院西北高原生物研究所卢学峰副研究员鉴定为五脉绿绒蒿(Meconopsis quintuplinervia Regel.)。
红外光谱仪为Thermo Nicolet 公司IS50 傅立叶变换红外光谱分析仪,DTGS 检测器,十万分之一电子分析天平(梅特勒-托利多仪器有限公司),玛瑙研钵。
1.2 实验方法
1.2.1 谱图采集方法
采用KBr 压片法,样品与KBr 比例为1∶50,混合均匀后在玛瑙研钵中研磨,放入压片机压成透明或半透明的薄片,然后将样品片放入样品架内进行测试。采用DTGS 检测器,扫描范围4000~400 cm-1,分辨率为4 cm-1,扫描次数为32 次,每份样品扫描5 次,扫描时即时去除水和CO2的干扰,取其平均谱图,将不同部位的平均谱图作为各部位的红外光谱标准谱图。
1.2.2 数据处理
OMNIC 7.0 软件完成样本红外光谱数据采集以及光谱数据预处理,方法是首先对采集到的光谱数据进行基线校正,消除采集过程中的基线漂移,然后对数据进行纵坐标归一化。
2 结果与分析
2.1 方法学考察
2.1.1 分辨率选择试验
将制好的同一样品压片,分别在分辨率为1、2、4、8、16 cm-1的条件下平行测定,结果如图1 中谱线1 至谱线5 所示。结果表明,分辨率为4、8、16 cm-1的条件下均能满足样品分析要求,同时分辨率低可能使某些重叠谱带分不开[7],最终实验选定分辨率为4 cm-1进行测定。
图1 不同分辨率下五脉绿绒蒿红外光谱图(n=5)Fig.1 IR spectra of M.quintuplinervia with different resolutions (n=5)
2.1.2 扫描次数
将制好的同一样品压片,在分辨率为4 cm-1的条件下,分别扫描4 次、8 次、16 次、32 次、64 次,平行测定,结果如图2 中谱线1 至谱线5 所示。结果表明,扫描次数为8 次、16 次、32 次、64 次均满足样品测定条件,基于扫描次数越多,光谱信噪比越高[7]以及节省时间的目的,最终实验选择扫描32 次进行检测。
图2 不同扫描次数下五脉绿绒蒿红外光谱图(n=5)Fig.2 IR spectra of M.quintuplinervia with different scanning times (n=5)
2.1.3 精密度试验
取五脉绿绒蒿样品1 份,按“1.2”项下方法连续测定5 次,得到的红外光图谱基本一致。用OMNIC7.0 软件计算相似度,测得的红外图谱与其所得平均谱图的相似度分别为0.9995、1.000、1.000、1.000、0.9996,RSD 值为0.017%。结果表明仪器精密度良好,满足样品分析要求。
2.1.4 重复性试验
同一份样品,按“1.2”项下方法重复压片5 次,分别进行扫描测定。用OMNIC7.0 软件计算相似度,测得的红外图谱与其平均谱图的相似度分别为0.9837、0.9849、0.9942、0.9900、0.9846,RSD 值为0.455%。表明该实验方法具有良好的重复性。
2.1.5 稳定性试验
取同一份五脉绿绒蒿样品片放入干燥器内保存,每隔1 d 测定1 次,结果显示5 d 内所得红外图谱具有较好的一致性,测得的红外图谱与其平均谱图的相似度分别为:0.9993、0.9817、0.9989、0.9973、0.9988,RSD 值为0.762%。结果表明样品稳定性良好,满足样品分析要求。
2.2 五脉绿绒蒿不同部位的一维红外光谱分析
根据文献对主要红外吸收谱带进行指认和归属,结果如表1 所示。在3372 cm-1附近为O-H 键伸缩振动谱带;2923 cm-1附近为亚甲基的C-H 键反对称伸缩振动谱带;1742 cm-1附近为酯类羰基C=O键的伸缩振动谱带[8];1653 cm-1附近为O-H 键弯曲振动、黄酮类或蛋白质类共轭羰基的伸缩振动或蛋白质酰胺Ⅰ带吸收谱带[9];1516 cm-1为苯环骨架伸缩振动吸收谱带[10];1470~1400 cm-1附近可能含有黄酮及生物碱类等多种成分的芳香环的骨架振动、C-H 弯曲振动吸收谱带[11];1373 cm-1是酯类C-H 弯曲振动吸收谱带[5];1245 cm-1为糖类C-O 伸缩振动谱带[5,10];1162、1106、1058 cm-1附近为糖苷类C-O键的伸缩振动谱带[12]。在1162~1058 cm-1附近花梗的吸收强度明显强于其他部位,推测花梗中所含糖类成分较多,这可能是由于花梗中还有较高的纤维素所致。

表1 五脉绿绒蒿主要红外吸收谱带归属Table 1 The assignments of main IR absorption peaks of M.quintuplinervia
以五脉绿绒蒿全草的红外谱图为参照,利用OMNIC 7.0 软件的质量检查功能计算花梗、叶、花与全草的相似系数分别为0.8942、0.9757、0.9549,结果显示以全草和叶的相似系数最高,花次之,与花梗差别最大,但整体上一维红外光谱不同部位之间相似性较高。
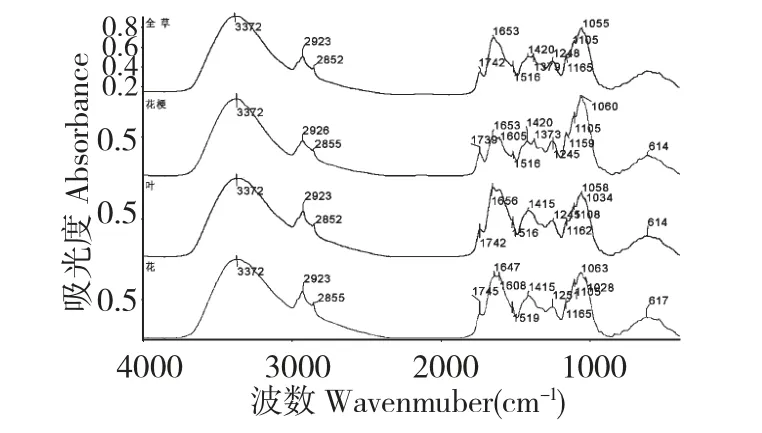
图3 五脉绿绒蒿不同部位的一维红外光谱图Fig.3 FT-IR spectra of different parts of M.quintuplinervia
图3 给出了五脉绿绒蒿不同部位一维红外光谱图。因3372 cm-1和1653 cm-1谱带受KBr 压片时引入的空气水分及样品的干燥程度的影响,除这两个谱带外,1058 cm-1吸收谱带强度在一维红外图谱所有吸收谱带中谱带强度最高,因此以1058 cm-1处谱带强度为基准,分别对2923、1738、1420 cm-1等主要特征谱带的吸收谱带强度进行初值化处理,所得结果作为该部位红外光谱主要特征谱带的相对强度(见表2),并对此相对强度进行分析比较。差0.71 倍,表明花部分苯环骨架振动较强,花梗部分振动较弱。可见不同部位一维红外光谱图在相同谱带呈现出明显差异,利用一维红外光谱能比较快速地对五脉绿绒蒿不同部位进行识别。

表2 不同部位主要特征谱带的相对强度Table 2 Relative intensity of the characteristic peaks of different parts of M.quintuplinervia
2.3 五脉绿绒蒿不同部位的二阶导数红外光谱分析
二阶导数红外光谱可以增强光谱的表观分辨率,分辨原谱中重叠的吸收谱带或使一些特征谱带间的差异更明显,进而找出特定化合物的特征吸收谱带并提高图谱的指纹特征性[13,14]。因此,对五脉绿绒蒿全草、花梗、叶和花在1800~800 cm-1范围内红外谱图进行了二阶导数处理(图4),花梗、叶、花与全草的相似系数分别为0.7853、0.9296、0.7853,表明不同部位间红外谱图大致相似,但不同部位间二阶导数差异明显比一维谱图显著。
一维红外图谱中差异不显著的各波段,经二阶导数处理后许多被掩盖的吸收谱带强度差异显现出来。从图4 可知,不同部位五脉绿绒蒿药材在1517~1471 cm-1波段和1162~1107cm-1波段呈现出多样的谱带形状和不同的吸收强度,明显表现出较大的差异。其中在1517~1471 cm-1波段,花中1517 cm-1谱带强度高于1471 cm-1,全草中1517 cm-1附近吸收谱带强度与1471 cm-1的谱带强度基本一致,花梗和叶中1517 cm-1谱带强度低于1471 cm-1;而在1162~1107 cm-1波段,花梗和叶中1162 cm-1谱带强度高于1107 cm-1,全草中1162 cm-1附近吸收谱带强度与1107 cm-1的谱带强度基本一致,而花中1165 cm-1谱带强度低于1107 cm-1。因此,可将1517~1471 cm-1和1162~1107 cm-1这两个波段作为五脉绿绒蒿不同部位二阶导数之间差异特征。
综上,与一维红外谱图相比,在1800~800 cm-1范围内五脉绿绒蒿不同部位间的二阶导数谱图谱差异显著。二阶导数谱图的1517~1471cm-1和1162~1107cm-1波段可作为区分不同部位的重要特征。

图4 五脉绿绒蒿不同部位的二阶导数红外光谱图Fig.4 Second derivative infrared spectra of different parts of M.quintuplinervia
3 结论
采用傅立叶红外光谱法对五脉绿绒蒿的全草、花梗、叶和花的一维红外光谱和二阶导数谱进行了识别分析。在一维红外光谱谱4000~400 cm-1范围内,对主要吸收谱带进行了基团的归属分析,其中1162、1106、1058 cm-1附近为糖苷类C-O 键的伸缩振动谱带,花梗的吸收强度明显强于其他部位,推测花梗中所含糖类成分较多,这可能是由于花梗中还有较高的纤维素所致;不同部位间红外谱图相似性高,同时主要特征谱带的相对强度的比值可以作为五脉绿绒蒿一维红外光谱差异特征。二阶导数红外光谱谱图花梗、叶、花与全草的相似系数分别为0.7853、0.9296、0.7853,较之一维红外谱图差异显著,同时1517~1471 cm-1和1162~1107 cm-1波段是区分不同部位的重要特征。
结果表明,五脉绿绒蒿一维红外光谱和二阶导数谱图能将不同部位的五脉绿绒蒿识别。因此,通过分析比较五脉绿绒蒿不同部位的红外谱图,可以宏观整体地把握五脉绿绒蒿不同部位的成分差异,为现代监控手段分析传统藏药的思路提供依据。
1 Yang YC (杨永昌).Handbook of Tibetan Medicine (藏药志).Qinghai:Qinghai People's Publishing House,1991.465
2 Liu SW(刘尚武).Flora Qinghai(青海植物志).Qinghai:Qinghai People's Publishing House,1997.388.
3 Lu XF(卢学峰).The Wild Medicinal Plants in Qinghai(青海野生药用植物).Qinghai:Qinghai Ethnic Publishing House,2012.182.
4 Sun SQ(孙素琴).Analysis of Traditional Chinese Medicine by Infrared Spectroscopy.Beijing:Chemical Industry Press,2010.33.
5 Yang HX(杨红霞),Ma F(马芳),Du YZ(杜玉枝),et al.Study on the Tibetan medicine Swertia mussotii Franch and its extracts by fourier transform infrared spectroscopy.Spectrosc Spect Anal (光谱学与光谱分析),2014,34:2973-2977.
6 Wu YW(武彦文),Xiao XH(肖小河),Sun SQ(孙素琴),et al.Study on traditional Chinese medicine extracts of Rhizoma Coptidis by FTIR.Spectrosc Spect Anal (光谱学与光谱分析),2009,29:93-96.
7 Weng SF(翁诗甫).Fourier Translation Infrared Spectroscopy.Beijing:Chemical Industry Press,2010.73-74.
8 Huang DL(黄冬兰),Chen XK(陈小康),Xu YQ(徐永群),et al.Analysis of different parts of Rabdosia serra(Maxim.)Hara by FT-IR.Chin Tradit Pat Med (中成药),2013,35:113-117.
9 Ma F(马芳),Zhang F(张方),Tang J(汤进),et al.Analysis and identification of Poria cocos peels harvested from different producing areas by FTIR and 2D-IR correlation spec-troscopy.Spectrosc Spect Anal (光谱学与光谱分析),2014,34:376-380.
10 Liu F(刘飞),Wang YZ(王元忠),Yang CY(杨春艳),et al.Identification of Dendrobium varieties by infrared spectroscopy.Spectrosc Spect Anal (光谱学与光谱分析),2014,34:2968-2972.
11 Du J(杜娟),Peng XY(彭惜媛),Ma F(马芳),et al.Analysis and identification of Semen Glycines Nigrae and Semen Pharbitidis by infrared spectroscopy.Spectrosc Spect Anal(光谱学与光谱分析),2014,34:2429-2433.
12 Li JR(李建蕊),Chen JB(陈建波),Zhou Q(周群),et al.Analysis of different parts and tissues of Panax notoginseng by fourier transform infrared spectroscopy.Spectrosc Spect Anal (光谱学与光谱分析),2014,34:634-637.
13 Hu Y(胡燕),Qi GN(齐桂年).Study on the FTIR fingerprinting of Dark Teas from different regions in china.Acta Agric Nucl Sin (核农学报),2014,28:684-691.
14 Wu XD(武晓丹),Jin ZX(金哲雄),Sun SQ(孙素琴).Discrimination of seven species of Agrimonia pilosa Ledeb and its extracts by FTIR and 2D-IR.Spectrosc Spect Anal (光谱学与光谱分析),2010,30:3222-3227.

