油樟油对油樟内生真菌中活性化合物影响
谭韵雅,卢 红,李 群*,魏 琴
1四川师范大学生命科学学院,成都 610101;2 宜宾学院发酵资源与应用四川省高校重点实验室,宜宾 644000
植物内生菌是与其宿主在长期的协同进化过程中形成了互利互惠、无害或微害的寄生关系的菌群。目前研究植物内生菌的生物学作用已逐渐成为热点,对于内生菌发酵生产代谢产物的报道较多[1,2]。但直接从植物中分离得到的内生菌发酵产物普遍含量较低,不利于直接用于工业生产,需要对其进行优化[3,4]。优化内生菌的方式非常多,其中添加前体物质等诱导物来促进其产物的生产是一种常用且有效的方法[5,6]。
1,8-桉叶油素、松油烯-4-醇、a-松油醇、r-松油烯均是重要的天然产物,存在于多种植物精油之中,在医药、香料和日用化学品等方面均有重要的用途,有较高的经济价值[7,8]。目前多是直接从植物中提取来获得这些物质,但存在产量少,受季节限制等局限性。因此本研究试图在产生这些天然产物的内生菌中添加诱导物,探索不同培养条件下这些天然产物的产量,旨在提高天然产物的产量。
本研究使用的内生菌是游玲等[9,10]2009 年从油樟中分离得到的,且经过分析发现这些内生菌能生产1,8-桉叶油素等物质。但其产量低,相对含量在8.5 %至16.7%之间,需优化提高其产量。本研究使用的油樟油是一种天然的芳香油,用它作原料,可以得到许多重要的香料、香料参合剂或其它的化工产品[11]。本研究参照陶翠等[12]2011 年对油樟叶挥发油对几种真菌的抗菌效果的报道,再加上前期的预实验,以4%油樟油水浊液作为诱导剂添加在可产1,8-桉叶油素等物质的几种内生菌中,探索油樟油对内生菌产物的影响,旨在能提高1,8-桉叶油素等天然产物的产量,为这些产物能否工业化生产提供依据。目前这方面的研究未见相关报道。
1 材料与仪器
1.1 材料
油樟内生真菌YY26、YG42 和YG71 由宜宾学院发酵资源与应用四川省高校重点实验室从宜宾市采集的油樟中分离获得。
1.2 培养基
马铃薯葡萄糖培养基(PDA):去皮马铃薯200 g煮沸30 min 过滤,葡萄糖20 g,琼脂20 g,加水定容至1000 mL,pH 自然。马铃薯葡萄糖液体培养基(PDB):去皮马铃薯200 g 煮沸30 min 过滤,葡萄糖20 g,加水定容至1000 mL,pH 自然。察氏培养基:蔗糖30 g,硝酸钠3 g,硫酸镁0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,磷酸氢二钾1 g,琼脂12 g,水1000 mL,pH 自然。
1.3 主要试剂
1,8-桉叶油素、松油烯-4-醇、a-松油醇和r-松油烯四种标品均由宜宾市旧州志林商贸有限责任公司江南香料化工厂提供。乙醇为色谱纯级别。
1.4 仪器
气相色谱仪[Agilent7890A、火焰离子化检测器(FID)],气-质联用仪(Agilent 7890A/ 5975C),超净工作台(SW-CJ-ZF),恒温培养摇床(THZ-300),恒温培养箱(BPH-9082)。
2 实验方法
2.1 油樟内生真菌的培养
从保藏的试管斜面挑取适量YY26、YG42 和YG71 菌种,分别接种于PDA 平板上活化,在长出的菌落边缘取直径6 mm 的菌丝块3 块,转入装有50 mL 培养液的摇瓶中,28 ℃,180 rpm 摇床培养8 d。
2.2 油樟油水浊液的制备
2.2.1 油樟叶挥发油的制备
新鲜油樟叶洗净后剪碎至适当粒度放入1 L 的圆底烧瓶中,用水蒸气蒸馏法提取4 h,然后乙醚萃取、旋转浓缩后用无水硫酸钠干燥,得油樟叶挥发油。
2.2.2 混合乳化剂的制备
吐温-80 和斯盘-80 按照7∶3 的比例混合,混合后于60 ℃水浴,然后充分搅拌后。此混合乳化剂的HLB(亲水亲油平衡值)值为12.0(水包油乳化剂)。
2.2.3 油樟油水浊液的制备
先将油樟叶挥发油和乳化剂(HLB 值为12.0)按照1∶5 的比例混合,加入研钵中,顺着一个方向充分研磨1 min 左右,再加入溶剂水继续研磨,过滤灭菌后放入4 ℃冰箱保存备用。
2.3 实验方案
在PDB 培养基和察氏培养基中加入4%油樟油水浊液,再分别接入真菌YY26、YG42、YG71,同时设置相应对照。每组实验设三个重复,如表1。在28 ℃,180 rpm 摇床中培养8 d 后,将培样瓶中的物质均匀混合后取10 mL 放入顶空进样瓶中,进行GC-FID 检测。采用外标法定量。取其中产物较多的一组样品进一步做GC-MS 检测,以此来确认产物。
2.4 标品的配制
分别称取0.5 g 1,8-桉叶油素、a-松油醇、松油烯-4-醇、r-松油烯标品于50 mL 容量瓶中用乙醇定容,制成10 g/L 的标准溶液。
取配好的10 g/L 的1,8-桉叶油素标准溶液,稀释成浓度分别为50、20、5、1、0.5、0.1 mg/L 的标准溶液,用以建立1,8-桉叶油素的标准曲线。
取配好的10 g/L 的r-松油烯标准溶液,稀释成浓度分别为1、0.5、0.2、0.1、0.05、0.01 mg/L 的标准溶液,用以建立r-松油烯的标准曲线。
分别取配好的10 g/L 的a-松油醇和松油烯-4-醇标准溶液,分别稀释成浓度为10、5、1、0.5、0.05、0.01 mg/L 的标准溶液,用以建立a-松油烯和松油烯-4-醇的标准曲线。
2.5 GC-FID 检测
色谱条件:HP-5(30 m ×250 μm ×0.25 μm)毛细管柱,平衡温度90 ℃,平衡时间10 min。载气为氮气,氢气流速40 mL/min,空气流速400 mL/min,氮气尾吹气25 mL/min,顶空不分流进样。柱箱程序:90 ℃保持4 min,然后5 ℃/min 到130 ℃保持5 min,然后5 ℃/min 到190 ℃保持3 min。
2.6 GC-MS 检测
2.6.1 色谱条件
HP-5(30 m × 250 μm × 0.25 μm)毛细管柱;进样口温度230 ℃;载气为He 流量1 mL/min;分流比3∶1,分流流量3 mL/min。色谱柱程序升温条件:初始温度90 ℃保持4 min 然后5 ℃/min 到130 ℃保持5 min 然后5 ℃/min 到190 ℃保持3 min。
2.6.2 质谱条件
离子源为EI 源,电子能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;质谱接口温度280 ℃;质量扫描范围为m/z 35~400。
2.7 精密度和稳定性试验
取2.4 中配制好的10 g/L 标准溶液,用乙醇为溶剂配制成10 mg/L 的混标,取10 mL 于顶空进样瓶中,按2.5 方法重复进样5 次,计算1,8-桉叶油素、a-松油醇、松油烯-4-醇、r-松油烯标准溶液的峰面积RSD(%);取同一供试品在同一天内重复进样5 次,并连续进样3 天,计算1,8-桉叶油素、a-松油醇、松油烯-4-醇、r-松油烯的峰面积日内与日间RSD(%)。
2.8 回收率试验
取2.4 中配制好的10 g/L 标准溶液,用乙醇为溶剂配制成10、5、1 mg/L 的混标,分别取5 mL 于顶空进样瓶中,再分别加入5 mL 已测样品,依2.5 中方法测定,计算出回收率及RSD(%)。
2.9 统计分析
本实验所有数据均使用SPSS17.0 软件进行方差分析。

图1 标品(A)和样品(B)的GC-FID 分析色谱图Fig.1 GC-FID TICs of standard (A)and sampl (B)
3 结果与讨论
3.1 标准曲线的建立及样品中物质的确认
3.1.1 标准曲线的建立
在2.5 色谱条件下,各个标品以2.4 中所配制的浓度梯度进样,以进样浓度和峰面积进行回归分析,求得1,8-桉叶油素的回归方程为Y=0.016X +0.0301,R2=0.9995;r-松油烯的回归方程为Y=0.0127X+0.0016,R2=0.9992;松油烯-4-醇的回归方程为Y=0.0346X +0.0286,R2=0.9996;a-松油醇的回归方程为Y=0.0552X-0.0221,R2=0.9999。
3.1.2 样品中物质的确认
几种标品的GC-FID 检测结果如图1A 所示。由图1A 可知,标品1,8-桉叶油素的出峰时间为5.134 min;r-松油烯的出峰时间为5.543 min;松油烯-4-醇的出峰时间为7.162 min;a-松油醇的出峰时间为7.383 min。图1B 为样品GC-FID 检测的其中一个结果图。比较图1A 与图1B 发现样品在相近的时间出现与标品相应的峰,初步判断样品中有1,8-桉叶油素、松油烯-4-醇和a-松油醇。而r-松油烯未见出峰,可能没有这个产物或该产物产量过低未被检测出来。
样品的GC-MS 检测结果显示,样品中1,8-桉叶油素、松油烯-4-醇、a-松油醇的质谱图与标准质谱图相对比,匹配度分别达到98%、89%、90%,证明样品中相应峰所对应物质确实与标品为同一物质。
3.2 精密度和稳定性试验结果
精密度试验中1,8-桉叶油素、a-松油醇、松油烯-4-醇、r-松油烯标准溶液的峰面积RSD(%)分别为2.69、1.23、1.42、1.96,表明进样过程中进样量基本一致;稳定性试验中1,8-桉叶油素、a-松油醇、松油烯-4-醇、r-松油烯的峰面积日内RSD(%)分别为1.99、2.12、2.11、1.59,日间RSD(%)分别为3.44、2.89、4.12、3.16,表明供试品溶液在所测时间内基本稳定。
3.3 回收率试验结果
2.8试验中1,8-桉叶油素、a-松油醇、松油烯-4-醇、r-松油烯的平均回收率(n=3)分别为101.22%,100.34 %,98.97 %,103.01 %;RSD(%)分别为2.89,1.71,1.99,2.62。
3.4 GC-FID 检测结果
通过GC-FID 检测,明确了各标本吸收峰的出峰时间。通过标品与样品GC-MS 质谱检测,确定样品中相同出峰时间的物质与相应的标品为同一物质。在此基础上对所有实验处理进行了GC-FID 检测,结果如表1 所示。
3.4.1 未加油樟油时内生菌中天然产物含量情况
从表1 可知,在未加油樟油的处理中(即3、4、5、9、10、11 处理),三种菌均能生成1,8-桉叶油素、松油烯-4-醇、a-松油醇,不能生成r-松油烯。其中不同菌株在不同培养基中均表现为1,8-桉叶油素的产量最高,最高产量可达0.18 mg/L(9、10 处理);其次为松油烯-4-醇,其最高产量为0.08 mg/L(4 处理);a-松油醇的产量最低,其最高产量仅为0.05 mg/L(4 处理)。
未加油樟油的处理组之间的对比发现(即3、4、5 之间相互比较;9、10、11 之间相互比较):在PDB培养基中,1,8-桉叶油素产量最高的是YG71 菌株,产量可达0.16 mg/L,其次是YY26 菌株,YG42 菌株的产量最低;对松油烯-4-醇和a-松油醇的产量来说,最高的均是YG42 菌株,产量分别可达0.08 mg/L 和0.05 mg/L;YY26 菌株的产量次之,YG71 菌株的产量最低。在察氏培养基中,YG42 和YY26 菌株的1,8-桉叶油素产量较高,产量均为0.18 mg/L,YG71 菌株的产量较低;YG42 和YG71 菌株中松油烯-4-醇和a-松油醇产量均相同且较高,分别为0.07 mg/L 和0.02 mg/L,YY26 菌株的产量较低。
由此可见,对未加油樟油的PDB 培养基和察氏培养基中内生菌产物进行对比分析得出:除YG42菌株中松油烯-4-醇和a-松油醇产量PDB 培养基比察氏培养基中的产量高外,其余均是察氏培养基中的产量更高,即察氏培养基的产物总量高于PDB 培养基中的产物总量。
3.4.2 加油樟油后内生菌中天然产物含量情况
由表1 可知,在PDB 培养基中,加入油樟油后,YY26 和YG42 菌株中1,8-桉叶油素、松油烯-4-醇、a-松油醇的产量均增加,表明油樟油对YY26 和YG42 菌株中的三种目标产物均有促进的作用。其中对1,8-桉叶油素的促进作用最强,在YY26 菌株中产量提高了1.41 倍,YG42 菌种中产量提高了1.30 倍,与仅加油樟油的处理相比(1 处理)有极显著的差异;其次对松油烯-4-醇和a-松油醇也有促进作用,只是提高倍数较小,最高仅有0.38 倍。与仅加油樟油的处理相比,仍达到了显著水平以上(见表2);而在YG71 菌株中,加入油樟油后,1,8-桉叶油素、松油烯-4-醇、a-松油醇的产量均被抑制,与仅加油樟油的处理相比,分别减少0.27、0.31、0.34倍,均达到显著水平以上(见表2)。
察氏培养基中,加入油樟油后,YY26 菌株中1,8-桉叶油素的产量减少,减少了0.19 倍,与仅加油樟油的处理相比有显著性差异;松油烯-4-醇和a-松油醇的产量均增加,但与仅加油樟油的处理相比没有显著性差异;YG42 菌株中1,8-桉叶油素、松油烯-4-醇的产量均增加,a-松油醇的产量减少,与仅加油樟油的处理相比均无显著性差异;YG71 菌株中1,8-桉叶油素、松油烯-4-醇、a-松油醇的产量均减少,与仅加油樟油的处理相比1,8-桉叶油素的产量有及显著性差异,松油烯-4-醇的产量有显著性差异,a-松油醇的产量则无显著性差异,分别减少0.45 倍、0.18 倍0.03 倍。
由此可见,对加了油樟油的PDB 培养基和察氏培养基中内生菌产物进行对比分析得出:除YG71 菌株中松油烯-4-醇和a-松油醇的产量察氏培养基比PDB 培养基高外,其余均是PDB 培养基中的产量更高,即PDB培养基中的产物总量比察氏培养基的产物总量高。这与未加油樟油的处理组结果完全不同。
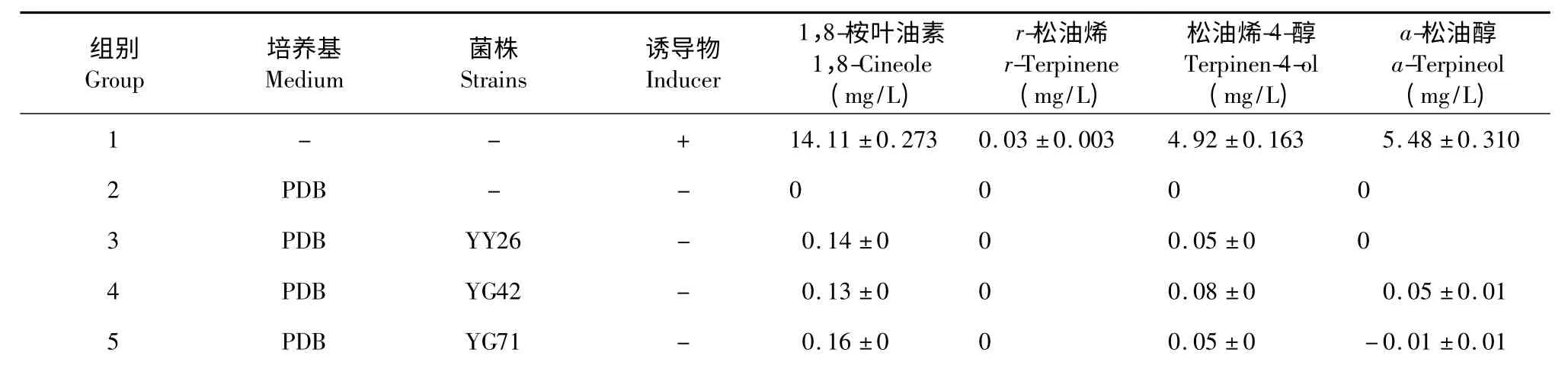
表1 内生真菌代谢产物GC 检测结果Table 1 GC detection result for the endophytic fungi metabolites

注:“-”表示不添加:“+”表示添加;与1 处理相比,a0.001<P<0.05;aaP<0.001。Note:″-″ means not added;″+″ means added;compared with 1 treatment,a0.001<P<0.05;aaP<0.001.

表2 油樟油对内生真菌中1,8-桉叶油素等产物的提升倍数Table 2 The multiple of the 4 investigated compounds promoted by C.longepaniculatum oil in endophytic fungi
4 讨论
在本研究中,采用了GC-MS 和GC-FID 两种检测方式,是因为本实验所用GC-MS 的最低检测线较高。而本实验中部分样品的物质含量较低,用GCMS 无法检测,因此采用GC-FID 检测。同时再选择几组含量较高的样品来做GC-MS 检测,以此定性。得到的实验结果如正文所描述。
众所周知,培养基与诱导物均是影响微生物代谢产物的重要因素。近几年有大量关于优化培养基来提高微生物代谢产物的报道[13,14],也有许多通过添加诱导物来促进代谢产物产量提高的报道[15,16]。本实验中未加油樟油的PDB 培养基与察氏培养基相比,察氏培养基的1,8-桉叶油素等物质积累更多;而加了油樟油的PDB 培养基与察氏培养基相比,PDB 培养基的1,8-桉叶油素等物质积累更多。可以推断培养基和诱导物对内生菌产物产量均有影响,且它们之间存在交互影响。
在PDB 培养基中,加入油樟油和不加油樟油的实验结果表明,油樟油可促进YY26、YG42 菌株中积累1,8-桉叶油素,并且积累量分别提高1.41 倍和1.30 倍。有人做过类似的研究,得到类似的结果,如吴欣证明滑桃树种子提取物能提高其内生菌Streptomyces sp.WXC 菌株中富伦菌素B 的产量[6],同时证实是因为滑桃树种子提取物作为诱导物诱导了活性化合物富伦菌素B 生物合成基因的表达。本实验中油樟油作为诱导物,在YY26 和YG42 菌株中促进1,8-桉叶油素产量的提高,是否也是诱导了1,8-桉叶油素生物合成基因的表达,还有待进一步探讨。另外,对YG71 菌株来说,在PDB 培养基和察氏培养基中1,8-桉叶油素均被抑制,推测可能是YG71 利用油樟油中的1,8-桉叶油素将其转化为了其它物质或者其它原因。Rodríguez P[17]等曾做过关于微生物对1,8-桉叶油素的生物转化,结果证实1,8-桉叶油素被转化为2-氧-1,8-桉叶油素等物质。
本实验初步证明通过添加诱导物或培养基的优化等手段可增加油樟内生菌中1,8-桉叶油素等物质的积累,之后的工作就可从这方面继续做进一步的研究。该研究为这些天然产物的工业化生产奠定了基础。
1 Wei YM,Liu L,Zhou XW,et al.Engineering taxol biosynthetic pathway for improving taxol yield in taxol-producing endophytic fungus EFY-21 (Ozonium sp.).African J Biotechnol,2012,11:9094-9101.
2 Yang YX(杨勇勋),Dong XP(董小萍),Yan YM(晏永明),et al.Studies on secondary metabolites produced by endophytic Aspergillus fumigatus from Trifolium repens.Nat Prod Res Dev (天然产物研究与开发),2013,25(001):64-67.
3 Ruiz-Sanchez J,Flores-Bustamante ZR,Dendooven L,et al.A comparative study of Taxol production in liquid and solidstate fermentation with Nigrospora sp.a fungus isolated from Taxus globosa.J Appl Microbial,2010,109:2144-2150.
4 Song Q,Huang Y,Yang H.Optimization of fermentation conditions for antibiotic production by Actinomycetes YJ1 strain against Sclerotinia sclerotiorum.J Agric Sci,2012,4(7):95-102.
5 Chen JH,Liu JJ,Zang GG,et al.Screening of taxol-producing endophytic fungi and regulation of fermentation condtions.J Central South Univ,2004,35:65-69.
6 Wu X(吴欣).Influence of Trewia nudiflora seed extract on the antifungal compound of endophyte.Biotechnol Bull (生物技术通报),2013,10:93-97.
7 Wang YW(王文元),Gu LL(顾丽莉),Wu ZM(吴志民).Research on 1,8-Cineole.Food Drug(食品与药品),2007,9(02A):56-59.
8 Ma JJ(马剑剑),Han MZ(韩孟竹),Wu JY(吴景雨),et al.One step synthesis of α-terpineol from turpentine oil.J Shanghai Instit Technol,Nat Sci(上海应用技术学院学报,自科版),2013,13:97-100.
9 Wang T(王涛),You L(游玲),Huang NY(黄乃耀),et al.Antifungal activities against phytopathogens and diversity ofendophytic fungi isolated from Cinnamomum longepaniculatum.Jiangsu Agric Sci(江苏农业科学),2009,1:98-101.
10 You L(游玲),Wang T(王涛),Li L(李兰),et al.Analyses on volatile organic compound of 78 endophytic fungi isolated from Cinnamomum longepaniculatum.J Northwest A&F Univ,Nat Sci(西北农林科技大学学报,自科版),2009,37:193-198.
11 Lou ZJ(罗中杰),Li WY(李维一),Wei Q(魏琴),et al.The status quo and future of Cinnamomum longepaniculatumin Yibin.J Sichuan Normal Univ,Nat Sci(四川师范大学学报,自科版),2001,24:317-319.
12 Tao C(陶翠),Wei Q(魏琴),Yin ZQ(殷中琼),et al.Antifungal activity of the essential oil from Cinnamomum longepaniculatum leaves against three species of fungi.Chin Veter Sci(中国兽医科学),2011,41:89-93.
13 Zhao L,Fan F,Wang P,et al.Culture medium optimization of a new bacterial extracellular polysaccharide with excellent moisture retention activity.Appl Microbial Biotechnol,2013:1-10.
14 Li S,Xu H,Yu J,et al.Enhancing isomaltulose production by recombinant Escherichia coli producing sucrose isomerase:culture medium optimization containing agricultural wastes and cell immobilization.Bioproc Biosystems Eng,2013:1-11.
15 Bhatia SK,Mehta PK,Bhatia RK,et al.Optimization of arylacetonitrilase production from Alcaligenes sp.MTCC 10675 and its application in mandelic acid synthesis.Appl Microbiol Biotechnol,2014,98(1):83-94.
16 Saini V,Bhattacharya A,Gupta A.Effectiveness of sal deoiled seed cake as an inducer for protease production from Aeromonas sp.S1 for its application in kitchen wastewater treatment.Appl Microbiol Biotechnol,2013,170:1896-1908.
17 Rodríguez P,Sierra W,Rodríguez S,et al.Biotransformation of 1,8-cineole,the main product of Eucalyptus oils.Electronic J Biotechnol,2006,9:233-236.

