松花粉黄色素的超声/微波协同提取工艺及其稳定性研究
李良玉,王欣卉,宋大巍,于 伟,贾鹏禹
1 黑龙江八一农垦大学国家杂粮工程技术研究中心;2 黑龙江八一农垦大学食品学院,大庆 163319
松花粉(Pine pollen)是我国特有马尾松和油松的花粉,药名松花、松黄,为鲜黄色或淡黄色细粉,其味甘平无毒,松花粉含有多种蛋白质、氨基酸、核酸、多糖纤维素、不饱和脂肪酸,还含有多酚类化合物、核酸和植物甾醇等生物活性成分,具有很高的保健价值[1-3],具有收敛止血、燥湿敛疮之功效,主治外伤出血、湿疹、黄水疮、皮肤糜烂、脓水淋漓等[4,5]。松花粉具有抗衰老、降血糖、降血脂、调节免疫等作用[6-11]。目前,对松花粉的研究较多但主要集中在松花粉多糖、蛋白、不饱和脂肪酸等方面,对于天然黄色素的研究还没有报道。超声-微波协同萃取技术是一种新型的高新提取技术,其将超声波和微波有机的结合起来,充分利用超声波的空化和微波的高能作用,将超声波振动能和微波能直接作用于样品,达到良好的提取效果[12]。目前,对超声/微波协同提取的应用报道,主要集中在多糖的提取中,对多酚、黄酮、有机酸等其它成分的提取有一定报道,但在天然色素的提取方面研究较少[13]。本文以东北野生马尾松松花粉为原料,研究超声/微波协同提取松花粉黄色素的工艺,将超声与微波有机的结合,发挥各自在提取中的优势,最大限度地提高提取得率,并对松花粉黄色素的稳定性进行了系统的研究,希望能为进一步开发利用马尾松这一林产资源提供理论依据。
1 材料与仪器
1.1 材料与试剂
东北野生马尾松松花粉市购;甲醇、乙醇、氯仿、乙醚、丙酮、苯、葡萄糖、蔗糖、苯甲酸钠、柠檬酸、碳酸钠、氯化钾、氯化钠、三氯化铝、三氯化铁、氯化锌、氯化铜、氯化钙、亚硫酸钠、30%双氧水、维生素C等皆为分析纯。
1.2 仪器与设备
Pharo300 紫外可见光分光光度计,默克密理博;CW-2000 型超声一微波协同提取仪,上海新拓微波溶样测试技术有限公司;恒温水浴箱,上海森信实验仪器有限公司;MD100-2 型电子分析天平,沈阳华腾电子有限公司;酸度计S220K,梅特勒·托利多公司。
2 实验方法
2.1 松花粉黄色素的提取方法
对松花粉黄色素的提取工艺采用单因素实验得到了优化的提取工艺参数和操作步骤,具体操作过程如下:提取剂为95%乙醇[14],微波功率300 W,提取温度50 ℃,提取时间10 min,料液比1∶15 mL/g,得到松花粉黄色素。
2.2 松花粉黄色素光谱特性的测定
取松花粉黄色素乙醇溶液,紫外-可见分光光度计在波长范围为200~600 nm 内进行扫描,测得最大吸收波长后,在该波长下进行松花粉黄色素吸光值的测定,作为评价松花粉黄色素稳定性的标准[15]。
2.3 超声/微波协同提取松花粉黄色素的工艺优化研究
2.3.1 微波功率对松花粉黄色素提取的影响
称取松花粉10 g 共5 份,提取剂为95%乙醇,提取时间15 min,液料比20∶1 mL/g,以吸光度为指标研究不同微波功率100、200、300、400、500 W 对松花粉黄色素提取效果的影响,重复三次。
2.3.2 液料比对松花粉黄色素提取的影响
称取松花粉10 g 共7 份,提取剂为95%乙醇,微波功率300 W、提取时间15 min,以吸光度为指标研究不同液料比10∶1、15∶1、20∶1、25∶1、30∶1、35∶1、40∶1(mL/g)对松花粉黄色素提取效果的影响,将液料比统一调配至20∶1 mL/g 后测定吸光度,重复三次。
2.3.3 提取时间对松花粉黄色素提取的影响
称取松花粉10 g 共5 份,提取剂为95%乙醇,微波功率300 W,液料比20∶1 mL/g,以吸光度为指标研究不同提取时间5、10、15、20、25 min 对松花粉黄色素提取效果的影响,重复三次。
2.3.4 响应面优化实验方法
在单因素实验基础上,根据二次回归组合实验设计原理,以松花粉吸光度为响应值,设计微波功率、提取时间、液料比三个因素进行响应面分析实验,实验设计见表1。

表1 因素水平编码表Table 1 Factors and levels for response surface analysis
2.4 松花粉黄色的稳定性研究
2.4.1 松花粉黄色素溶解性研究[16]
将松花粉黄色素溶液冷冻干燥,称取0.01 g 的松花粉黄色素粉末7 份分别加入10 mL 的蒸馏水、甲醇、乙醚、无水乙醇、丙酮、氯仿、苯,搅拌均匀,加盖,室温下避光浸取3 h,观察溶解情况,考察松花粉黄色素的溶解性。
2.4.2 温度对松花粉黄色素稳定性的影响[17]
取松花粉黄色素提取液50 mL 共5 份分别置于5 支具塞试管中,加塞后分别置于20、40、60、80、100℃的恒温水浴锅中加热3 h,取出后冷却至室温,每30 min 测定吸光度一次,重复3 次。
2.4.3 pH 值对松花粉黄色素稳定性的影响[18]
取松花粉黄色素提取液9 mL 共14 份分别置于14 支具塞试管中,用1 mol/L HCL 与1 mol/L NaOH调pH 值为1~14,用蒸馏水补足至10mL,再取混匀后加塞,黑暗处放置4h 后测其吸光度,重复3 次。
2.4.4 光照对松花粉黄色素稳定性的影响[19]
取松花粉黄色素提取液50 mL 以及松花粉黄色素稀释液50 mL(松花粉黄色素提取液40 mL+10 mL 无水乙醇)各1 份分别置于2 支具塞试管中,加塞置阳光下和紫外灯下照射3 h,每30 min 测吸光度一次,重复3 次。
2.4.5 金属离子对松花粉黄色素稳定性的影响[20]
取松花粉黄色素提取液9 mL 共30 份置于30支具塞试管中,再分别加入0.2、0.4、0.6、0.8、1.0 mL 6 种相同浓度1 mg/mL 的不同金属离子溶液(K+、Mg2+、Fe3+、Ca2+、Cu2+、Al3+),用蒸馏水补足至10 mL,混匀后加塞,黑暗中放置4 h 后测定其吸光度,重复3 次。
2.4.6 食品添加剂对松花粉黄色素稳定性的影响[21]
取松花粉黄色素提取液9 mL 共40 份置于40支具塞试管中,再分别加入0.2、0.4、0.6、0.8、1.0 mL5 种相同浓度0.1%的不同食品添加剂溶液(维生素C、柠檬酸、碳酸钠、苯甲酸钠、亚硫酸钠)和3种相同浓度10%的不同食品添加剂溶液(氯化钠、葡萄糖、蔗糖),用蒸馏水补足至10 mL,混匀后加塞,黑暗中放置4 h,测定其吸光度,重复3 次。
2.5 数据处理
实验重复3 次,并采用Origin 8.0 软件制图,采用SAS8.2 软件进行数据统计分析。
3 结果与分析
3.1 松花粉黄色素光谱特性的测定结果
松花粉黄色素光谱特性的测定结果,见图1。由图1 可知,松花粉黄色素溶液的紫外光谱扫描发现其光谱在362 nm 处有吸收峰,选择可见光范围内最大吸收波长362 nm 作为吸光度测定波长。

图1 松花粉黄色素的紫外-可见光吸收光谱曲线Fig.1 UV-Vis spectrum of pine pollen yellow pigment
3.2 超声/微波协同提取松花粉黄色素的提取工艺研究结果与分析
3.2.1 单因素实验结果
3.2.1.1 微波功率对松花粉黄色素提取的影响
由图2-a 可知随着微波功率的增大,松花粉黄色素的吸光度呈现上升趋势。在100~300 W 时范围内,呈现上升的趋势,在300 W 时,吸光度达到最大值。在300~500 W 范围内,提取率逐步下降。可能的原因是当微波功率在100~300 W 时,微波功率不足乙醇溶剂也达到足够穿透能力。因此,吸光度呈现上升趋势,微波超过300 W 两者达到最适平衡状态,吸光度也达到最大值。当微波功率大于300 W 以后会引起色素结构的变化而使吸光度下降。因此,本实验选择响应面优化微波功率范围为在以300 W 为中心200 W 到400 W 之间。

图2 微波功率(a)、液料比(b)及提取时间(c)对松花粉黄色素提取的影响Fig.2 Effects of microwave power(a),liquid/solid ratio(b)and extraction time(c)on the extraction of pine pollen yellow pigment
3.2.1.2 液料比对松花粉黄色素提取的影响
由图2-b 可以看出,随着提取液料比的不断增大,松花粉黄色素的吸光度值呈现上升的趋势;当液料比达到30∶1 mL/g 后,吸光度趋于平衡。因此,本实验选择响应面优化提取液料比范围为在以25∶1 mL/g 为中心20∶1 mL/g 到30∶1 mL/g 之间。
3.2.1.3 提取时间对松花粉黄色素提取的影响
由图2-c 可知随着提取时间的延长,松花粉黄色素吸光度呈现上升趋势。在5~15 min 时,提取率呈现快速上升的趋势,在提取15 min 左右达到最大,超过20 min 有下降的趋势,这可能是提取时间过长影响了色素的稳定性。因此,本实验选择响应面优化提取时间范围为在以15 min 为中心10 min到20 min 之间。
3.2.2 响应面实验结果与分析
基于单因素实验结果确定的最佳条件,以微波功率(W),液料比(mL/g),提取时间(min),这三个因素为自变量(分别以X1、X2、X3表示),以松花粉黄色素吸光度为响应值设计3 因素共17 个实验点的三元二次回归正交旋转组合实验,保证实验点最少前提下提高优化效率,运用SAS 8.2 软件处理,实验结果见表2。

表2 实验安排表以及结果Table 2 Scheme and results of regression orthogonal rotary design
3.2.2.1 多因素组合优化实验分析
采用SAS 8.2 统计软件对优化实验进行响应面回归分析(RSREG),回归方程以及回归方程各项的方差分析结果见表3,二次回归参数模型数据如表4所示。

表3 回归方程各项的方差分析表Table 3 The ANOVA of regression equations

由表3 可以看出:二次回归模型的F 值为5.57,P 值<0.05,大于在0.05 水平上的F 值,而失拟项的F 值为4.61,小于在0.05 水平上的F 值,说明该模型拟和结果好。一次项、二次项和交互项的F值均大于0.05 水平上的F 值,说明其对提取率有显著的影响。

表4 二次回归模型参数表Table 4 The parameters of quadratic regression
以松花粉黄色素的吸光度为Y 值,得出微波功率(W)、液料比(mL/g)、提取时间(min)的编码值为自变量的三元二次回归方程为:
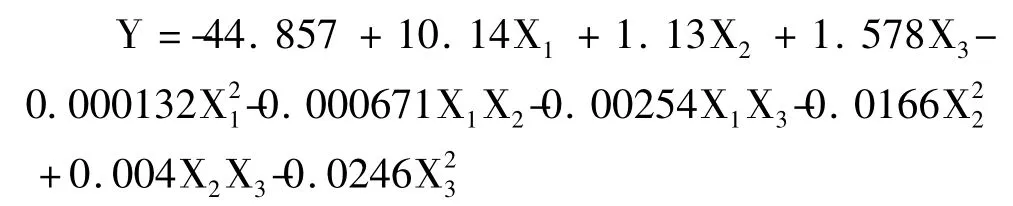
3.2.2.2 最优提取条件确定
为了进一步确证最佳点的值,采用SAS 软件的Rsreg 语句对实验模型进行响应面典型分析,以获得最大提取效果时的条件。经典型性分析得最优提取条件和提取率为:微波功率351.4 W,液料比25.4 mL/g,提取时间11.9 min 时,松花粉黄色素的吸光度值最大,理论最大值为3.491。
3.2.3 验证实验
按照最优提取条件进行实验,重复三次。结果麦松花粉黄色素的吸光度值3.49±0.3,实验值与模型的理论值非常接近,且重复实验相对偏差不超过2%,说明实验条件重现性良好。结果表明,该模型可以较好的反映出超声/微波协同提取松花粉黄色素的条件。
3.3 松花粉黄色素的稳定性研究
3.3.1 松花粉黄色素溶解性能
松花粉黄色素在不同溶剂中的溶解性能实验结果见表5。
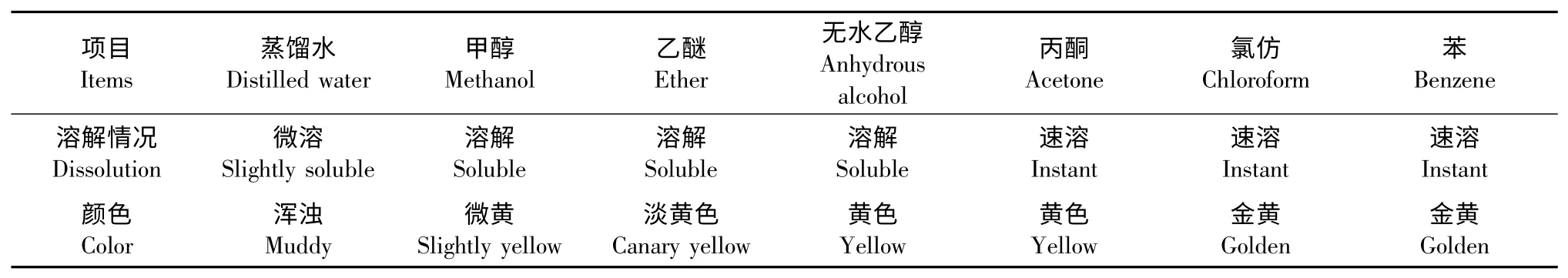
表5 不同溶剂中松花粉黄色素的溶解性能Table 5 The solubility of pine pollen yellow pigment in different solvents
由表5 可以看出,随着溶剂极性的不断减弱松花粉黄色素的溶解性不断提高,可以认为松花粉黄色素为一种脂溶性色素。
3.3.2 温度对松花粉黄色素稳定性的影响
温度对松花粉黄色素稳定性影响的实验结果,见表6。

表6 温度对松花粉黄色素稳定性的影响Table 6 Effects of temperature on pine pollen pigment stability
由表6 可以看出,在20~60 ℃时松花粉黄色素稳定;当温度为80 ℃时,松花粉黄色素的吸光度呈先增加后下降的趋势,在0.5 h 内吸光度增加,这是由于温度升高有利于松花粉黄色素分子的热运动促进色素的溶解,1 h 后吸光度呈下降的趋势,3 h 后趋于平衡,保留率较高,温度低于80 ℃松花粉黄色素稳定性较好;当温度超过80 ℃后,松花粉黄色素稳定性急剧下降保留率低稳定性差,因此该色素应避免在80 ℃以上的环境下使用。
3.3.3 pH 值对松花粉黄色素稳定性的影响
pH 值对松花粉黄色素稳定性影响的实验结果,见表7。

表7 pH 值对松花粉黄色素稳定性的影响Table 7 Effects of pH on pine pollen pigment stability
由表7 可以看出,随着pH 值的提高,松花粉黄色素的吸光度成上升趋势,酸性条件下稳定性较好,碱性环境对其有增色作用。
3.3.4 光照对松花粉黄色素稳定性的影响
光照对松花粉黄色素稳定性影响的实验结果,见表8。
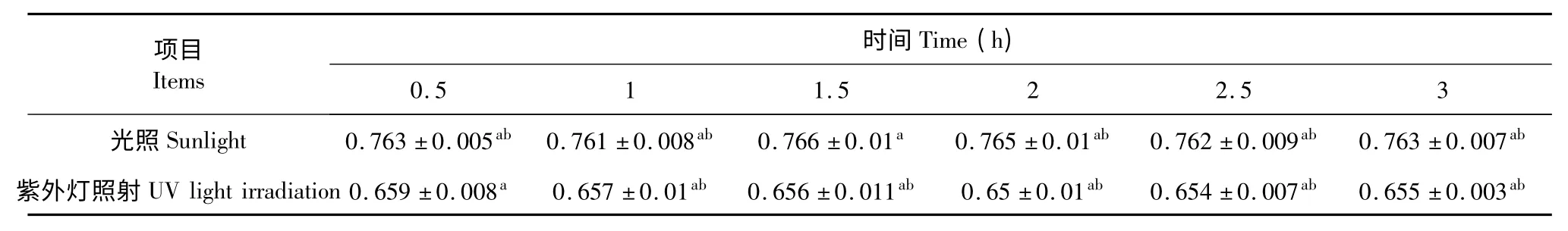
表8 光照对松花粉黄色素稳定性的影响Table 8 Effects of irradiation on pine pollen pigment stability
由表8 可以看出,无论是日光照射还是紫外灯照射对色素的吸光度变化幅度很小,颜色基本没有变化,说明松花粉黄色素的光稳定性良好。
3.3.5 金属离子对松花粉黄色素稳定性的影响
金属离子对松花粉黄色素稳定性影响的实验结果,见表9。
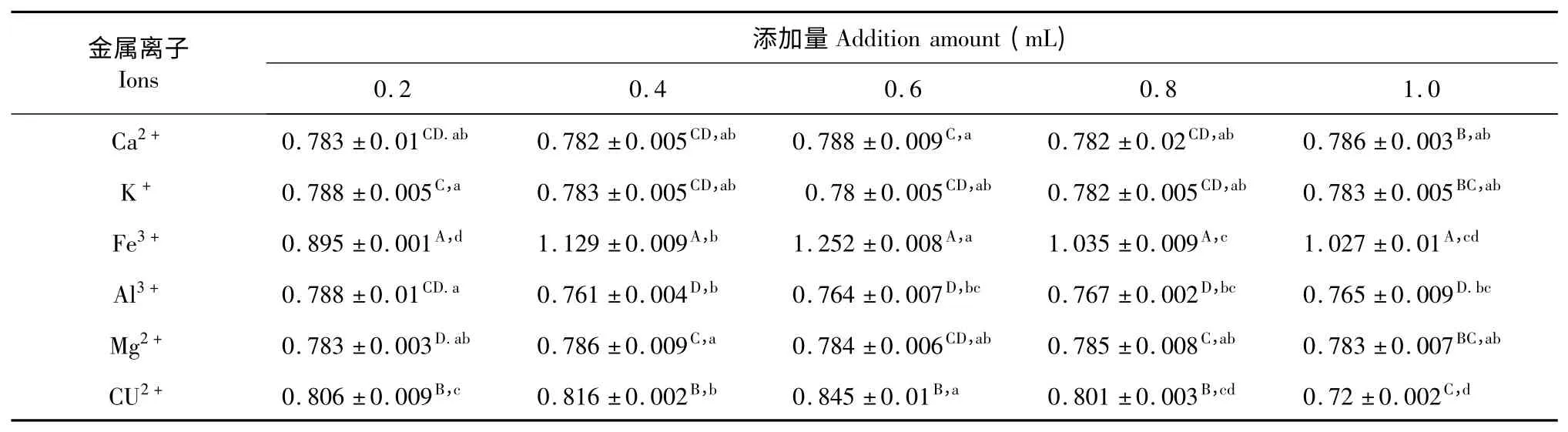
表9 不同金属离子对松花粉黄色素稳定性的影响Table 9 Effects of different metal ions on pine pollen pigment stability
由表9 可以看出,K+、Mg2+、Ca2+、Al3+等四种离子对松花粉黄色素的稳定性影响很小;Cu2+对松花粉黄色素的稳定性有一定的影响,当Cu2+浓度较低时Cu2+自身颜色影响测定导致吸光度升高,浓度较高时Cu2+影响松花粉黄色素的稳定性导致吸光度下降;Fe3+对松花粉黄色素的稳定性影响较大,当Fe3+浓度较低时出现浑浊现象导致吸光度升高,Fe3+浓度较高时松花粉黄色素的稳定性较差导致吸光度下降,但仍高于对照。
3.3.6 食品添加剂对松花粉黄色素稳定性的影响
食品添加剂对松花粉黄色素稳定性影响的实验结果,表10。
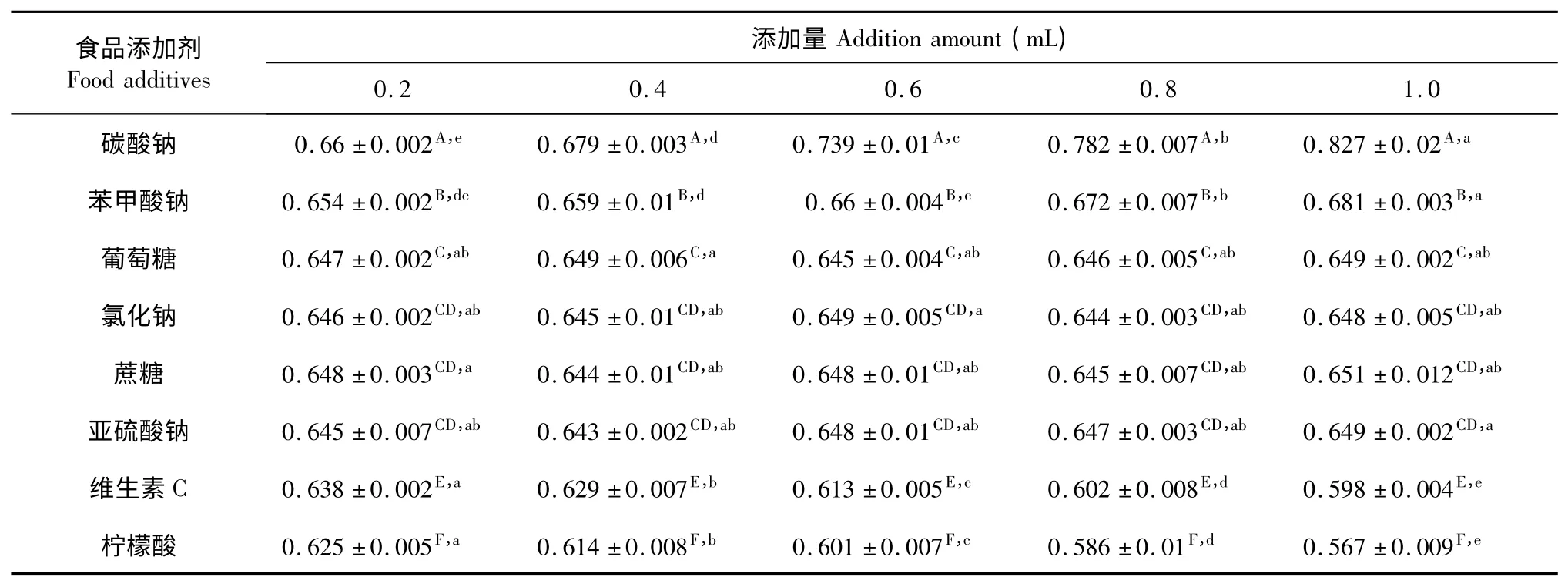
表10 食品添加剂对松花粉黄色素稳定性的影响Table 10 Effects of food additives on pine pollen pigment stability
由表10 可以看出,葡萄糖、氯化钠、蔗糖和亚硫酸钠对色素的吸光度变化幅度很小,颜色基本无变化,说明其对松花粉黄色素的稳定性没有显著的影响;碳酸钠和苯甲酸钠对色素的吸光度变化幅度较大,颜色增深,说明其对松花粉黄色素的稳定性有显著的增色作用;而维生素C 和柠檬酸对色素的吸光度变化幅度较大,颜色减弱,说明其对松花粉黄色素的稳定性有显著的减色作用。
4 结论
通过实验研究可以得到松花粉黄色素超声/微波协同的最佳提取工艺参数为:微波功率351.4 W,液料比25.4 mL/g,提取时间11.9 min,松花粉黄色素的吸光度值最大为3.49;在溶解性方面松花粉黄色素微溶于水,速溶于有机溶剂,属于脂溶性色素,最大吸收波长为362 nm;稳定性方面,在低于80 ℃的条件下,色素的热稳定性较好,应在80 ℃以下生产和存放;该色素对光不敏感,光稳定性良好;松花粉黄色素酸性条件下稳定性较好,碱性环境对其有增色作用;金属离子K+、Mg2+、Ca2+和Al3+对色素稳定性影响小,Cu2+和Fe3+对色素稳定性有一定的影响;食盐、葡萄糖、蔗糖、苯甲酸钠的影响较小,碳酸钠和苯甲酸钠对色素稍有增色作用,维生素C 和柠檬酸稍有减色作用。
1 Hui J(回晶),Lin JS(林家帅),Li TY(李天翼),et al.Study on antioxidant activity of flavonoids from pine pollen in vitro.J Liaoning Univ,Nat Sci(辽宁大学学报,自科版),2014,41:281-285.
2 Kroyer G,Hegedus N.Evaluation of bioactive properties of pollen extracts as functional dietary food supplement.Innov Food Sci Emerging Echol,2001,2:171-174.
3 Liu JE(刘杰尔).Pine pollen and composition analysis of weight control function.Zhejiang:Zhejiang University,MSc.2008.
4 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China,Vol I(中华人民共和国药典).Beijing:China Medical Science Press,2010,191-192.
5 Luo YX(罗砚曦),Cai HF(蔡华芳),Zhong YS(钟宇森).Research progress of medicinal efficacy of pine pollen.China Pharm(中国药房),2009,20:957-958.
6 Yang XP,Guo DY,Zhang JM,et al.Characterization and anti-tumor activity of pollen polysaccharide.Int Immunopharmacol,2007,7:401-408.
7 Eraslan G,Kanbur M,Silici S,et al.Evaluation of protective effect of bee pollen against propoxur toxicity in rat.Ecotoxicol Environ Safety,2009,72:931-937.
8 Cao W,Wei YH.The Principle and Processing Technology of bee Products and Health Care.Beijing:Chemical Industry Press,2002.15.
9 Uzbekova DG,Makarova VG,Khvoynitskaya LG,et al.Evaluation of bee-collected pollen influence on lipid peroxidation,antioxidant system and liver function in old animals.J Hepatol,2003,38:203.
10 Marghitas LA,Stanciu OG,Dezmirean DS,et al.In vitro an-tioxidant capacity of honeybee-collected pollen of selected floral origin harvested from Romania.Food Chem,2009,115:878-883.
11 LeBlanc BW,Davis OK,Boue S,et al.Antioxidant activity of Sonoran desert bee pollen.Food Chem,2009,115:1299-1305.
12 Lin S(林硕).Study on technology and equipment of ultrasonic-microwave synergizing dynamic countercurrent extraction.Hefei:Anhui Agricultural University(安徽农业大学),MSc,2009.
13 Xin XC(辛晓晨).Study on ultrasonic/microwave assisted extraction and analysis of physicochemical of Betel Nut oil.Haikou:Hainan University(海南大学),MSc.2012.
14 Bai M(白明).The separation and purification of flavonoids and research of extraction on Chinese pine pollen.Tianjin:Tianjin University of Science & Technology(天津科技大学),MSc.2009.
15 Yang L(杨玲),Jiang D(江丹),Zhou B(周波),et al.Study of stability of monascus yellow pigment and methods for enhancing its photostabiliy.Modern Food Sci Technol(现代食品科技),2008,24:1124-1127.
16 Wen CF(文赤夫),Xiang XQ(向小奇),Liu X(刘旋),et al.Extraction and stability of yellow pigments from Ginkgo biloba leaves.Food Sci(食品科学),2010,31(8):43-45.
17 Song FY(宋凤艳),Jiang XP(江晓萍).Stability of the pigment of Arachis duranehsis.Modern Food Sci Technol(现代食品科技),2010,26:247-252.
18 Abu L(阿布来提·阿布都热西提).Study on extraction and stability of natural yellow pigment from ligulate flowers of sunflower.Food Sci(食品科学),2009,30(4):96-98.
19 Shi HY(史海英),Lv XL(吕晓玲).Study on the stability of the purple corn pigment.Modern Food Sci Technol(现代食品科技),2007,23:7-10.
20 Li XK(李学坤),Li WH(李稳宏),Han F(韩枫),et al.Basic research on stability of yellow pigment from fenugreek.Trans Chin Soc Agric Eng(农业工程学报),2009,25:246-250.
21 Li CX(李彩霞),Yang XL(杨小龙),Li Q(李琼),et al.Stability of the pigment from“Black Beauty”Potato.Food Sci(食品科学),2010,31(9):89-94.

