胰岛素自身免疫综合征
解放军总医院第一附属医院内分泌科 刘敏 尹士男
尹士男 医学博士,解放军总医院第一附属医院内分泌科主任。现任中华医学会北京分会糖尿病分会专业委员会委员、解放军医学会内分泌专业学会委员、中国医师协会内分泌代谢分会委员、中国老年学委员。《国际糖尿病》、《中国药物临床应用及监测》杂志编委,《解放军医学杂志》特约编委。2009年《中国胰岛素泵临床应用指南》起草人之一。
胰岛素自身免疫综合征(insulin autoimmune syndrome,I A S)又称自身免疫性低血糖(autoimmunehypoglycemia,AIH),是由于血中非外源性胰岛素诱导产生高浓度免疫活性胰岛素(immunoreaetive insulin,IRI)和高效价胰岛素自身抗体(insulin autoantibodies,IAA),从而引起的严重的自发性低血糖症。本病于1970年由日本学者平田(Hirata)等首次报道,故又名Hirata病。该病较为罕见,自首次报道至今,日本、欧美及国内共报道了400例左右。在国内,对该病报道多为个案报道或数例病例总结。IAS的临床特点为自发性低血糖表现,是导致严重低血糖的重要原因之一,常易混淆于其他原因导致的低血糖症,易造成临床上误诊和漏诊。本文就该病的流行病学特点、发病机制、临床特点、治疗以及预后等方面进行简要概括,以期加强临床医生对该病的认识。
流行病学特点及发病机制
1. 流行病学特点
IAS至今全球陆续报道约400例,大多数报道来自日本。在日本除胰岛素瘤和胰外肿瘤外,IAS是引起自发性低血糖的第3位病因。1970~1996年期间,日本报道IAS约226例,同期日本以外的东亚国家报道10例,非亚洲人群报道27例[1]。截至2007年9月,日本报道了380例[2];截至2009年非亚洲人群报道58例[3]。国内1985年首次报道IAS,截至2011年11月累计报道81例[4]。IAS患病率尚不清楚,目前为止规模最大的流行病学研究是1994年Uchigata等[5]进行的有关IAS的回顾性调查。该研究显示日本IAS患者发病年龄80%在40岁以上,发病高峰为60~69岁,无性别差异。我国以及西方非亚裔人群的病例总数较少。2012年一项报道[6]回顾性比较了解放军总医院2001年1~9月收治的9例、北京协和医院总结的1994~2004年国内40例、1970~1992年日本197例以及截至2009年5月报道的非亚洲人群58例IAS患者资料。结果显示,来自解放军总医院的9例中有6例IAS患者年龄在40~72岁,北京协和医院总结中国40例患者年龄中位数为43岁,日本病例中发病高峰年龄为60~69岁,非亚种人群58例患者中有42例年龄大于40岁,4组性别差异无统计学意义。由此可见,40岁以上人群更易发IAS,但更为详尽的流行病学特点还需要大样本的调查进一步验证。
2. 发病机制
目前认为,IAS的发病建立在易感基因遗传背景的基础上,并与自身免疫缺陷、服用含巯基的药物诱发机体产生IAA等方面有密切关系。
研究提示,I A S 与人白细胞抗原(h u m a n leukocyte antigen,HLA)具有高度相关性。首先,基因型分为多克隆型和单克隆型。日本一项关于IAS患者的基因型分析显示,HLA-DR4/DQ3最为多见,其中HLA-DR4包括DRB1*0406、D R B 1*0 4 0 3、D R B 1*0 4 0 7,H L A-D Q 包括DQA1*0301和DQB1*0302,具体见表1[1]。从表1中可分析出日本IAS患者基因型的三个特点:①DR4是IAS的主要易感基因;②DRB1*0406基因型患者IAS发生风险高;③DR4B1链中Glu74对于患者体内IAA抗体的形成极为重要,同时Ser37亦有助于抗体的形成。另一项有关日本IAS患者HLA相关基因的筛查显示,所有患者均携带HLA-DRB1*0406等位基因[7,8],但亦有DRB1*0401及DRB1*0407阳性的个案报道[9,10]。我国仅1例作了相关基因检测为DRB1*0406阳性[11]。这些结果提示HLA-DRB1*0406可能是IAS发病的主要遗传易感基因。
含巯基药物包括他巴唑、巯甲丙脯酸、谷胱甘肽、丙基巯嘧啶、吡硫醇、卡托普利、青霉胺、亚胺培南以及卡比马唑等。多数学者[12,13]认为,含巯基药物能够与胰岛素分子的二硫键相互作用,使内源性胰岛素发生变构——二硫键断裂,改变了胰岛素分子的免疫原型,从而触发免疫反应,产生IAA。日本的调查[2]显示甲巯咪唑(methimazole,MTZ)和Graves病是IAS发病的主要诱因,除日本之外的东亚10例报道中,7例有Graves病并服用MTZ。2012年国内回顾性比较研究结果[6]显示,国内IAS病例多数合并有Graves病(6/9~24/40),且多为服用MTZ后诱发(6/6~22/24),少数(1/9~2/40)合并风湿系统疾病,包括强直性脊柱炎、系统性红斑狼疮、硬皮病等;日本病例中43.7%(86/197)曾服用含巯基药物,22.3%(44/197)合并Graves病并应用MTZ;非亚洲人群34.5%(20/58)合并风湿或血液系统疾病,包括系统性红斑狼疮、类风湿性关节炎、良性单克隆丙种球蛋白病、多发性骨髓瘤等,5.2%(3/58)合并甲亢,3.4%(2/58)应用卡比马唑。上述结果提示,自身免疫缺陷和服用含巯基的药物是IAS的重要诱发因素。此外,某些非巯基化合物也可能诱发IAS,如类固醇、D860、α-干扰素及中药骨刺消增丸[14]等,其发生机制还不清楚。
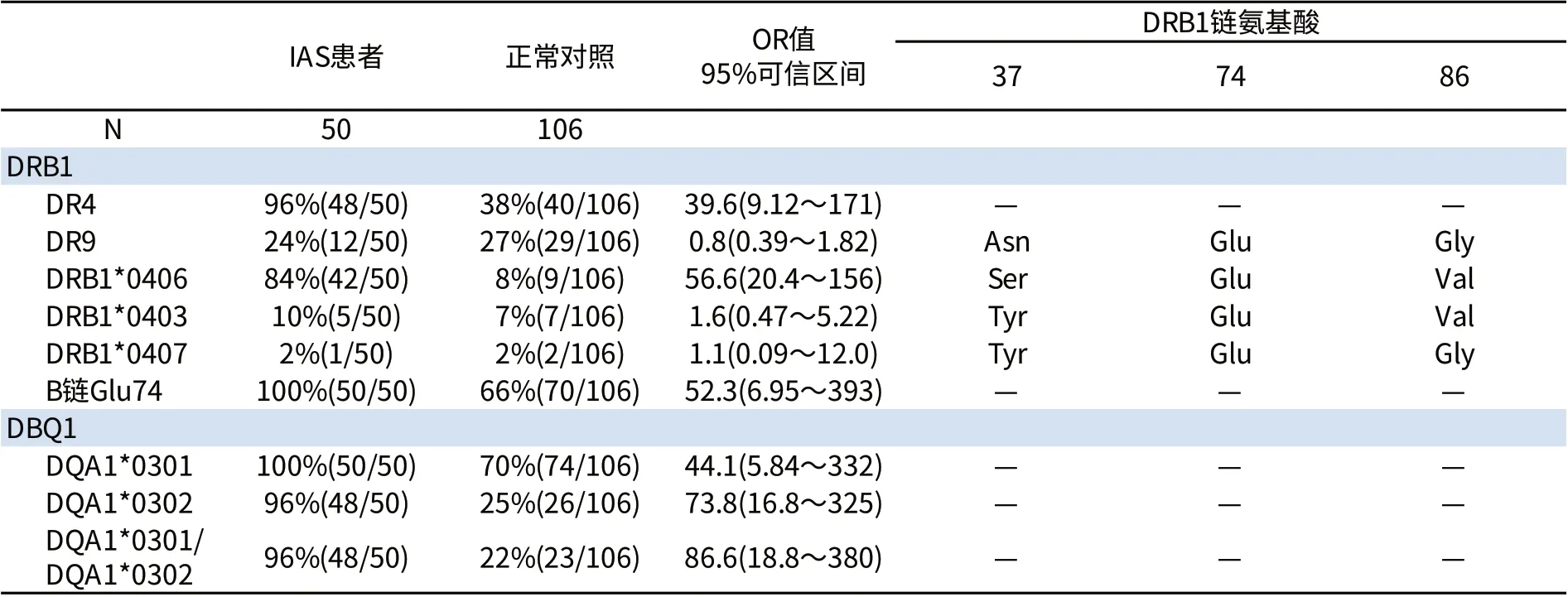
表1 日本IAS患者基因型分析
IAA的出现是IAS发病的关键,IAA分为多克隆型和单克隆型。研究数据包括日本、中国、韩国在内的东亚地区以多克隆型为主[1],非亚洲地区以单克隆型为主[3],抗体的异质性提示不同人群的IAS存在不同的发病机制。IAS患者的IAA不同于外源性胰岛素产生的抗体,Scatchard分析法结果显示IAS患者的IAA具有低亲和力和高结合容量的特点[15],这些抗体在血清中与自身胰岛素大量结合。进食刺激分泌的胰岛素因与IAA结合,故不能发挥其生理效应,于是血糖显著升高,进一步刺激了胰岛β细胞分泌胰岛素,因而血中产生大量与抗体结合的胰岛素。同时,和IAA的结合也阻止了胰岛素的降解,从而扩大了血清胰岛素“储存池”。数小时后,患者血糖水平恢复正常,胰岛素分泌减少,游离胰岛素的减少使体内游离胰岛素和IAA结合的胰岛素间的平衡被打破。再加上IAA亲和力低,胰岛素-IAA复合物发生解离,大量游离胰岛素释放入血,显示出胰岛素的生物活性,而此时血糖已经恢复正常,这种胰岛素不按机体需要释放则引起低血糖。同时,由于存在胰岛细胞增生肥大,低血糖对胰岛细胞分泌胰岛素的反馈抑制作用减弱,致使血糖低于正常时仍有内源性胰岛素分泌,进一步加重低血糖。IAS发病机制目前仍有许多环节处于未知及假说阶段,需要研究进一步揭示和证实。
IAS的临床特点
1. 临床表现
患者多以反复发生的典型或较严重的自发性低血糖就诊。发作时血糖多低于2.8mmol/L。最初以头痛、焦虑、饥饿感等副交感神经兴奋症状为主,进而血糖降低,表现为出汗、震颤、心悸、乏力、皮肤苍白等交感神经兴奋症状。若血糖进一步下降,可导致低血糖休克或昏迷。患者常表现为空腹低血糖或餐后反应性低血糖。也有一部分患者出现低血糖的时间不规律,尤其病程较长、年龄较大者,可表现为无症状性低血糖,以昏迷为首发症状,临床上较难识别,误诊率较高。此外,IAS患者常合并有Graves病、系统性红斑狼疮、黑棘皮病等自身免疫性疾病,且大部分患者有服用诱发IAS的药物史,这些均为临床上与其他疾病相鉴别的特点。
2. 辅助检查
血液中IRI常>100mU/L,当>1000mU/L时需高度怀疑IAS;C肽浓度亦升高,但浓度要远低于胰岛素浓度,即所谓的胰岛素和C肽“分离现象”;在从未使用外源性胰岛素的情况下,血液中可存在高滴度IAA,表现为低亲和力和高结合容量;对于应用胰岛素治疗的糖尿病患者,可表现为反复夜间及凌晨低血糖,餐后表现为正常或较高血糖水平,且停用胰岛素无改善;患者行OGTT时可以呈糖耐量减低甚至糖尿病和/或诱发低血糖[15,16]。
IAS的诊断
1. IAS的诊断标准
(1)有典型的自发性低血糖症状。
(2)发作时血糖水平<2.8mmol/L。
(3)尽管从未接受过胰岛素治疗,但血中存在IAA,且活性增高。
(4)放射免疫法测血浆总免疫反应性胰岛素显着增高。
(5)偶有糖尿病症状或尿糖。
(6)病理组织学上可见到胰腺增生或多型胰岛组织,可能与长期刺激胰岛β细胞分泌胰岛素有关。
(7)排除胰岛素瘤及其他原因导致的低血糖。
IAS为自身免疫性疾病,当低血糖患者在没有用过任何胰岛素制剂而检查发现IAA明显升高是确诊本病的关键之一。而IAA亦可见于外源性胰岛素治疗前的1型糖尿病、多内分泌腺病患者和2%献血者中,这些人群中自身抗体产生的触发因素不明,自身抗体的水平较低,因而无相关的低血糖症状。
2. IAS的鉴别诊断
本病是比较少见的引起低血糖反应的疾病,容易误诊和漏诊,临床上需与以下疾病鉴别:
2.1 胰岛细胞瘤 是高胰岛素血症性低血糖最常见的病因,故低血糖患者发现胰岛素水平显著升高,很容易想到胰岛细胞瘤,文献中就有少数患者曾被误诊为胰岛素瘤而行手术探查。主要鉴别点:①胰岛素瘤低血糖多发生于空腹时,IAS空腹和餐后均可发生;②除自身免疫性低血糖外,其余原因所致的低血糖,血清胰岛素浓度均不会超过正常的10倍,IAS患者的血清胰岛素浓度呈特征性的异常升高,明显高于胰岛素瘤患者,大于1000mU/L时常提示IAS;③影像学检查胰岛素瘤常有占位表现,IAS则无占位表现。当患者出现反复低血糖发作而又无胰腺占位性病变时,一定要考虑到IAS的可能。
2.2 B型胰岛素抵抗 也可表现为顽固的低血糖发作并伴发自身免疫性疾病。以下几点可与IAS鉴别:①该病好发于中年黑人女性;②常伴难以控制的高血糖、严重胰岛素抵抗、黑棘皮病和雄性化表现;③低血糖多发生于空腹时,餐后低血糖少见;④胰岛素升高幅度小于IAS;⑤IAA呈阴性而胰岛素受体抗体阳性;⑥治疗常需大剂量糖皮质激素治疗低血糖、大剂量胰岛素治疗高血糖,且预后差、死亡率高[3]。
2.3 糖耐量受损或早期糖尿病 IAS在发作期间,除低血糖外还可出现糖耐量受损,餐后血糖高于正常,出现尿糖,可能被误诊为早期糖尿病。早期糖尿病患者胰岛素释放延迟,可出现类似IAS的迟发反应性低血糖,但胰岛素基础水平不高,C肽水平和胰岛素水平相一致,IAA阴性,多有糖尿病家族史,且多有超重或肥胖。IAS患者和早期2型糖尿病、肥胖者的胰岛素抵抗不同,前者主要是由于存在胰岛素抗体,空腹血糖正常或偏低,甚至可出现低血糖,而后者主要由于外周组织对胰岛素的敏感性降低,空腹胰岛素水平一般无IAS如此之高,空腹血糖水平正常或偏高。
2.4 其他 IAS也需与曾接受外源性胰岛素治疗IAA阳性者鉴别,IAS者的IAA多呈明显低亲和力和高结合容量[17,18],外源胰岛素所致抗体的滴度相对较低,随时间延长会逐渐下降,有自愈倾向,不会造成反复低血糖[6]。
IAS的治疗及预后
IAS患者多数预后良好,病程呈自限性经过,80%的患者1~3个月内可自行缓解。IAS的一般治疗需给予少量、多餐、低糖、高蛋白和高纤维饮食。有诱因者要首先停用他巴唑、巯丙酰甘氨酸类等含有巯基的药物。去除诱因后,大多数患者低血糖发作会逐渐减少、减轻,数月后消失,但再次使用该药又可诱发本病,故禁止再次使用此类药物。患者尽管可能有胰岛细胞增生,但目前不主张手术治疗。低血糖发作时应对症治疗,可静注葡萄糖或肌注胰高血糖素。α-糖苷酶抑制剂能够抑制葡萄糖吸收,减少对胰岛素分泌的刺激,对缓解IAS患者餐后低血糖有作用。偶见自然缓解迁延者,可用糖皮质激素。IAS对糖皮质激素反应敏感,小剂量使用(30mg/d)即可控制病情及加速病情缓解。少数严重的反复低血糖昏迷病例需应用糖皮质激素、免疫抑制剂,必要时血浆置换治疗。
IAS是一种临床上少见的自身免疫性疾病,现有的研究资料提示与某些遗传易感基因、药物以及自身免疫缺陷等因素密切相关,其完整的发病机制还有待进一步研究阐明。由于IAS临床上少见,其处理措施与其他低血糖症有很大区别,因此在临床工作中遇到低血糖患者尤其是自发性低血糖患者时,应注意与IAS鉴别,减少误诊和漏诊,及时诊断和处理,减少患者的痛苦和死亡风险。
[1] Uchigata Y, Hirata Y. Insulin autoimmune syndrome(IAS, Hirata disease)[J]. Ann Med Interne(Paris), 1999, 150(3): 245-253.
[2] Uchigata Y, Hirata Y, Iwamoto Y. Drug-induced insulin autoimmune syndrome[J]. Diabetes Res Clin Pract, 2009, 83(1): e19-20.
[3] Lupsa BC, Chong AY, Cochran EK, et al.Autoimmune forms of hypoglycemia[J]. Medicine(Baltimore), 2009, 88(3): 141-153.
[4] 陈敏,窦京涛,王先令,等.胰岛素自身免疫综合征临床特征及随访资料分析并文献复习[J].中华内分泌代谢杂志, 2012, 28(10): 813-816.
[5] Uchigata Y, Eguchi Y, Takayama-Hasumi S, et al. Insulinautoimmune syndrome(Hirata disease): clinical features and epidemiology in Japan[J]. Diabetes Res Clin Pract, 1994, 22(2-3): 89-94.
[6] 陈敏,庄晓明,窦京涛,等.胰岛素自身免疫综合征的临床特征比较分析[J].首都医科大学学报, 2012, 33(3): 409-413.
[7] Uchigata Y, Kuwata S, Tokunaga K, et al. Strong associationof insulin autoimmune syndrome with HLA-DR4[J]. Lancet, 1992, 339(8790): 393-394.
[8] Uchigata Y, Kuwata S, Tsushima T, et al. Patients with Graves' disease who developed insulin autoimmune syndrome(Hirata disease) possess HLA-Bw62/Cw4/DR4 carrying DRB1*0406[J]. J Clin Endocrinol Metab, 1993, 77(1): 249-254.
[9] Murakami M, Mizuide M, Kashima K, et al. Identification ofmonoclonal insulin autoantibodies in insulin autoimmune syndrome associated with HLA-DRB1*0401[J]. Horm Res, 2000, 54(1): 49-52.
[10] Uchigata Y, Hirata Y, Omori Y, et al. Worldwide differences in the incidence of insulin autoimmune syndrome(Hirata disease) with respect to the evolution of HLA-DR4 alleles[J]. Hum Immunol, 2000, 61(2): 154-157.
[11] 杜建玲,李昌臣,谷玲,等.他巴唑致胰岛素自身免疫综合征1例[J]. 中华内科杂志, 2001, 40(7): 438.
[12] 舒子正,沈菲菲,朱姿英.他巴唑致低血糖昏迷2例[J].中华内分泌代谢杂志, 1999, 15(2): 76.
[13] 刘平,刘荣莉,云云.抗甲状腺药致胰岛素自身免疫综合征1例[J].现代诊断与治疗, 2003, 14(2): 124.
[14] 田坚,沈静雪.服用骨刺消增丸所致胰岛素自身免疫综合征1例[J]. 中国实用内科杂志, 2003, 23(6): 384.
[15] Nasu T, Suzuki R, Okamoto Y, et al. Late postprandial hypoglycemia due to bioactive insulin dissociation from autoantibody leading to unconsciousness in a patient with insulin autoimmune syndrome[J]. Intern Med, 2011, 50(4): 339-343.
[16] Okazaki-Sakai S, Yoshimoto S, Yagi K, et al. Insulin autoimmune syndrome caused by an adhesive skin patch containing loxoprofensodium[J]. Intern Med, 2013, 52(21): 2447-2451.
[17] Eguchi Y, Uchigata Y, Yao K, et al. Longitudinal changes of serum insulin concentration and insulin antibody features in persistent insulin autoimmune syndrome(Hirata's disease)[J]. Autoimmunity, 1994, 19(4): 279-284.
[18] Suzuki K, Hirayama S, Ito S. A case of a non-insulin dependent diabetic patient with regular spontaneous hypoglycemic attacks, which were due to insulin-binding antibodies induced by human insulin therapy[J]. Tohoku J Exp Med, 1997, 182(2): 163-173.

