响应面法优化籽瓜皮中高纯度果胶的提取工艺
杨继涛,杨 敏
(1.甘肃农业大学 理学院,甘肃 兰州 730070;2.甘肃农业大学农业资源化学与应用研究所,甘肃 兰州 730070)
籽瓜(Citrullus lanatusssp.vulgaris var.megakasperms Lin et Chao),葫芦科,一年生蔓性草本,形状与西瓜类似,多籽,含糖量低,因其习惯上以食用籽为主,故称籽瓜[1-2]。籽瓜在我国种植面积广泛,尤其在我国西北干旱地区为重要的经济作物[3]。由于籽瓜主要为籽用,长久以来,在籽瓜主产区都是以取籽为主,作为加工炒食制品的原料,而瓜瓤和瓜皮则丢弃不用,丢弃的瓜瓤和瓜皮占总质量的65%~70%,致使籽瓜利用率低,而且造成了严重的浪费[4]。
果胶存在于植物细胞壁和细胞内,一般从苹果、柑橘等果皮中提取[5-8]。果胶在乳品工业、酿造业中有着广泛的应用,市场需求巨大[9-12]。果胶为多糖类大分子化合物,利用响应面法优化果胶提取的报道较多,大多数工艺中,一般以水为提取溶剂,辅以微波、加热、超声等方法,而植物中大分子极性化合物,如杂多糖、色素、蛋白质等,均会出现共提取的问题,影响果胶产品的纯度[13-15]。果胶纯度一般用半乳糖醛酸含量来表示,含量越大表示纯度越高[16]。本研究采用咔唑-硫酸比色法测定果胶中半乳糖醛酸含量,为了更好提高籽瓜皮中所提取果胶的纯度,考察以水为提取溶剂条件下,提取温度、提取时间和提取液pH值等因素对籽瓜皮中果胶提取的影响,并对提取条件进行响应面法优化,确定高纯度果胶的最佳提取工艺参数,利用傅里叶变换红外光谱对比分析了在优化条件下所提取的籽瓜皮中果胶的纯度,以期为籽瓜皮果胶的高效提取提供参考依据。
1 材料与方法
1.1 材料与试剂
籽瓜:采自甘肃白银平川;高纯果胶(半乳糖醛酸含量76%):郑州天顺食品添加剂有限公司;浓盐酸(分析纯)、无水乙醇(分析纯)、浓硫酸(分析纯):北京化工厂;D-半乳糖醛酸标准品:上海源叶生物科技公司;咔唑(分析纯):上海中秦化学试剂有限公司;溴化钾(色谱纯):Aladdin化学试剂(上海)有限公司。
1.2 仪器与设备
JA2003型精密电子天平:上海良平仪器仪表有限公司;DF-Ⅱ集热式磁力加热搅拌器:金坛市顺华仪器有限公司;电热鼓风干燥箱:杭州汇尔仪器设备有限公司;PHS-3C酸度计:上海精密科学仪器有限公司;722型可见分光光度计:上海佑科仪器仪表有限公司;FTS3000型傅立叶变换红外光谱仪:美国Digilab公司;XFB-200型粉碎机:湖南中诚制药机械厂。
1.3 实验方法
1.3.1 籽瓜皮中果胶的提取
籽瓜皮的预处理:选取新鲜无腐的籽瓜皮,洗净后切成小块,然后在沸水中加热煮沸8 min,再用50 ℃热水淋洗2~3次,以除尽籽瓜皮内的酶,自然风干,将风干后的籽瓜皮粉碎过100目筛封装备用。
果胶提取:称取30.0 g上述处理好的籽瓜皮粉末,按一定的料液比加入蒸馏水,用浓盐酸调节pH,油浴恒温一定时间提取果胶,趁热过滤得滤液,再对残渣进行相同条件的二次提取。集合滤液减压浓缩至200 mL,加入体积比1∶3的无水乙醇沉析过夜,析出果胶后离心收集,放入干燥箱中60 ℃干燥12 h,称质量备用。
1.3.2 半乳糖醛酸标准曲线的绘制及含量测定
采用咔唑-硫酸法测定籽瓜皮果胶中的半乳糖醛酸的含量[17]。
(1)半乳糖醛酸标准溶液的配制
准确称取半乳糖醛酸标准品10 mg,蒸馏水溶解并定容于100 mL容量瓶中,配制成100 μg/mL的标品溶液。各移取上述半乳糖醛酸溶液1~9 mL于10 mL容量瓶中,稀释至10 mL,得到质量浓度为10~90 μg/mL的半乳糖醛酸标准品溶液。
(2)半乳糖醛酸标准曲线制定
移取不同质量浓度的半乳糖醛酸标准溶液各1 mL于具塞试管中,在冰水浴冷却下,缓慢加入5.5 mL浓硫酸,沸水浴中加热15 min后,降至室温,再加入0.15%咔唑0.5 mL,充分混合(以蒸馏水代替半乳糖醛酸标准溶液,依上法同样处理,作为对照空白)。室温放置35 min后,利用分光光度计在波长530 nm处,分别测定其吸光度值,以吸光度值(y)为纵坐标,标准溶液中半乳糖醛酸的含量(x)为横坐标,制作半乳糖醛酸标准曲线。
(3)果胶半乳糖醛酸含量测定
准确称取籽瓜皮果胶样品10 mg,配制成0.1%的果胶溶液,精确量取1 mL待测液,按照上述实验步骤测定其吸光度值。通过上述绘制的标准曲线计算果胶中半乳糖醛酸的含量,其计算公式如下:
Y=A×V×N/W×100%
式中:Y为半乳糖醛酸含量,%;A为从标准曲线中查得的半乳糖醛酸质量浓度,μg/mL;V为待测液的体积,mL;N为稀释倍数;W为果胶样品质量,g。
1.3.3 果胶提取的单因素试验和响应面设计
(1)单因素试验设计
以半乳糖醛酸含量为响应值,分别研究提取温度(73℃、78 ℃、83 ℃、88 ℃、93 ℃)、提取时间(30 min、60 min、90 min、120 min、150 min)、pH值(1.0、1.5、2.0、2.5、3.0)和料液比(30∶1、27∶1、25∶1、23∶1、21∶1(g∶L))对籽瓜皮中所提取果胶的半乳糖醛酸含量的影响。
(2)Box-Behnken试验设计
在单因素试验的基础上进行响应面优化试验,以提取时间(A)、提取温度(B)、提取液pH值(C)为影响因素,以籽瓜皮果胶中半乳糖醛酸含量(Y)为响应值,确定籽瓜皮中果胶的最优提取条件。因素与水平编码见表1。

表1 响应面试验因素与水平编码Table 1 Factors and levels of response surface design
1.3.4 傅里叶变化红外光谱分析
利用傅立叶变换红外光谱仪,比对市售果胶样品和最佳工艺条件下提取的籽瓜皮中果胶的红外光谱。各准确称取10 mg的果胶样品,60 ℃干燥6 h,粉碎研细后,KBr压片,扫描波数范围400~4 000 cm-1,扫描时间0.5 min,扫描分辨率4 cm-1,扫描次数32。
2 结果与分析
2.1 半乳糖醛酸标准曲线的绘制
采用咔唑-硫酸比色法测定不同质量浓度的半乳糖醛酸在波长530 nm处的吸光度值,以半乳糖醛酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制出的半乳糖醛酸标准曲线,结果如图1所示。

图1 半乳糖醛酸的标准曲线Fig.1 Standard curve of galacturonic acid
由图1可知,在0~90 μg/mL范围内,标准曲线线性回归方程为y=0.005 8x-0.008 6,拟合系数R2=0.999 1,表明半乳糖醛酸含量与吸光度值呈良好的线性关系。
2.2 籽瓜皮中果胶提取工艺的单因素试验结果
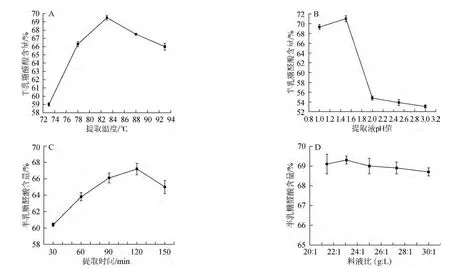
图2 提取温度(A)、提取液pH值(B)、提取时间(C)和料液比(D)对果胶中半乳糖醛酸含量的影响Fig.2 Effects of extraction temperature (A),pH value (B),time (C) and solid-liquid ratio (D) on galacturonic acid content of pectin
由图2可以看出,随着提取温度的升高,半乳糖醛酸含量显著提高,在83 ℃时半乳糖醛酸含量达到最大值为69.5%,继续升高温度,半乳糖醛酸含量降低。这可能是因为过高的温度会使果胶发生降解,导致半乳糖醛酸含量减少。因此,选择提取温度为83 ℃较为理想。
提取液pH值在1.0~1.5,随着pH值的增大,半乳糖醛酸含量提高。pH值>1.5之后,半乳糖醛酸含量显著降低,表明果胶半乳糖醛酸存在一个较低的pH范围内,较高的pH不利于果胶半乳糖醛酸提取。因此,选择提取液pH值为1.5较为理想。
提取时间在30~120 min,半乳糖醛酸含量逐渐提高,提取时间>120 min,半乳糖醛酸含量下降。可见,提取时间过长,会使部分游离的果胶水解,造成果胶半乳糖醛酸含量降低。因此,选择提取时间为120 min较为理想。
料液比在20∶1~30∶1(g∶L),半乳糖醛酸含量的变化不明显,在料液比为23∶1(g∶L)时达到最大值69.3%,再继续增大料液比,半乳糖醛酸含量开始减小,因此,选择提取料液比为23∶1(g∶L)较为理想。
2.3 响应面试验
2.3.1 响应面试验结果与分析
从单因素试验结果可知,其中料液比因素对半乳糖醛酸的含量影响较小,固定料液比为23∶1(g∶L),以提取时间,提取温度及提取液pH值为因素设计响应面试验。按照试验设计方案进行响应面试验分析,其结果见表2,显著性与方差分析结果见表3。

表2 Box-Behnken响应面试验设计及结果Table 2 Design and results of Box-Behnken response surface experiment

表3 回归模型显著性与方差分析Table 3 Variance analysis and significance tests of regression model
利用Design-Expert 8.0软件对表2数据进行多元回归拟合,果胶半乳糖醛酸含量(Y)与各因素的回归方程如下:

由表3看出,模型极显著(P<0.000 1),失拟检验的P值是0.085 0>0.05,表明相对于纯误差失拟是不显著的。拟合模型的R2=0.997 5,表明99.75%的变异来源于自变量。预测模型R2=0.994 2,表明试验值与对应的模型预测值之间高度一致,由此可知模型拟合良好,可用该回归模型代替试验真实点对试验结果进行分析。
分析表3可知,各因素对果胶半乳糖醛酸含量影响排序为C(pH值)>B(温度)>A(时间)。其中对果胶半乳糖醛酸的含量影响极显著的是B、C、AB、BC、A2、B2、C2,显著的是AC。
2.3.2 单因素交互作用
考察各因素之间相互关系对籽瓜皮果胶中半乳糖醛酸含量的影响,通过Design-Expert 8.0软件对各因素之间的交互作用进行响应面分析,绘制响应面曲线图和等高线图,结果见图3。
由图3A可以看出,提取温度在低水平时,延长提取时间能提高果胶半乳糖醛酸含量,提取温度在高水平时,加热较短的时间就能获得较高的半乳糖醛酸含量,其曲面较为平缓。
由图3B可以看出,提取温度和提取液pH值两个因素间有较强的交互作用,其曲面较陡,提取温度为78~88 ℃及提取液pH值为1.0~1.5 时,果胶半乳糖醛酸含量达到较高值,当二者水平过高或过低都会使果胶半乳糖醛酸含量下降,提取液pH值和提取温度应有各自适宜的水平范围。
由图3C可以看出,提取时间和提取液pH值与半乳糖醛酸含量呈抛物线关系,曲面也较为陡,在一定范围内随着时间延长和pH值升高,半乳糖醛酸含量增大,达到最大值后,继续延长提取时间和提高提取液pH值,半乳糖醛酸含量呈下降趋势。
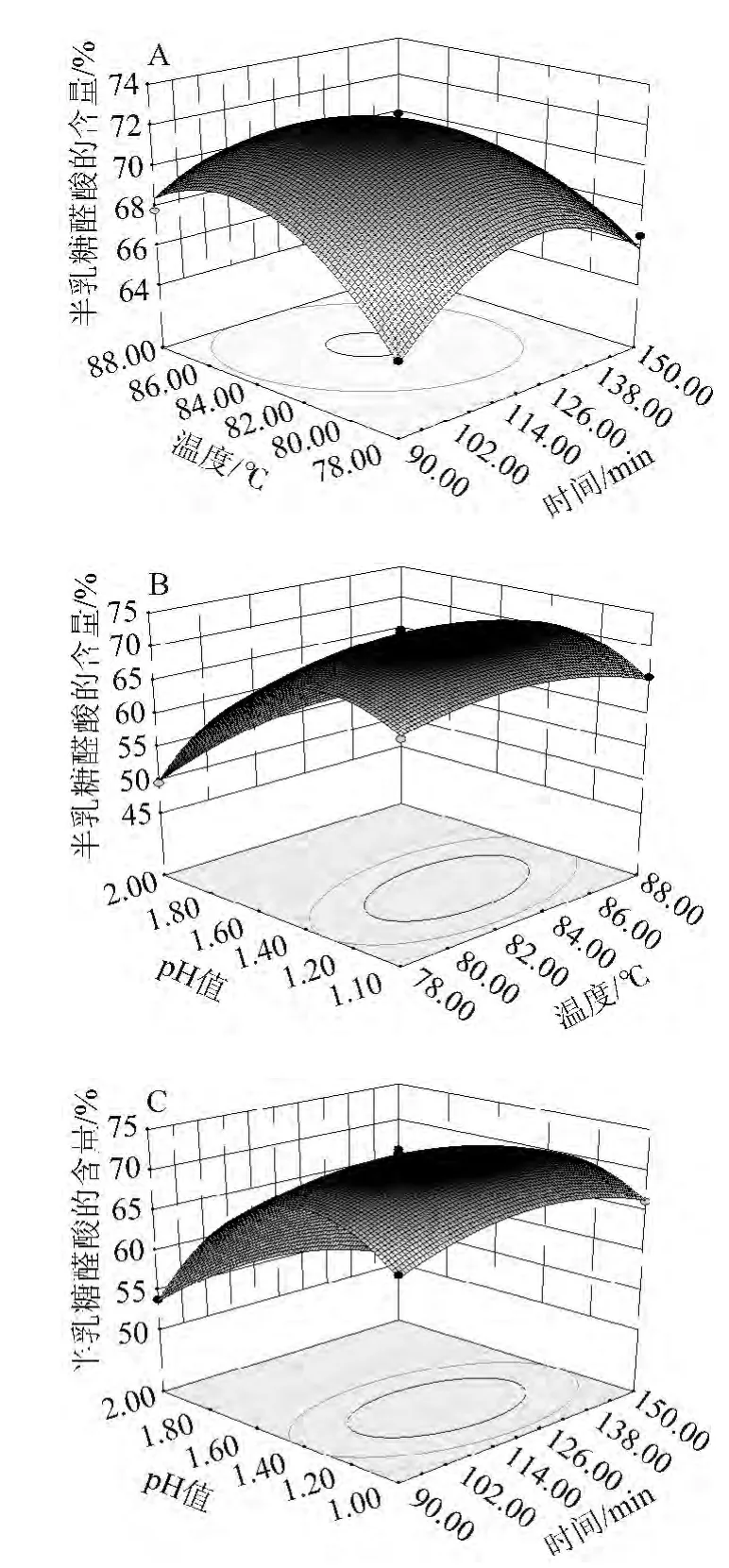
图3 提取温度、提取时间和提取液pH值的交互作用对果胶中半乳糖醛酸含量影响的响应曲面和等高线Fig.3 Response surface plots and contour line of effects of interactions between extraction time,temperature and pH value on galacturonic acid content of pectin
2.3.3 模型验证
运用Design-Expert 8.0确定的最佳提取工艺为提取温度88 ℃,提取时间147 min,提取液pH值为1.64,在此条件下,果胶中半乳糖醛酸含量的的预测值为78.10%。考虑到操作的方便性,确定的最佳工艺条件为提取温度88 ℃,提取时间150 min,提取液pH值为1.6,在此条件下,果胶中半乳糖醛酸含量的的预测值78.03%。采用上述条件进行模型验证,试验重复5次,所得籽瓜皮果胶中半乳糖醛酸含量平均值为76.65%,与理论预测值拟合较好,可见该模型能较好地模拟与预测提取工艺条件对果胶中半乳糖醛酸含量的影响。
2.4 红外光谱比对分析

图4 不同果胶的红外光谱图Fig.4 Infrared spectrogram of different pectin
由图4可以看出,由于果胶为多糖类化合物,其中含有大量的羟基,其中在波数范围3 700~3 000 cm-1出现的宽峰为羟基O-H振动的结果;果胶中半乳糖醛酸甲酯的部位在波数2 900~2 700 cm-1之间产生O-CH3的伸缩振动;波数1 627 cm-1和1 743 cm-1处分别为羧基官能团和酯化羧基官能团中C=O的吸收峰[18]。经比较,采用优化工艺从籽瓜皮中所提取果胶与商售高纯果胶产品红外图谱峰型与丰度较一致,产品对比具有较好的相似性。
3 结论
利用响应面分析法,优化了籽瓜皮中果胶提取工艺,即水溶剂条件下,提取温度88 ℃,提取时间150 min,提取液pH值为1.6,料液比为23∶1(g∶L)。该条件下提取的果胶半乳糖醛酸含量较高,均值为76.65%,与理论预测值(78.03%)拟合良好,实验的重现性好。所提取果胶符合市场规定的半乳糖醛酸含量≥65%的标准[19]。利用傅里叶变换红外光谱比对分析表明,市售高纯果胶产品与本研究所提取的果胶红外光谱图吻合度高,说明采用响应面法优化的提取工艺参数准确可靠,可运用于实践。
[1]程瑛琨,孟庆繁,陈亚光,等.籽瓜多种营养成分的分析[J].食品研究与开发,2006,27(7):169-171.
[2]吴霞明,赵金莲.籽瓜中微量元素与维生素含量的分析[J].中国酿造,2007,26(11):65-67.
[3]梁 琪,郑善强.甘肃省不同产地籽瓜瓤皮成分分析[J].甘肃农业大学学报,1999,34(1):79-83.
[4]田林森.籽瓜综合加工[J].食品科学,1997,18(6):65-66.
[5]贾艳萍,何爱民.微波法萃取橘皮中果胶的研究[J].中国酿造,2006,25(3):48-51.
[6]文奋武,杨孝朴.甜菜渣提取果胶的研究:酸法萃取,乙醇沉淀工艺[J].兰州大学学报:自然科学版,1996,32(4):142-148.
[7]牛丽影,李大婧,刘春泉.响应面法优化香橼果胶提取工艺[J].食品工业科技,2013,34(23):219-222.
[8]WAI W W,ALKARKHI A F M,EASA A M.Comparing biosorbent ability of modified citrus and durian rind pectin[J].Carbohyd polym,2010,79(3):584-589.
[9]董 丹,关统伟,雷 激,等.柠檬皮渣果胶提取预处理工艺研究[J].中国酿造,2014,33(12):80-84.
[10]KIM Y,WICKER L.Charge domain of modified pectins influence interaction with acidified caseins[J].Food Hydrocolloid,2011,25(3):419-425.
[11]BEYER M,REICHERT J,HEURICH E,et al.Pectin,alginate and gum arabic polymers reduce citric acid erosion effects on human enamel[J].Dent Mater,2010,26(9):831-839.
[12]RAKHSHAEE R,PANAHANDEH M.Stabilization of a magnetic nano-adsorbent by extracted pectin to remove methylene blue from aqueous solution:a comparative studying between two kinds of crosslikened pectin[J].J Hazard Mater,2011,189(1):158-166.
[13]刘焕云,李慧荔,顿博影.微波加热法提取柚果皮果胶的工艺[J].农业工程学报,2008,24(8):302-304.
[14]章 凯,黄国林.微波萃取技术及其在果胶提取中的应用[J].中国酿造,2009,28(4):9-13.
[15]李建凤,任 磊,王 真,等.响应曲面法用于超声波提取柠檬皮渣果胶研究[J].食品工业科技,2013,34(4):267-269.
[16]余继宏,朱炯波,聂 琴.天仙果果胶提取条件及含量测定[J].中国林副特产,2007(3):6-8.
[17]张小玲.果胶的咔唑硫酸分光光度测定法研究[J].甘肃农业大学学报,1999,34(1):75-78.
[18]冯 静,梁瑞红,刘成梅,等.菠萝皮果胶的提取及结构组成研究[J].食品工业科技,2011,32(11):241-243.
[19]赵 利,王 杉.果胶的制备及其在食品工业的应用综述[J].食品科技,1999(5):32-34.

