鸡miR-20a靶基因TP53INP1鉴定
王宁,段逵,宋鹤,张潇飞,张天目,张文建,闫晓红,王守志,李辉
(农业部鸡遗传育种重点实验室,东北农业大学动物科学技术学院,哈尔滨150030)
鸡miR-20a靶基因TP53INP1鉴定
王宁,段逵,宋鹤,张潇飞,张天目,张文建,闫晓红,王守志,李辉
(农业部鸡遗传育种重点实验室,东北农业大学动物科学技术学院,哈尔滨150030)
前期研究发现,过表达miR-17-92基因簇能促进鸡前脂肪细胞增殖,但作用机制尚不清楚。生物信息学分析发现,TP53INP1是miR-17-92基因簇成员miR-17-5p和miR-20a的潜在靶基因,研究采用荧光素酶报告基因技术和基因过表达技术开展该靶基因的验证。结果表明,过表达miR-17-92基因簇能显著抑制TP53INP1的3' UTR报告基因活性;而转染miR-20a抑制剂能显著提高TP53INP1的3'UTR报告基因活性。将miRNA抑制剂分别转染到DF1细胞和鸡前脂肪细胞中,采用real-time RT-PCR方法检测细胞TP53INP1基因表达变化。结果显示,miR-20a抑制剂能促进TP53INP1表达,TP53INP1是miR-20a的一个靶基因。
鸡;miR-17-92基因簇;前脂肪细胞;TP53INP1;基因表达
miRNA是一类非编码小RNA分子,通过与靶mRNA不完全碱基互补配对,导致靶基因mRNA降解或翻译抑制,调控靶基因表达[1]。miRNA是机体发育中必不可少的小RNA分子,目前很多研究证明,miRNA参与动物细胞发育、增殖,分化、凋亡及代谢等过程[2-3]。miRNA基因在染色体上的分布非随机,miRNA基因紧密相邻,排列成簇[4-5]。miR-17-92基因簇是目前受关注miRNA簇之一,该基因簇能编码产生miR-17、miR-18a、miR-19a、miR-20a、miR-19b和miR-92等成员,该簇miRNA成员在多种肿瘤中高表达,过表达会导致疾病和癌症发生[6-7]。
人体miR-17-92基因簇位于13号染色体C13orf25上[8],该miRNA簇在动物发育和疾病发生过程中发挥重要作用,可增加成骨细胞增殖能力[9],调节脂肪形成多个信号通路[10]。本研究前期在鸡前脂肪细胞小RNA重测序中发现mir-17-92基因簇在鸡前脂肪细胞中表达[11],进一步研究发现,miR-17-92基因簇过表达能促进鸡前脂肪细胞增殖(未发表)。但miR-17-92基因簇促进鸡脂肪细胞增殖的机制仍不清楚。
TP53INP1是一个p53诱导核蛋白1,TP53INP1能影响细胞进程,调节细胞增殖、凋亡等[12-13]。本研究生物信息学分析发现,TP53INP1基因3'UTR存在miR-17-92基因簇成员miR-20a和miR-17-5p的集合位点,提示TP53INP1就是miR-17-92基因簇的靶基因[14]。为揭示miR-17-92基因簇促进鸡前脂肪细胞增殖的分子机制,本研究开展鸡miR-17-92基因簇靶基因TP53INP1鉴定。
1 材料与方法
1.1 材料
脂肪组织来自东北农业大学高、低脂双向选择系(NEAUHLF)高脂鸡,miR-17-92基因簇过表达质粒pcDNA3.1-miR-17-92、鸡前脂肪细胞(ICPA)和胚胎成纤维细胞(DF1)均为农业部鸡遗传育种重点实验室保存,psiCHECK2载体购自Promega公司,miR-17-5p inhibitor、miR-20a inhibitor、miR-19a inhibitor和miR-19b inhibitor购自上海吉玛公司。
1.2RNA提取与反转录
使用Trizol提取东北农业大学高、低脂双向选择系(NEAUHLF)的高脂鸡脂肪组织,鸡胚胎成纤维DF1细胞和ICPA细胞总RNA,以A260/A280比值在(1.8~2.0)高质量的RNA作为模板,采用Promega反转录试剂盒合成cDNA。
1.3 载体构建
以东北农业大学高低脂双向选择系(NEAUHLF)高脂鸡脂肪组织cDNA为模版,使用primer 5.0设计引物(见表1),采用RT-PCR扩增TP53INP1(NM_001030946.1)的3'UTR,该片段包含miR-17-92基因簇成员结合位点的片段(835 bp);将扩增片段克隆到含有XhoⅠ和NotⅠ酶切位点的psi-CHECK2双荧光素酶报告基因载体上,构建成psi-CHECK2-TP53INP1。

表1RT-PCR引物和real-time PCR引物序列Table 1Primer sequences for RT-PCR and real-time PCR
1.4 细胞培养与转染
DF1和前脂肪细胞均采用完全培养基(DMEM/ F12+10%FBS),并在37℃5%CO2条件下培养。转染前,将细胞按照每孔1×104密度接种到六孔板,待细胞完全贴壁并生长至70%~80%密度时转染。细胞转染参照Invitrogen脂质体2000转染试剂说明书。将质粒分别转染至六孔板细胞中;每孔加入质粒2 μg,转染试剂8 μL;转染48 h后收集细胞,检测荧光素酶活性。
1.5 荧光素酶活性检测
使用Dual-Luciferase Reporter Assay System(Promega公司)分别检测萤火虫荧光素酶和海肾荧光素酶活性,报告基因活性结果以萤火虫/海肾相对值表示,所有试验均重复3次并计算标准差。
1.6 实时荧光定量PCR(real-time PCR)
使用real-time PCR仪型号为ABI 7500。反应体系为:Roche FastStart Universal SYBR Green Master(Rox)(2×)5 μL,上、下游引物(10 μmol·L-1)各0.2 μL,cDNA模板1 μL,ddH2O 3.6 μL,总体积10 μL。反应条件:95℃预变性10 s,95℃变性5 s,60℃复性延伸34 s,共40个循环。溶解曲线95℃15 s,60℃10 min,95℃15 s,每个样品设3孔重复。以NONO基因为内参,利用2-△△Ct方法将原始Ct值转换为相对基因表达量。所用引物序列见表1。
1.7 数据分析
数据分析采用Student's t-test,运用SAS 9.2软件完成,数据格式表示为(平均值±标准差)。统计分析P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1TP53INP1基因3'UTR生物信息学分析
鸡TP53INP1基因(NM_001030946.1)的3'UTR长度是4 008 bp。应用UCSC数据库分析发现,鸡、猕猴、鼠、狗、大象及热带爪蟾等TP53INP1基因3'UTR基因组序列存在同源性较高区域(见图1),提示该区域可能是重要的TP53INP1表达调控元件。进一步采用在线miRNA靶基因分析软件Targetscan分析发现,鸡TP53INP1基因mRNA的3'UTR存在miR-17-92基因簇成员miR-17-5p和miR-20a的潜在靶结合位点;比较分析显示,TP53INP1基因3'UTR的这两个潜在miRNA结合位点在各物种非常保守,这两个miRNA种子区结合序列在鸡、人、鼠、猪等动物中完全相同(见图2)。
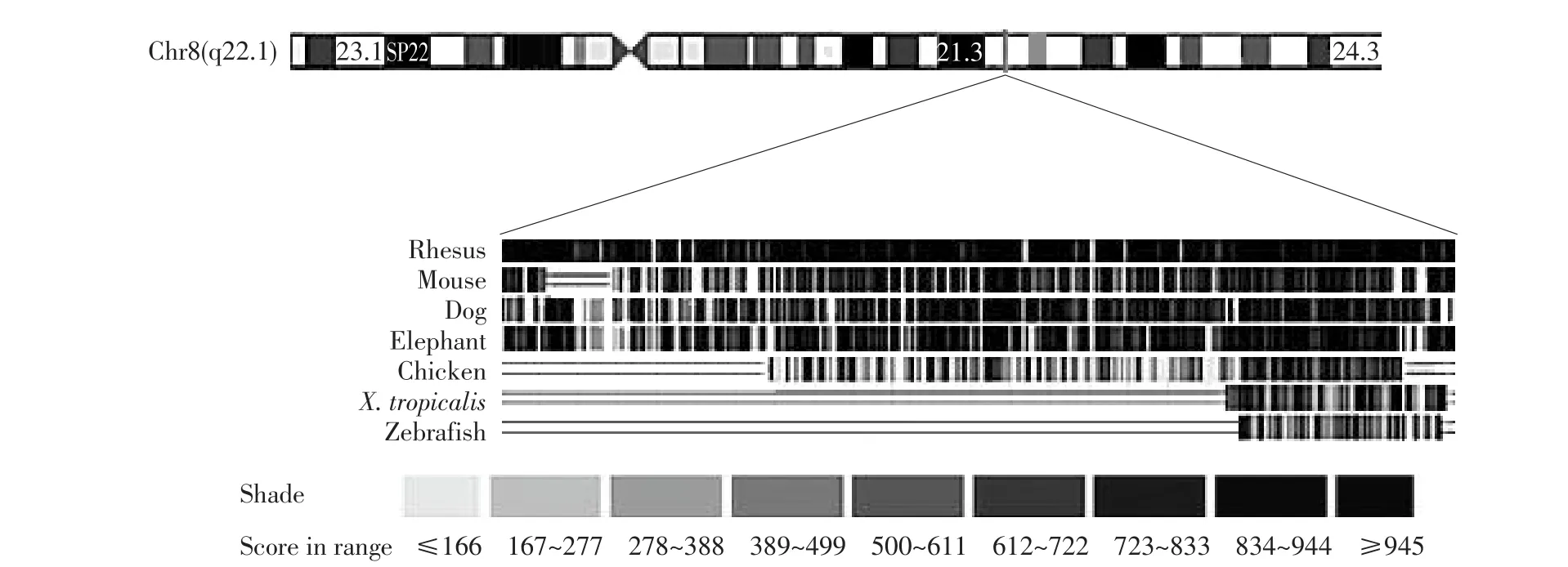
图1TP53INP1基因3'UTR的同源性分析Fig.1Homology analysis of TP53INP1 3'UTR

图2 鸡TP53INP1 3'UTR的miR-17-92基因簇miRNA成员结合区分析Fig.2Predicted miRNA binding sites of miR-17-92 cluster in chicken TP53INP1 3'UTR
2.2miR-17-92基因簇对TP53INP1的调节作用分析
为确定miR-17-92基因簇是否靶作用于TP53INP1上的3'UTR,构建鸡TP53INP1的3'UTR荧光素酶报告基因载体(psiCHECK2-TP53INP1)(见图3),酶切测序正确无误后,将miR-17-92基因簇pcDNA3.1-miR-17-92过表达质粒和psi-CHECK2-TP53INP1质粒共转染到DF1细胞,48 h后收细胞,使用荧光素酶报告基因检测系统测定萤火虫/海参荧光素酶相对活性。结果发现,与pcDNA3.1-control相比,pcDNA3.1-miR-17-92能极显著抑制psiCHECK2-TP53INP1荧光素酶报告基因活性达5倍以上(P<0.01)(见图4)。这表明miR-17-92家族成员可能直接调控TP53INP1表达。
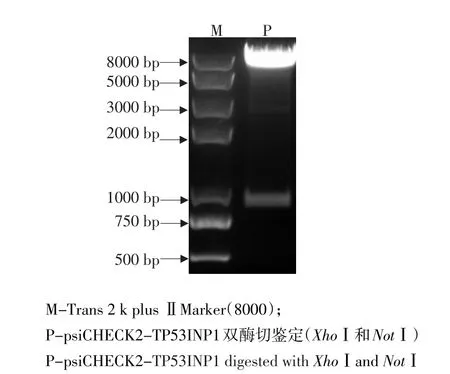
图3psiCHECK2-TP53INP1载体双酶切验证Fig.3Identification of psiCHECK2-TP53INP1 plasmid by double enzyme digestion with XhoⅠand NotⅠ
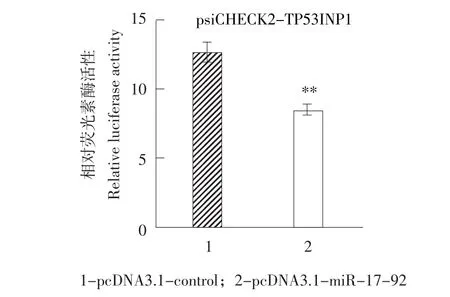
图4miR-17-92基因簇对psiCHECK2-TP53INP1报告基因活性影响Fig.4Effect of miR-17-92 cluster overexpression on relative luciferase activity of psiCHECK2-TP53INP1
2.3miR-20a对TP53INP1的调节作用
生物信息学分析显示,miR-17-92基因簇中miR-17-5p,miR-20a均靶作用于TP53INP1,为确定这两个miRNA成员是否作用于TP53INP1,利用miR-17-5p和miR-20a的inhibitor与psiCHECK2-TP53 INP1共转染到DF1细胞中,测定相对荧光活性。结果发现,与inhibitor NC相比,miR-17-5p inhibitor和miR-20a inhibitor均能提高报告基因活性,其中miR-20a达到显著水平(P<0.05)(见图5),结果表明miR-20a可能靶作用于TP53INP1。
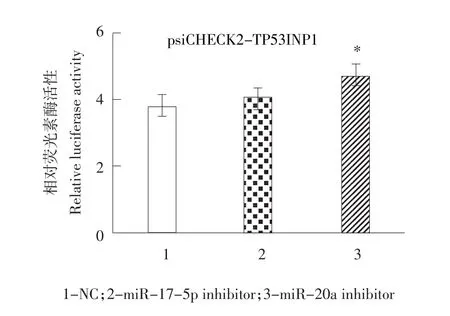
图5 转染miR-17-5p inhibitor和miR-20a inhibitor对psiCHECK2-TP53INP1报告基因活性影响Fig.5Effect of miR-17-5p inhibitor and miR-20a inhibitors on reporter activity of psiCHECK2-TP53INP1
为进一步验证miR-17-5p和miR-20a是否靶作用于TP53INP1,使用miR-17-5p、miR-20a、miR-19a和miR-19b的inhibitor,转染到DF1细胞中,以miRNA inhibitor NC作为阴性对照,24和48 h后使用real-time RT-PCR检测TP53INP1在DF1细胞中的表达水平。结果发现,与miRNA inhibitor NC相比,转染miR-20a inhibitor显著提高TP53INP1表达水平,而转染miR-17-5p、miR-19a和miR-19b的inhibitor对TP53INP1的mRNA表达水平未发生显著变化(P>0.05)(见图6)。此结果与报告基因分析结果一致,说明在DF1细胞中鸡miR-20a靶作用于TP53INP1。
采用同样方法,分析miR-17-5p,miR-19a,miR-19b,miR-20a的inhibitor,对鸡前脂肪细胞内源性TP53INP1表达影响,结果与DF1细胞结果一致,转染miR-20a的inhibitor显著提高细胞TP53INP1表达水平(P<0.05)。但转染miR-17-5p、miR-19a和miR-19b的inhibitor后,未发现TP53INP1表达水平发生显著变化(P>0.05)(见图7)。同样也说明在前脂肪细胞中只有miR-20a对TP53INP1表达有调控作用。
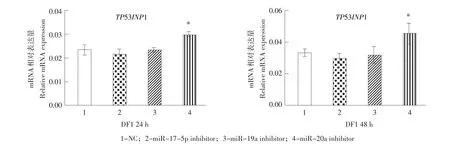
图6 转染miR-17-5p、miR-17-9a和miR-20a的inhibitor对DF1细胞中内源性TP53INP1表达影响Fig.6Effect of miR-17-5p,miR-17-9a and miR-20a inhibitors on relative TP53INP1mRNA expression in DF1 cells
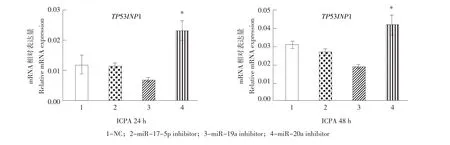
图7 转染miR-17-5p和miR-20a的inhibitor对鸡前脂肪细胞中内源性TP53INP1表达的影响Fig.7Effect of miR-17-5p and miR-20a inhibitors on relative TP53INP1 mRNA expression in ICPA cells
3 讨论与结论
本研究采用生物信息学、报告基因技术证实TP53INP1是miR-17-92基因簇miR-20a的一个靶基因。miR-20a结合位点在人、鼠、鸡等动物TP53INP1基因3'UTR高度保守,推测TP53INP1是miR-17-92基因簇的重要保守靶基因。多个研究支持这一推测[6-14]。
TP53INP1具有抑制细胞增殖,促进细胞凋亡作用。在人体宫颈癌细胞研究中发现,miR-20a/ miR-17-5p靶作用于TP53INP1基因,促进宫颈癌细胞增殖[13-15];在人体胃癌研究中发现,miR-20a/ miR-17-5p靶作用于p21和TP53INP1,从而促进胃癌细胞增殖[6]。农业部鸡遗传育种重点实验室之前研究发现,过表达miR-17-92基因簇促进鸡前脂肪细胞增殖,但机制仍不清楚。本研究证实,miR-17-92基因簇成员miR-20a靶作用于TP53INP1。考虑到miR-17-92基因簇靶基因众多,推测miR-17-92基因簇可能至少部分通过抑制TP53INP1基因表达,从而促进鸡前脂肪细胞增殖。后续将以拯救试验确认miR-20a是否作用于TP53INP1而促进细胞增殖。
与人TP53INP1研究结果不同,发现鸡miR-20a能靶向作用于TP53INP1,但miR-17-5p对TP53INP1并无明显作用。鸡miR-17-5p和miR-20a种子区相同,但miR-17-5p对鸡TP53INP1无明显作用,推测miRNA作为一个反式作用因子,在发挥调控时还需其他蛋白、非编码RNA等参与,在不同细胞中其靶基因并不完全相同[16-17]。
TP53INP1基因是miR-20a的靶基因;抑制其表达,miR-17-92基因簇可能是通过靶向抑制TP53INP1表达,促进鸡脂肪细胞增殖。
[1]Ambros V.MicroRNA:Tiny regulators with great potential[J].Cell, 2001(7):823-826.
[2]Wienholds E,Plasterk R H A.MicroRNA function in animal development[J].Febs Letters,2005,26:5911-5922.
[3]Alvarez-Garcia I,Miska E A.MicroRNA functions in animal development and human disease[J].Development,2005,21:4653-4662.
[4]Lai E C,Tomancak P,Williams R W,et al.Computational identification of Drosophila microRNA genes[J].Genome Biol,2003(7):42.
[5]Lagos-Quintana M,Rauhut R,Meyer J,et al.New microRNAs from mouse and human[J].Rna-a Publication of the Rna Society, 2003(2):175-179.
[6]Wang M,Gu H B,Qian H,et al.miR-17-5p/20a are important markers for gastric cancer and murine double minute 2 participates in their functional regulation[J].European Journal of Cancer,2013(8):2010-2021.
[7]Ventura A,Young A G,Winslow M M,et al.Targeted deletion reveals essential and overlapping functions of the miR-17 similar to 92 family of miRNA clusters[J].Cell,2008(5):875-886.
[8]Diosdado B,van de Wiel M,Droste J S T S,et al.MiR-17-92 cluster is associated with 13q gain and c-myc expression during colorectal adenoma to adenocarcinoma progression[J].British Journal of Cancer,2009(4):707-714.
[9]Zhang C G,Zhu Q L,Zhou Y,et al.N-Succinyl-chitosan nanoparticles coupled with low-density lipoprotein for targeted ostholeloaded delivery to low-density lipoprotein receptor-rich tumors [J].International Journal of Nanomedicine,2014,9(1):2919-2932.
[10]Hilton C,Neville M J,Karpe F.MicroRNAs in adipose tissue:Their role in adipogenesis and obesity[J].International Journal of Obesity,2013(3):325-332.
[11]Yao J,Wang Y,Wang W,et al.Solexa sequencing analysis of chicken pre-adipocyte microRNAs[J].Biosci Biotechnol Biochem,2011(1):54-61.
[12]Okamura S,Arakawa H,Tanaka T,et al.p53DINP1,a p53-inducible gene,regulates p53-dependent apoptosis[J].Mol Cell,2001 (1):85-94.
[13]Tomasini R,Samir A A,Carrier A,et al.TP53INP1s and homeodomain-interacting protein kinase-2(HIPK2)are partners in regulating p53 activity[J].Journal of Biological Chemistry,2003, 39:37722-37729.
[14]Yan X H,Wang Z P,Wang N.Characterization of the structure, function and regulation of the chicken mir-17-92 cluster[J].Zoological Research,2012,33(5):455-462.
[15]Tomasini R,Seux M,Nowak J,et al.TP53INP1 is a novel p73 target gene that induces cell cycle arrest and cell death by modulatingp73transcriptionalactivity[J].Oncogene,2005,55:8093-8104.
[16]Schober A,Nazari-Jahantigh M,Wei Y,et al.MicroRNA-126-5p promotes endothelial proliferation and limits atherosclerosis by suppressing Dlk1[J].Nat Med,2014(4):368-376.
[17]Tan W Q,Li Y,Lim S G,et al.miR-106b-25/miR-17-92 clusters:Polycistrons with oncogenic roles in hepatocellular carcinoma [J].World Journal of Gastroenterology,2014,20:5962-5972.
Identification ofTP53INP1 as a targets gene of chicken miR-20a
The previous studies showed that overexpression of miR-17-92 cluster promoted the chicken preadipocyte proliferation,however,the underlying molecular mechanism remains unclear. Bioinformatics analysis found thatTP53INP1 was a potential target gene of miR-17-5p and miR-20a encoded by the miR-17-92 cluster.In the present study,we verified this bioinformatics analysis result using a luciferase reporter assay and miRNA overexpression and knockdown.The results showed that miR-17-92 cluster significantly decreasedTP53INP1 3ʹUTR luciferase reporter activity;transfection of miR-20a inhibitor significantly decreasedTP53INP1 3ʹUTR luciferase reporter activity.Real-time RT-PCR expression analysis showed that transfection of miR-20a inhibitor increased the endogenousTP53INP1 expression in DF1cells and immortalized chicken preadipocytes.Taken together,these data suggest thatTP53INP1 is a target gene of miR-20a.
chicken;miR-17-92 cluster;preadipocytes;TP53INP1;gene expression
S831;Q786
A
1005-9369(2015)09-0069-06
时间2015-9-23 9:38:13[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150923.0938.018.html
王宁,段逵,宋鹤,等.鸡miR-20a靶基因TP53INP1鉴定[J].东北农业大学学报,2015,46(9):69-74.
Wang Ning,Duan Kui,Song He,et al.Identification ofTP53INP1 as a targets gene of chicken miR-20a[J].Journal of Northeast Agricultural University,2015,46(9):69-74.(in Chinese with English abstract)
2015-04-20
国家自然科学基金项目(31372299);国家863课题(2011AA100301)
王宁(1964-),男,教授,博士,博士生导师,研究方向为动物遗传育种与繁殖。E-mail:wangning@neau.edu.cn
/WANGNing,DUAN Kui,SONG He,ZHANG Xiaofei,ZHANG Tianmu,ZHANG Wenjian,YAN Xiaohong, WANG Shouzhi,LI Hui
(Key Laboratory of Chicken Genetics and Breeding,Ministry of Agriculture, School ofAnimal Sciences and Technology,NortheastAgricultural University,Harbin 150030,China)

