静磁场对猪胰脏脂肪酶催化活性和结构的影响研究
冉景榆, 肖立华
(1.贵州理工学院 化学工程学院, 贵州 贵阳 550003; 2.贵州理工学院 材料与冶金工程学院, 贵州 贵阳 550003;3.贵州省特种功能材料2011协同创新中心, 贵州 贵阳 550003)
静磁场对猪胰脏脂肪酶催化活性和结构的影响研究
冉景榆1,2, 肖立华2,3
(1.贵州理工学院 化学工程学院, 贵州 贵阳 550003; 2.贵州理工学院 材料与冶金工程学院, 贵州 贵阳 550003;3.贵州省特种功能材料2011协同创新中心, 贵州 贵阳 550003)
将来源于猪胰脏的脂肪酶置于0.45 T强度的静磁场中,在不同温度、不同pH值条件下测定脂肪酶的催化活性,并且对米氏常数、酶蛋白二次结构进行测定,探索低成本方法以提高生物酶的催化活性.实验发现,在磁场存在的情况下,磁化2 h后的脂肪酶的催化活性明显提高.脂肪酶的最佳反应温度和最佳pH值没有因为磁化处理而改变.米氏常数Km和酶促反应最大速度Vmax均发生变化,磁化处理后的酶催化效率高于空白对照组.脂肪酶的构象在经过磁场处理后发生明显变化.
脂肪酶; 酶活性; 构象; 磁化处理
0 引言
脂肪酶(甘油酯水解酶,Lipase)主要分布在含有脂肪的动、植物和微生物(如霉菌、细菌等)组织中,可以将甘油三酯水解成甘油和脂肪酸,是广泛应用在化工、食品、制药等领域的主要酶类[14].近年来,为了提高生物酶的催化活性和稳定性,国内外研究人员进行了诸多尝试,主要方法有固定化[5]、高压[6]、微波辐射[7]等.磁场对生物酶的影响也是近年来的热点研究方向,由于易操作、易控制、对环境友好等特点,磁化处理方法一直备受研究人员的青睐.截至目前,已有诸多文献报道了磁场对生物酶活性影响的研究情况,比如过氧化物酶[8]、细胞色素氧化酶[9]等.磁场的选用有多种形式,电磁场、脉冲磁场、超低频磁场等.然而,关于静磁场对生物酶活性影响的研究较少.在我们前期的研究工作中,已经发现静磁场处理也是一种提高生物酶活性,尤其是热稳定性和酸碱稳定性的有效方式[10-12].因此,在本实验中,我们采用0.45 T强度的静磁场对来源于猪胰脏的脂肪酶进行磁化处理,围绕米氏常数、最佳pH值、最佳温度、二次结构等内容,对脂肪酶的催化活性和稳定性进行考察.
1 实验部分
1.1 实验试剂
去离子水(贵州理工学院制备),脂肪酶(生化纯试剂,Sigma公司),聚乙烯醇(天津中奥天元公司),橄榄油.
1.2 实验设备

图1 磁场外形结构
分析天平(Bp121s型,德国Sartorius公司制造),双功能水浴恒温振荡器(SHABA型,金坛市杰瑞尔电器有限公司制造,多头磁力搅拌器(HJ6型,金坛市杰瑞尔电器有限公司制造),圆二色仪(JASCO715型,日本岛津公司制造).
实验用磁场为北京三环国际贸易公司制作的0.45 T强度的钕铁硼永磁场,磁场外形如图1所示.该磁场在环境温度不超过120℃的情况下,能够长时间保持磁场强度不变.
1.3 脂肪酶催化活性的测定
体积比为10%的橄榄油分散于质量分数为3%的聚乙烯醇溶液,快速搅拌30 min,该混合物作为底物用于脂肪酶的催化活性的测定.1 mL的脂肪酶溶液(1.0 mg/mL)加入其中,在40℃下反应10 min,然后将10 mL乙醇加入反应混合物,终止反应.反应所产生的脂肪酸用氢氧化钠溶液进行中和滴定,用酚酞作指示剂.反应式为: RCOOH+NaOH→RCOONa+H2O. 脂肪酶活性的定义,1 mL酶液在一定温度和pH值下,1 min水解底物产生1 μmol的可滴定的脂肪酸,即为1个酶活力单位,以u/mL表示.文中的所有实验结果均为3组平行实验结果的平均值.
1.4 温度的影响
将脂肪酶和经静磁场磁化处理后的脂肪酶分别置于25~70℃的温度下进行催化反应.测其活性数据,并对比各组数据,考察温度对两组脂肪酶的影响.
1.5 pH的影响
分别配制pH值为4.0~9.0的磷酸盐缓冲液,使脂肪酶在不同的pH值条件下参与催化反应,测其催化活性,并对比经过不同预处理情况后的脂肪酶的活性数据,考察不同pH值对脂肪酶的影响.
1.6 米氏常数的测定
首先将底物分别稀释到0.8 mg/mL~1.0 mg/mL,然后取5 mL底物与0.5 mL脂肪酶溶液,在40℃反应2 min,后用10 mL乙醇加入反应混合物,终止反应.用上述方法测定脂肪酶的催化活性,然后通过LinewaverBurk作图法,求出米氏常数Km和酶促反应最大速度Vmax.
1.7 构象变化
对经过磁场预处理的脂肪酶进行其构象的测定.利用紫外圆二色光谱仪进行蛋白质结构分析,以期证明经不同预处理后的脂肪酶的蛋白质结构变化情况.
2 结果与讨论
在不同温度下,经过磁场处理和未经磁场处理的脂肪酶的最佳温度不变,均为40℃,即在40℃条件下,脂肪酶的催化活性最大,如图2所示.在40℃之后,随着温度的逐步升高,脂肪酶的催化活性逐渐减小,这可能是由于温度较高时,酶的结构被高温所破坏,从而导致脂肪酶的催化活性降低.但是同空白对照组相比,经过磁场处理后的脂肪酶在同一温度下表现出更高的活性.
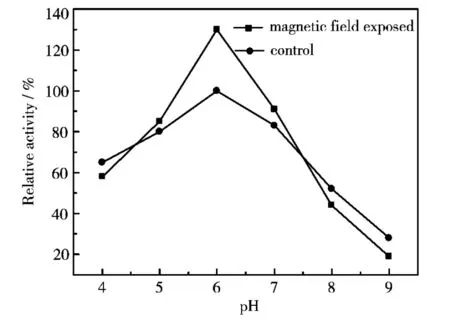
图3 不同pH值条件下的脂肪酶的催化活性

图4 不同磁化处理时间的脂肪酶的催化活性
在不同pH值条件下,磁场处理和未经磁场处理的脂肪酶的最佳pH值不变,均为6.0,即在pH值为6.0的条件下,脂肪酶的催化活性最大,如图3所示.在pH值较小或较大时,酶活性均受到抑制,从图中可看到,偏酸性环境有利于脂肪酶活性的发挥.同空白对照组相比,经过磁场处理后的脂肪酶活性在pH值达到6.0之前迅速增加,然后在pH值达到6.0之后迅速减小.这说明经过磁化处理后的脂肪酶活性对酸碱环境的变化表现得更为敏感.
经过不同时间磁化处理的脂肪酶活性如图4所示.经磁化处理后的脂肪酶活性明显高于未经磁化处理的脂肪酶,在磁化时间2 h时,磁化后的脂肪酶活性高于空白对照组49%.随着脂肪酶放置时间的延长,两组酶的活性在减小,但磁化处理后的脂肪酶活性减小得较为缓慢.这说明经过磁化处理的生物酶,在常温下可以得到较长时间的保存.
米氏常数的测定结果如表1所示.米氏常数的变化不明显,但酶促反应的最大速度发生较明显的变化.我们定义“酶促反应的最大速度”与“米氏常数”的比值为酶的“催化效率”.从表中可知磁化处理后的脂肪酶的催化效率明显高于空白对照组,催化效率高出近2倍.

表1 米氏常数测定结果
脂肪酶的蛋白质结构如图5(a)和图5(b)所示,由于生物酶的蛋白质结构和其催化活性密切相关,我们利用紫外圆二色光谱仪对脂肪酶蛋白质结构进行分析,以摩尔椭圆度为纵坐标,以波长为横坐标作图.同空白对照组相比,磁化处理后的脂肪酶在不同波长下,峰值的正负情况发生明显变化,比如在202 nm处,负峰值变成了正峰值.这说明脂肪酶的蛋白质结构经磁化处理后发生了变化,从而找到了脂肪酶催化活性经磁化处理后发生变化的理论依据.
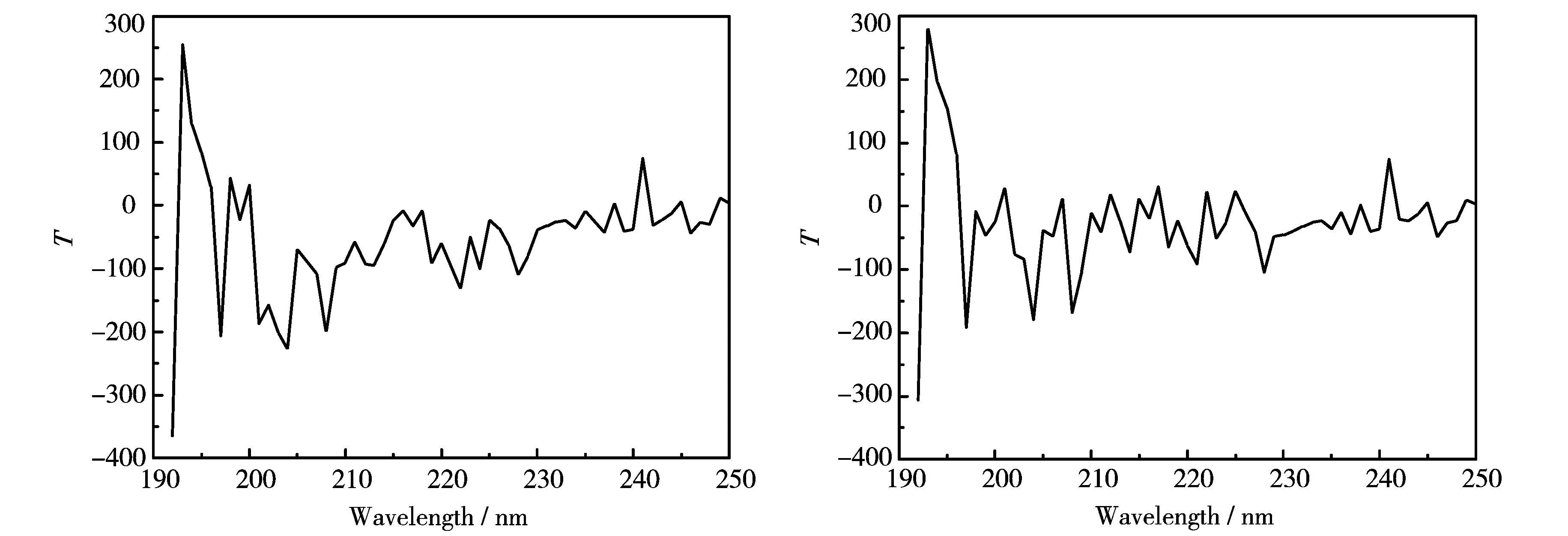
(a)未经磁化处理 (b)经磁化处理
3 结论与展望
将来源于猪胰脏的脂肪酶,经过0.45 T静磁场的磁化处理,与未经过磁化处理的脂肪酶(空白对照组)相比,最佳温度和最佳pH值均不变,但相同温度下的酶活性明显增大,对于酸碱环境的敏感性增强,催化效率发生显著变化.通过紫外圆二色光谱仪对脂肪酶的蛋白质结构进行检测发现,酶的构象发生了变化.由于酶的结构与其活性密切相关. 因此,我们认为简单的静磁场作用就可以改变生物酶的结构,从而影响其活性.由于脂肪酶广泛应用于工业生产中,利用环境友好且无污染的静磁场进行磁化预处理,对提高酶的催化活性和稳定性具有一定的现实意义.
[1]Schmid R D, Verger R. Lipases: interfacial enzymes with attractive applications[J]. Angew Chem Int Ed, 1998, 37(12): 1609-1633.
[2]Gupta R, Gupta N, Rathi P. Bacterial lipases: an overview of production, purification and biochemical properties[J]. Appl Microbiol Biotechnol, 2004, 64(6):763-781.
[3]Ong A L, Kamaruddin A H, Bhatia S, et al. Performance of free Candida antarctica lipase B in the enantioselective esterification of ketoprofen[J]. Enzyme Microb Technol, 2006, 39(4): 924-929.
[4]Chang S W, Shaw J F, Yang K H, et al.Studies of optimum conditions for covalent immobilization of Candida rugosa lipase on poly(gammaglutamic acid)by RSM[J]. Bioresour Technol, 2008, 99(8): 2800-2805.
[5]Ramani K, Lourdusamy J K, Chandran V, et al. Immobilization of acidic lipase derived from Pseudomonas gessardii onto mesoporous activated carbon for the hydrolysis of olive[J]. J Mol Catal B: Enzym, 2010, 62(1):58-65.
[6]Rezaei K, Temelli F. Lipase catalyzed hydrolysis of canola oil in supercritical CO2[J]. J Am Oil Chem Soc, 2000, 77 (8): 903-909.
[7]Yadav G D, Borkar I V. Kinetic and mechanistic investigation of microwaveassisted lipase catalyzed synthesis of citronellyl acetate[J]. Ind Eng Chem Res, 2009, 48 (17):7915-7922.
[8]Portaccio M, De Luca P, Durante D. In vitro studies of the influence of ELF electromagnetic fields on the activity of soluble and insoluble peroxidase[J]. Bioelectromagnetics, 2003, 24(7): 449-456.
[9]Blank M, Soo L. Enhancement of cytochrome oxidase activity in 60 Hz magnetic fields[J]. Bioelectrochem Bioenerg, 1998, 45(2):253-259.
[10]Ran J Y, Jia S Y, Liu Y, et al. Characterization of cellulase under various intensities of static magnetic fields[J]. Catal Commun, 2009, 11(2):91-95.
[11]Liu Y, Jia S Y, Ran J Y, et al. Effects of static magnetic field on activity and stability of immobilized amylase in chitosan bead[J]. Catal Commun, 2010, 11(5):364-367.
[12]Liu Y, Jia S Y, Wu Q, et al. Studies of Fe3O4chitosan nanoparticles prepared by coprecipitation under the magnetic field for lipase immobilization[J]. Catal Commun, 2011, 12(8):717-720.
[责任编辑:蒋海龙]
InfluenceofStaticMagneticFieldontheCatalyticActivityandStructureofLipasefromPorcinePancreas
RAN Jing-yu1,2, XIAO Li-hua2,3
(1.School of Chemical Engineering, Guizhou Institute of Technology, Guiyang Guizhou 550003, China)
(2.School of Materials and Metallurgical Engineering, Guizhou Institute of Technology, Guiyang Guizhou 550003, China)
(3.Guizhou Collaborative Innovation Center for Special Functional Materials 2011, Guiyang Guizhou 550003, China)
It was highly interest to tune the catalytic activity of enzymes in a convenient and low cost means. Herein, lipase was studied in the presence and absence of a 0.45 T static magnetic field. Enzymatic activities at varied exposure time, pH and temperature were assessed, together with the kinetic parameters of the catalysis and the secondary conformation. In the presence of the static magnetic field, the optimal exposure time is 2 h at which enhanced activity was observed while the optimal pH and temperature forthe catalytic reaction are unchanged. The Kmdecreased and Vmaxalso increased. Such behavior could be explained by the slight structure change induced by the magnetic field as revealed by circular dichroism.
lipase; enzymatic activity; conformation; magnetization treatment
2015-04-16
贵州省科学技术联合基金重点项目(黔科合LH字[2014]7357号); 贵州省科学技术基金计划项目(黔科合J字[2014]2086号); 贵州理工学院博士基金资助项目(XJGC20140604)
冉景榆(1986-),男,土家族,重庆酉阳人,讲师,博士研究生,研究方向为酶工程. E-mail: 799645857@qq.com
TS201.2
: A
: 1671-6876(2015)02-0117-04

