常用非甾体抗炎药对成骨细胞增殖和骨形成蛋白的影响
陈坚,屠永刚,李善文,张佩
(1.东莞市常平医院,广东 523560;2.中山市古镇人民医院,广东 528421;3.南方医科大学中医药学院,510515)
常用非甾体抗炎药对成骨细胞增殖和骨形成蛋白的影响
陈坚1,屠永刚1,李善文2,张佩3
(1.东莞市常平医院,广东523560;2.中山市古镇人民医院,广东528421;3.南方医科大学中医药学院,510515)
目的观察几种临床常用非甾体抗炎药含药血清对人成骨细胞增殖和骨形成蛋白表达的影响,为临床用药提供实验依据。方法选取临床常用的非甾体抗炎药(阿司匹林、布洛芬、双氯芬酸钠、美洛昔康、尼美舒利、塞来昔布)及生理盐水,按照人-动物体表面积换算剂量,予大鼠连续灌胃5次,第5次结束后1h采集大鼠血液制备含药血清。以强直性脊柱炎患者全髋置换术中股骨松质骨分离得到的成骨细胞为研究对象,实验分为含药血清组和空白血清组。采用碱性磷酸酶染色和茜素红染色来鉴定细胞,采用CCK-8法检测各组血清对人成骨细胞增殖的影响及酶联免疫法检测对骨形成蛋白2的表达。结果浓度为20%的含药血清可能会抑制成骨细胞的增殖,10%的含药血清相对来说细胞的效应最稳定;对细胞骨形态发生蛋白2生成的影响方面,双氯芬酸钠组、美洛昔康片组、塞来昔布胶囊组较对照组平均值低,其中双氯芬酸钠组与对照组相比差异有统计学意义。结论 几种非甾体抗炎药对成骨细胞的增殖和骨形成蛋白表达的影响不一,其中双氯芬酸钠的抑制效果较明显,其治疗强直性脊柱炎的机制可能与影响了骨形成蛋白有关。
非甾体抗炎药;成骨细胞;增殖;骨形成蛋白/骨形态发生蛋白2
强直性脊柱炎(Ankylosing Spondylitis,AS)是一种病因尚未阐明以骶髂关节和脊柱慢性炎症为主的全身性疾病,其特征性病理表现为肌腱、韧带附着点炎症,常见症状为腰背部的僵硬或疼痛,休息无改善,活动后可以缓解;晚期可发生脊柱强直、畸形以至严重的功能受损。其一线用药包含非甾体类抗炎药(Non-Steroidal Anti-Inflammatory drugs,NSAIDs),目前有研究发现,长期服用此类药物能抑制AS的新骨形成,延缓病情发展[1],但随之也会带来胃肠道、心血管等方面的不良反应及治疗的经济负担[2]。如何选择非甾体类抗炎药以达到长久、安全的防治效果,是目前亟需解决的难题。哪种药物效果更佳,以及不同剂量效果是否存在差异,目前相关研究较少。为此,本实验拟通过血清药理学的方法对比观察几种常见非甾体抗炎药对成骨细胞骨形态发生蛋白的影响,为临床选药提供实验依据。
1 材料与方法
1.1材料
1.1.1常用的非甾体类抗炎药A.阿司匹林肠溶片(拜阿司匹灵),B.布洛芬胶囊(芬必得),C.双氯芬酸钠(扶他林),D.美洛昔康片(莫比可),E.尼美舒利片(灵泰帮尼),F.塞来昔布胶囊(西乐葆),均购于本院西药房。
1.1.2主要试剂优质南美胎牛血清(Gibco);α-MEM培养基(Gibco);DMEM-F12、0.25%胰酶(Hyclone);Ⅱ型胶原酶、β-甘油磷酸钠、抗坏血酸磷酸盐、地塞米松、茜素红(Sigma);青-链霉素液、PBS(广州天骏生物科技有限公司);碱性磷酸酶测试盒(南京建成科技有限有限公司);BCIP/NBT碱性磷酸酯酶显色试剂盒(碧云天生物技术公司);CCK-8检测试剂盒(日本同仁化学研究所);人骨形成蛋白-2酶联免疫分析试剂盒(广州昂科生物技术有限公司)。1.1.3动物SD(Sprague-Dawley)系清洁级雄性大鼠28只,体重250~300 g,普通饲养环境,分7组:A组、B组、C组、D组、E组、F组、对照组G(生理盐水组),每组4只。大鼠由南方医科大学动物实验中心提供(许可证号:SCXK(粤)2011-0015)。
1.2骨组织标本来源从广州中医药大学第一附属医院及本院收集骨组织标本(经患者及我院伦理委员会同意,由主刀医师手术取材),病例为强直性脊柱炎患者,按1984年的纽约诊断标准明确诊断,患者手术前2个月未曾服用过抗骨质疏松药物、非甾体类抗炎药物、糖皮质激素类及肿瘤坏死因子拮抗剂等影响骨代谢的药物,现实施全髋置换术,取出的股骨头松质骨立即进入加有双抗的DMEM-F12培养液中备用。
1.3含药血清的制备28只SD大鼠随机分成7组,不同的药物按照人-动物体表换算给药,每天分2次灌胃,1 mL/次,对照组予相同量的生理盐水。第5次灌胃完1 h后,所有大鼠麻醉,腹主动脉取血,血液4℃静置2 h,3000 r/min离心15 min,吸取上清,各组混匀。所收集的血清于56℃灭活30 min,保存于-80℃,备用。
1.4实验方法
1.4.1人成骨细胞的分离与培养通过改良Pamela方法[3]:取出无菌松质骨组织,用剪刀去除表面的软组织,PBS冲洗3遍至骨质发白。剪成1 mm× 1 mm×1 mm的骨块,用PBS冲净残留的血迹,平铺在培养皿中加入0.25%胰酶,37℃孵箱消化30 min。血清终止消化,去胰酶后加入0.1%Ⅱ型胶原酶,37℃孵箱消化3 h。取上层消化液离心留细胞加入20%完全培养液(20%小牛血清+DMEM-F12+双抗)重悬细胞,接种于培养皿内;骨块也同样加入全培,置于37℃、含体积分数5%CO2的培养箱中培养,每3 d换液1次。骨块约15 d后逐渐有细胞爬出。细胞汇合铺满80%后使用胰酶消化,1:3传代培养,换10%完全培养基培养细胞,实验采用第3~5代细胞。
1.4.2成骨细胞形态观察倒置相差显微镜下观察细胞的形态生长状态,并在合适条件下加入骨诱导剂(10 mmol/mlβ-甘油磷酸钠,50μmol/m l抗坏血酸磷酸盐,0.1μmol/ml地塞米松)。
1.4.3成骨细胞的鉴定取2-3代生长良好的细胞,经胰酶消化后,用含10%胎牛血清的α-MEM培养基重悬,接种于6孔板中,3 d后按照碱性磷酸酯酶试剂盒说明进行染色。另取细胞用含骨诱导剂的条件培养液培养,21 d后,进行茜素红染色。染色后,蒸馏水冲洗,自然风干。低倍镜下观察矿化结节。
1.5观察指标
1.5.1细胞增殖的检测取2-3代生长良好的细胞,经胰酶消化后,镜检计数后,用含10%胎牛血清的α-MEM培养基重悬,接种于96孔板中,每孔100 μl。24 h细胞贴壁后,弃原培养液,换无血清培养液培养24 h,弃无血清培养液,依次分别加入不同浓度(5%、10%、20%)的各组含药血清,每孔200μl,每个剂量均设10个复孔,分别培养24 h、48 h、72 h后,按CCK-8试剂盒说明书进行操作,于酶联免疫检测仪450 nm波长处,测定光密度殖(OD)。
1.5.2骨形成蛋白2(BMP-2)含量的测定取第3代生长良好的细胞,经胰酶消化后,用含10%胎牛血清的α-MEM培养基重悬,接种于6孔板中,每孔2 ml,24 h后更换为含10%各组血清培养,于培养的第3天收集上清,按照ELISA试剂盒操作说明进行检测。1.6统计学方法计量数据采用SPSS 19.0软件处理,组间比较应用ONE-Way ANOVA进行方差分析,两两间比较采用配对样本t检验,多因素间比较应用析因设计方差分析,方差齐时两两比较用SNK法,方差不齐时用Dunnett’s T3。数据以(±s) 表示,P<0.05为差异有统计学意义。
2 结果
2.1成骨细胞鉴定倒置相差显微镜下,15 d左右骨块周围开始有细胞爬出,成长梭形,加入成骨诱导剂后细胞形态开始变得不规则,呈短梭形、三角形或多边形。碱性磷酸酶染色,显微镜下观可见大量染色呈阳性的细胞出现,细胞胞浆中分布特征性的蓝紫色细颗粒。成骨细胞钙结节在镜下可见部分细胞聚集呈“集落生长”,21 d后茜素红染色呈红色(见图1~5)。
2.2不同浓度的不同药物对成骨细胞增殖的影响
如图6~7和表1结果所示,除了A组药物,其他几组药物当浓度为5%和10%时,吸光度OD值逐渐增加,其中D组较明显与5%浓度相比差异有统计学意义(P<0.05);浓度为20%时,吸光度OD值开始下降,其中D组和F组较明显,与10%浓度相比差异具有统计学意义(P<0.05),表现为对细胞增殖的抑制作用增强。10%浓度的各种药物的含药血清相对来说细胞的效应最稳定。
表1 不同药物含药血清对成骨细胞增殖的影响(±s)
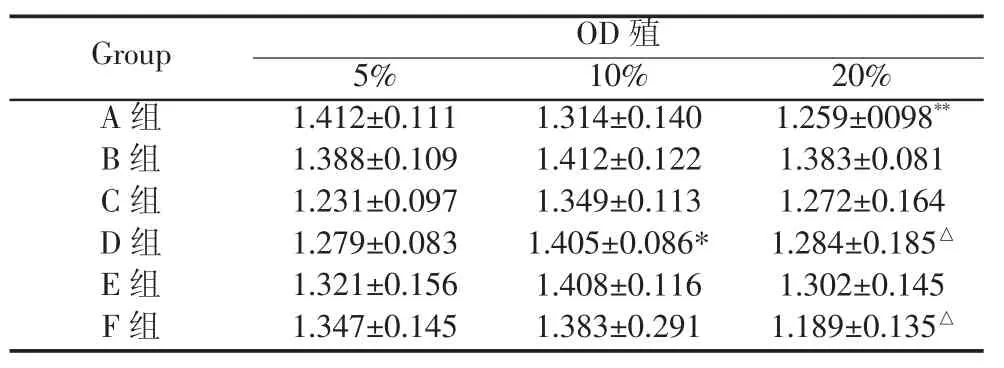
表1 不同药物含药血清对成骨细胞增殖的影响(±s)
注:**与5%组相比P<0.01;*与5%组相比P<0.05;△与10%组相比P<0.05。
Group OD殖5% 10% 20% A组 1.412±0.111 1.314±0.140 1.259±0098**B组 1.388±0.109 1.412±0.122 1.383±0.081 C组 1.231±0.097 1.349±0.113 1.272±0.164 D组 1.279±0.083 1.405±0.086* 1.284±0.185△E组 1.321±0.156 1.408±0.116 1.302±0.145 F组 1.347±0.145 1.383±0.291 1.189±0.135△
2.3不同药物含药血清对成骨细胞骨形态发生蛋白2的影响
用10%药物含药血清处理细胞3 d后,不同药物对BMP-2表达量的影响不同:A、B、E组较对照组平均值高,C、D、F组较对照组平均殖低;其中只有A、C(P<0.01)、E(P<0.05)组与对照组的差异有统计学意义,提示C组药物可能有抑制骨形成蛋白表达的功能。
3 讨论
AS是脊柱关节病中一种潜在高致残类型,其患病率在各国报道不一,波动在0.2%~1.4%[4],严重影响着患者的工作、学习和生活质量,给社会和家庭带来沉重的负担。NSAIDs能够迅速改善患者腰背部疼痛和发僵,减轻关节肿胀和疼痛及增加活动范围,是AS治疗的一线用药[5,6]。据统计全球约5亿人在服用NSAIDs[7],但长期应用不良反应发生率的增高又限制了其应用。有文献[2]报告长期服用保泰松、塞来昔布等对脊柱结构性破坏有防治作用,能延缓骨化。其机理可能是:COX-2受抑后,地诺前列酮降低,一方面会导致DKK-1上调,Wnt/β-caten in信号通路受抑,从而使骨保护素生产减少;另一方面会抑制BMP,抑制成骨过程[8]。但是哪种抑制成骨作用最强,还没有文献专门对NSAIDs各种药物进行对比性研究。本实验以此为目的,以期为临床选药提供依据。
NSAIDs是一大类非皮质激素结构类似,具有解热、镇痛、抗炎和抗风湿作用的药物[9]。作者在实验前大量总结文献发现,NSAIDs对骨代谢产生影响的机制可能为:抗炎机制,对体内一些生物因子产生了作用,如前列腺素[10-12],从而改变了成骨细胞和破骨细胞的代谢;干扰血管的再生过程及某些骨形成通路[13]。其中前列腺素能通过加速成骨细胞的增殖和分化来刺激新骨形成,还能通过扩张血管和促进血管再生来为骨折端提供血液供应,而且这种影响主要是通过前列腺素E受体的2型和4型(EP2 和EP4)来介导的[14]。有研究发现NSAIDs可通过抑制COX-2的表达,阻止PG合成,从而抑制MSCs的游走、分化、增殖,阻断其向成骨细胞分化[15]。还有实验显示药物可能会影响软骨细胞形成和软骨内化骨,从而促进成骨细胞的活性和骨形成[16]。骨形成蛋白(Bone Morphogenetic Protein,BMPs)是转化生长因子β(transforming growth factorβ,TGF-β)超家族的一员,是一种多功能生长因子,主要位于骨髓基质细胞、骨膜细胞和骨细胞内,BMP具有诱导成骨与促进成骨细胞分化的能力,其表达水平与骨形成活跃程度相关[17]。成骨细胞在骨代谢过程中发挥重要作用,其体外培养技术的成功使骨代谢的研究进入细胞阶段,人成骨细胞体外培养技术起始于20世纪80年代初期[18],主要来源为新生儿颅骨和成人松质骨。血清药理学由日本田代真一在1984年提出,其能客观模拟药物与机体相互作用的过程,克服药物本身理化性质对实验的影响,使用这种方法对成骨细胞进行的实验研究,国内外文献均有报道[19]。
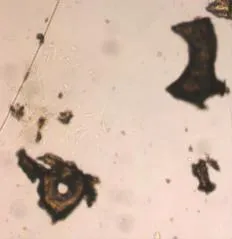
图1 骨块周围有细胞爬出
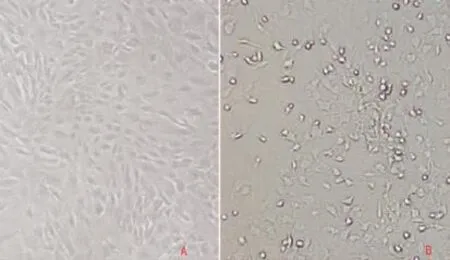
图2 加入成骨诱导剂前(A)后(B)细胞形态(×100)

图3 成骨细胞ALP染色成蓝色(×400)
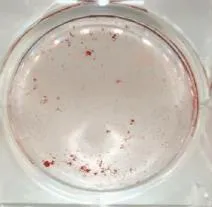
图4 钙结节茜素红染色大体图

图5 钙结节茜素红染色(×100)
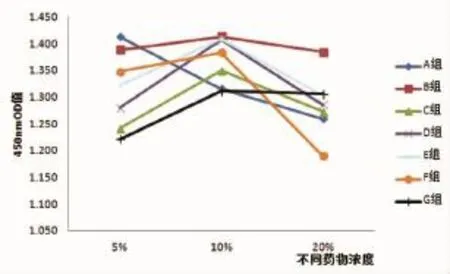
图 6 不同浓度的药物含药血清对成骨细胞增殖的影响
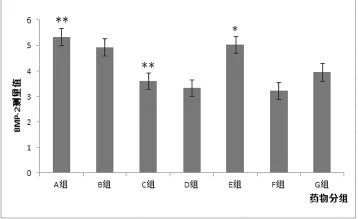
图7 不同药物对成骨细胞骨形成蛋白的影响
本实验通过血清药理学的方法来对比观察几种常见非甾体抗炎药对成骨细胞骨形态发生蛋白的影响。选取临床常用的非甾体抗炎药(阿司匹林、布洛芬、双氯芬酸钠、美洛昔康、尼美舒利、塞来昔布)及生理盐水,按照人-动物体表面积换算剂量,予大鼠连续灌胃5次,第5次结束后1h采集大鼠血液制备含药血清。以强直性脊柱炎患者全髋置换术中股骨松质骨分离得到的成骨细胞为研究对象,实验分为含药血清组和空白血清组。采用碱性磷酸酶染色和茜素红染色来鉴定细胞,采用CCK-8法检测各组血清对人成骨细胞增殖的影响及酶联免疫法测对骨形成蛋白2的表达。结果显示其随着浓度的增加先增加后抑制,20%浓度时药物抑制现象明显,因此后面的实验适宜浓度定为10%。为对比观察不同药物对成骨细胞的影响,本实验选择酶联免疫法测骨形成蛋白2的表达。实验结果显示,阿司匹林、布洛芬、尼美舒利组较对照组平均值高,双氯芬酸、美洛昔康、塞来昔布组较对照组平均值低,其中双氯芬酸钠组较空白组比较差异有统计学意义,表明其能抑制BMP-2的生成,可能是其动物实验或临床发挥作用的机制之一。Krischak等人[20]的动物实验显示双氯芬酸钠可以减少成骨细胞的数量,降低骨密度,延缓骨愈合。与本实验的结果相似。但是缺少临床实验。美洛昔康、塞来昔布较对照组无显著性差异,意味着对BMP-2的效果类似,同李国青等人[21]对比,尼美舒利、美洛昔康及塞来昔布三种NSAIDs对活动期AS患者疼痛缓解率及临床疗效的结果相似,无显著性差异(P>0.05)。
然而,本实验作为一项探索性实验,只纳入了AS患者的细胞,采用的是血清药理学研究,缺少正常细胞对照组、干扰因素多,在后续的研究中,将进一步扩大实验细胞种类、改善给药方式,进行深入研究。且需进行临床对比观察实验,但临床上患者的依从性很难把握,观察周期长,借助人的细胞实验结果来指导临床的可行性更大。本实验结果提示双氯芬酸钠的抑制效果较其他几种药物明显,其治疗强直性脊柱炎的机制可能与影响了骨形成蛋白表达有关,但临床个体差异较大,在有效安全的前提下可参照选药。
[1] WandersA,HeijdeD,LandeweR,etal.Nonsteroidal antiinflammatorydrugsreduceradiographicprogressionin patients with ankylosing spondylitis:a randomized clinical trial [J].Arthritis Rheum,2005,52(6):1756-1765.
[2]刘蕊,刘湘源.NSAID治疗强直性脊柱炎应按需用还是持续用[J].新医学,2011,42(3):196-198.
[3] Robey PG,Termine JD.Human bone cells In vitro[J].Calcif Tissue Int,1985,37(5):453-560.
[4]黄烽.应重视非甾体抗炎药对早期强直性脊柱炎的治疗价值[J].中国药物应用与监测,2006,3(6):1-4.
[5]邢帅,高延征,高坤,等.非甾体类抗炎药治疗强直性脊柱炎的研究现状及展望[J].风湿病与关节炎,2015,4(3):60-63,68.
[6]王一荃,汪悦.强直性脊柱炎中西医结合治疗进展[J].湖南中医杂志,2013,29(10):151-153.
[7]王聪颖,许叶.非甾体抗炎药的研究进展[J].北方药学,2011,8 (9):34-36.
[8]Diarra D,Stolna M,Polzer K,et al.Dickkopf1 is a master regulator of joint rem odeling[J].Nat Med,2007,13(2):156-163.
[9] Vane JR.The fight against rheumatism:from willow bark to COX-1 sparing drugs[J].JPhysiol Pharmacol,2000,51(4 Pt 1):573-586.
[10]王振刚.非甾体抗炎药治疗强直性脊柱炎的再认识 [J].中国医刊,2013,48(7):1-3.
[11]周凯,曾伟南,周宗科.依托芬那酯凝胶联合布洛芬缓释胶囊与两者独用治疗膝骨关节炎的前瞻性随机对照临床试验 [J].中华关节外科杂志(电子版),2014,8(5):598-603.
[12]古洁若.应关注强直性脊柱炎诊治研究的热点[J].新医学,2011,42(3):141-143.
[13]陈坚,李义凯,张佩.非甾体类抗炎药物对骨折愈合影响的研究进展[J].中国药物经济学,2014(S2):1-3.
[14]Radi Z A,Khan N K.Effects of cyclooxygenase inhibition on bone,tendon,and ligament healing[J].Inflamm Res,2005,54(9):358-366.
[15]Wittenberg R H,Peschke U,Botel U.Heterotopic ossification after spinal cord injury.Epidemiology and risk factors[J].JBone Joint Surg(Br),1992,74(2):215-218.
[16]Blackwell KA,Raisz LG,PilbeamCC.Prostaglandins in bone:bad cop,good cop[J].Trends Endocrinol Metab,2010,21(5):294-301.
[17]Toom A,Arend A,Gunnarsson D,et al.Bone formation zones in heterotopicossifications:histologicfindingsandincreased expression of bone morphogenetic protein 2 and transforming growth factors beta2 and beta3[J].Calcif Tissue Int,2007,80(4):259-267.
[18]郭海玲,赵咏芳,王翔.淫羊藿苷对人成骨细胞增殖及OPG蛋白表达的实验研究[J].中国骨伤,2011,24(07):585.
[19]张晓玮,郑洪新,林庶茹,等.补肾中药血清对成骨细胞中骨形态发生蛋白2、7活性的影响[J].中国组织工程研究与临床康复,2011(28):5253-5257.
[20]Krischak GD,Augat P,Blakytny R,et al.The non-steroidal anti-inflammatorydrugdiclofenacreducesappearanceof osteoblasts in bone defect healing in rats[J].Arch Orthop Trauma Surg,2007,127(6):453-458.
[21]李国青,张育,顾健.三种NSAIDS对活动期强直性脊柱炎患者疼痛的疗效及安全性评价[J].中国疼痛医学杂志,2007,13(3):133-136.
The influence of commonly used non-steroidal anti-inflammatory drug on osteoblast cell proliferation and bone morphogenetic protein
CHEN Jian1,TU Yong-gang1,LI Shan-wen2,ZHANG Pei3
(1.Changping Hospital,Dongguan,Guangdong 523560,China;2.Guzhen People's Hospital,Zhongshan,Guangdong 528421,China;3.TCM College,Southern Medical University,Guangzhou,Guangdong 510515,China)
ObjectiveTo investigate the influence of clinical commonly used several nonsteroidal anti-inflammatory drug-containing serum on osteoblast proliferation and bone morphogenetic protein expression,and to provide experimental evidence for clinical practice.M ethods To select commonly usednon-steroidal anti-inflammatory drugs in clinical(aspirin,ibuprofen,diclofenac,meloxicam,nimesulide,celecoxib)and saline,according to the human-animal body surface area dose,to fed rats five times in a row,after 1 hour of the fifth to collect rat blood serum.Osteoblasts for the study came from femoral cancellous bone of total hip arthroplasty in patients with ankylosing spondylitis,they were divided into groups containing serum and blank serum.Alkaline phosphatase staining and alizarin red staining were used to identify the cells.The osteoblast cell proliferation was detected by CCK-8 assay.Enzyme-linked immunoassay was used to detect the expression of bone morphogenetic protein 2.ResultsConcentration of 20%of the drug-containing serum inhibited osteoblast cell proliferation,the effect of 10% serum containing was relatively most stable.Production of bone morphogenetic protein-2 was lower in diclofenac group,meloxicamtablets group,celecoxib group than the control group,and the difference between diclofenac group and control group was statistically significant.ConclusionThe influences of clinical commonly used several non-steroidal anti-inflam-matory on osteoblast proliferation and bone morphogenetic protein expression were different,the inhibitory effect of diclofenac sodium was the most obvious.The treatment mechanism of ankylosing spondylitis may be related with its affecting bone formation proteins.
non-steroidal anti-inflammatory drug;osteoblast cell;proliferation;bone morphogenetic protein/BMP-2
R971.91
A
1005-7234(2015)06-0459-05 DIO:10.3969/j.issn.1005-7234.2015.06.005
2015-08-17;
2015-09-17
广东省东莞市科技局立项课题,编号:20131051010208
陈坚(1964-),男,江西籍,副主任医师
研究方向:创伤骨科,脊柱外科
屠永刚
电话:15899631143
电子邮箱:94665961@qq.com

