C-myc、PTEN、p33/ING1和P-gp/MDR1在食管鳞状细胞癌中的表达和意义
冷雪芹 贾慧琼 陈文霞 李慧娥 曹春莉 苏秉忠
·论著·
C-myc、PTEN、p33/ING1和P-gp/MDR1在食管鳞状细胞癌中的表达和意义
冷雪芹1贾慧琼1陈文霞2李慧娥2曹春莉1苏秉忠1
目的研究C-myc、PTEN、p33/ING1和P-gp/MDR1在食管鳞癌中的表达与临床病理特点的关系。方法采用荧光定量PCR法检测60例食管鳞癌患者的食管鳞癌组织、癌旁组织和正常食管组织中c-myc、PTEN、p33/ING1和P-gp/MDR1的表达水平。分析它们在食管鳞癌浸润、分化、转移时表达的差异性及其相关性。结果C-myc和P-gp/MDR1在正常食管组织、癌旁组织、食管鳞癌组织中的表达逐渐升高(P<0.05)。PTEN和p33/ING1在正常食管组织、癌旁组织、食管鳞癌组织中的表达逐渐降低(P<0.05)。C-myc在有淋巴结转移、低分化、浸润深的食管鳞癌组织中的表达高,差异有统计学意义(P<0.05)。PTEN和p33/ING1在有淋巴结转移、低分化、浸润深的食管鳞癌组织中的表达低,差异有统计学意义(P<0.05)。P-gp/MDR1的阳性表达与食管鳞癌组织的分化程度、浸润深度、有无淋巴结转移差异无统计学意义(P>0.05)。结论C-myc和PTEN的协同作用共同参与了食管鳞癌的发展、浸润和转移。联合检测癌基因c-myc、抑癌基因PTEN,p33/ING1和P-gp/MDR1基因在食管鳞癌组织中的表达可能为临床诊断病情发展程度、化疗治疗疗效、预后等提供指导意义。
食管鳞状细胞癌;c-myc;PTEN;p33/ING1;P-gp/MDR1
食管癌是严重损害人类健康的癌症之一,有研究发现,原癌基因的激活、抑癌基因的失活、细胞凋亡调控基因的失调及肿瘤对化疗药物产生耐药是许多肿瘤的发生机制及联合化疗失败的主要原因之一。本研究通过联合检测癌基因c-myc、PTEN、抑癌基因p33/ING1和P-gp/MDR1在食管鳞癌手术切除标本的癌灶、癌旁组织和正常食管黏膜中的表达,对其分级分化转移的相关性进行研究,并探讨它们相互之间的关系及作用机制,以期寻求食管鳞癌癌变过程的重要分子靶点,从而为食管鳞癌在基因水平的诊断和治疗提供思路。
材料和方法
一、实验标本
选择内蒙古医学院第一附属医院2010年8月至2011年6月期间的胸外科食管鳞癌手术后大体标本60例,全部患者术前均未行放疗、化疗等治疗,其中男性50例,女性10例,年龄在41~75岁,平均59.87岁,每例标本分别在癌组织、癌旁食管组织(距离癌肿组织边缘3 cm以内)及正常食管组织(距离癌肿组织边缘5 cm以外)分别取材。依据术后病理回报判断食管鳞癌分化程度及浸润深度,依据术后清扫的淋巴结病理回报来判断是否有淋巴结转移。其中淋巴结转移者32例,淋巴结未转移者28例,分化程度:高分化23例,中分化20例,低分化17例。浸润深度:浅层组(癌组织限于黏膜层或黏膜下层或浅肌层)14例,深层组(癌组织侵及深肌层或外膜层)46例。
二、主要试剂
Trizal试剂盒,上海生工生产。PrimeScriptRRT reagent Kit With gDNA Ereser(PerfectReal Time)试剂盒和SYBRRPremix Ex TaqTMII(Perfect Real Time)荧光定量均由宝生物工程(大连)有限公司生产。
三、方法
1.提取总RNA。
2.测定RNA纯度和含量。
3.合成cDNA。
4.PCR扩增。
5.PCR产物的凝胶电泳和扫描。
6.荧光定量PCR检测C-myc、PTEN、p33/ ING1和P-gp/MDR1基因表达。
7.记录结果
每份标本以C-myc、PTEN、p33/ING1和P-gp/ MDR1基因和内参基因各重复3孔,求出3复孔检测循环阈值(Ct)的平均值,最后用2-△Ct=2-(Ct目的基因-Ct内参基因)作为评价C-myc、PTEN、p33/ING1和P-gp/MDR1基因表达水平指标,同时做空白孔对照,质控监测,保证试验准确性。
四、统计学处理
用SPSS 17.0软件对所得数据进行统计学处理,免疫组化所得结果为计数资料,采用χ2检验;荧光定量PCR结果为计量资料,采用t检验和方差分析进行统计;相关性检验用Pearson列联系数相关分析,P<0.05为差异有统计学意义。
结果
一、c-myc、PTEN、p33/ING1和P-gp/MDR1 mRNA在食管正常组织、癌旁组织和食管鳞癌组织中的表达水平及与食管鳞癌临床病理参数的关系见表1、2。
二、c-myc、PTEN、p33/ING1和P-gp/MDR1 mRNA在食管正常组织、癌旁组织和食管鳞癌组织中的表达见图1-8。
三、食管鳞癌组织中c-myc、PTEN、p33/ING1和P-gp/MDR1表达的相关性
食管鳞癌组织Pearson相关性分析c-myc与PTEN基因呈负相关表达(r=-0.306,P<0.05);P-gp/ MDR1与P33/ING1基因表达呈负相关(r=-0.309,P<0.05)。
讨论
研究发现,食管鳞癌的发生、发展是多种癌基因的激活[1-3]、抑癌基因的抑制或缺失共同作用[4]的结果,肿瘤多药耐药性(MDR)是肿瘤化疗失败的最大障碍。本研究通过分析癌基因c-myc、抑癌基因PTEN、抑癌基因p33/ING1和P-gp/MDR1在食管鳞癌患者各种临床病理特征中表达的相互关系,探讨癌基因c-myc、抑癌基因PTEN、抑癌基因p33/ ING1和P-gp/MDR1在食管鳞癌中表达的意义及相互关系,为临床治疗和延缓食管鳞癌患者病情发展提供理论基础。

表1 c-myc、PTEN、p33/ING1和P-gp/MDR1 mRNA在食管正常组织、癌旁组织、鳞癌组织的表达(x±s)
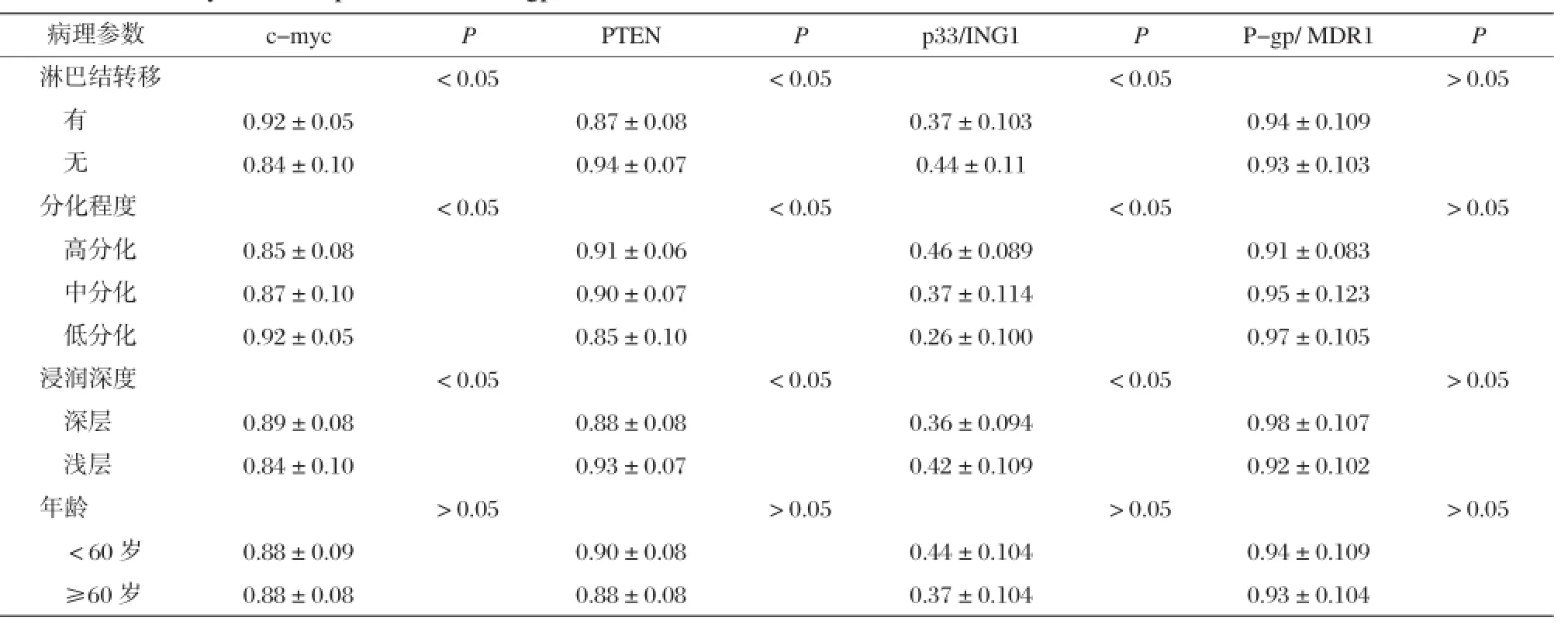
表2 c-myc、PTEN、p33/ING1和P-gp/MDR1 mRNA在食管鳞癌组织中的表达与临床病理参数的关系(x±s)
一、c-myc表达与食管鳞癌的关系
C-myc基因为细胞癌基因,它在DNA合成、细胞分化、调节细胞增殖、凋亡和调控细胞周期中均起到重要作用。依据本实验研究结果及分析可以得出,c-myc的异常表达在食管鳞癌的发展、浸润、转移中,都起到至关重要的作用。C-myc可能通过基因扩增、过表达、与其它基因的共同作用等机制致组织癌变。C-myc导致肿瘤的发生可能通过以下几条途径:①C-myc的异常表达可下调p27蛋白水平[5],也可激活Cullin基因,促进SCF对p27的泛素化降解,降低p27蛋白水平,p27蛋白可以通过抑制细胞周期素依赖性蛋白激酶来抑制细胞周期,阻止肿瘤形成,它的降低促进肿瘤细胞的增殖;②C-myc基因异常激活后,通过其转录目标mimitin基因[6],激活食管鳞癌细胞的增殖;③C-myc通过定位DNA合成点及与复制前复合体相结合,能够控制DNA复制;当失控时,同一机制也许还能引起DNA损伤和不正确的细胞增殖,从而引起癌症的发生[7]。以上途径可能单独、协同或共同引起食管鳞癌的发生,或许还有其他未知途径,需要我们不断探索。
二、PTEN表达与食管鳞癌的关系
PTEN基因在正常情况下抑制细胞过度生长,诱导细胞凋亡。当PTEN突变或失活时,机体细胞的正常凋亡过程受到抑制,细胞无限制生长,导致肿瘤的发生。本实验研究结果表明,在肿瘤恶性程度增高、浸润能力增强过程中,PTEN的抑制作用逐渐丧失。PTEN通过多种途径来参与调控细胞的代谢、生长、凋亡、恶变行为,如生长因子的信号传导系统--P13K/Akt信号途径[8-9]、MAPK信号转导通路[10]等。PTEN基因的异常表达还可能会导致PIP3通路不正常激活,从而使细胞无限制生长,同时可促进血管内皮因子形成,使血管内皮细胞增殖和肿瘤微血管形成,从而使肿瘤侵袭转移能力增高[11]Ghita C等[12]研究认为PTEN通过其脂质磷酸酶活性调节局灶聚集黏附激酶和SHC磷酸化对细胞与细胞间的粘附作用、细胞与细胞外基质的降解作用进行有效的调节,从而多方面调节肿瘤的生物学功能。PTEN/P53/ MDM2信号通路原癌蛋白MDM2被鉴定为PTEN/ PI3K/AKT的下游分子,PTEN可以抑制AKT磷酸化,从而AKT不能从细胞浆进入细胞核,进而MDM2与P53蛋白相互结合受抑,最终抑制P53转录激活[13]。同时,PTEN启动子上有P53的结合位点,P53又能从转录水平调节PTEN表达。因此,PTEN、MDM2与P53形成了相互作用通路,相互协调之间的作用与功能。
三、P-gp/MDR1在食管鳞癌中的表达和意义
图1 c-myc RT-PCR电泳图
图2 c-myc扩增曲线
图3 PTEN RT-PCR电泳图
图4 PTEN扩增曲线
图5 p33/ING1 RT-PCR电泳图

图6 p33/ING1扩增曲线
图7 P-gp/MDR1 RT-PCR电泳图
图8 p-gp/MDR1扩增曲线
肿瘤多药耐药性(MDR)是肿瘤化疗失败的最大原因,多药耐药基因MDR1表达增高是影响肿瘤多药耐药性的主要表型,MDR1基因的编码产物P-gp可使抗癌药物泵出细胞外,使细胞内的药物浓度降低,从而使肿瘤细胞产生耐药性。机制如下:当有耐药性的细胞置于含有抗癌药物的液体中时,大多数的脂溶性药物将按浓度梯度进入细胞内,此时P-gp将结合药物分子,同时其核苷酸结合位点连上腺嘌呤核苷三磷酸,ATP水解之后释放的能量使抗癌药物主动地转运到细胞外,使细胞内侧的药物浓度始终维持比较低水平,从而使相应抗癌药的细胞毒作用减弱或消失,而出现耐药性。本实验结果提示该基因的表达是独立于病理形态指标之外的分子参数,食管癌组织中存在着原发性多药耐药,这可能是在病情发展的过程中,肿瘤细胞的自身MDR1基因扩增的结果,无论组织分化好坏、病变早晚、大体形态如何,就从P-gp/MDR1基因表达情况来看,食管癌都有相当高耐药机率,这很可能是多年来食管癌的化疗效果不明显的原因之一,合理选择化疗药物尤为重要。
四、p33/ING1在食管鳞癌中的表达和意义
抑癌基因ING1主要作用是参与细胞生长的负性调节、细胞衰老和凋亡[14]。P33/ING1蛋白为ING1基因主要的翻译产物。抑癌基因的功能失活的主要机制:①基因水平的改变、插入、缺失、突变和重组等;②基因的结构正常,但其产物表达异常,可能在转录、转录后加工、蛋白降解、翻译等的环节出现了异常;③虽然有正常的产物但不能发挥其功能,如被癌基因产物所结合从而封闭了功能[15-16]。本试验结果提示,p33/ING1基因的表达与食管癌的发生、发展、浸润及转移有关;食管癌中p33/ING1基因突变存在一定比例,同时与局部基因的杂合性缺失有密切关系。
五、癌基因c-myc、抑癌基因PTEN、抑癌基因p33/ING1和P-gp/MDR1在食管鳞癌组织中表达的联系
本实验发现,食管正常组织和食管鳞癌组织中c-myc和PTEN蛋白的表达呈负相关,说明在食管鳞癌发展过程中,原癌基因c-myc被激活,导致细胞异常增生,而抑癌基因PTEN的负调控作用减弱甚至消失,组织无限制、无规律生长,最终发展为恶性肿瘤。二者在肿瘤形成过程中的关系,可能有以下几点:①PTEN基因是c-myc基因的靶基因之一,c-myc的异常激活,导致PTEN的表达失活,二者相互作用,引起肿瘤的发生[17]。②PTEN基因可以在转录水平上抑制内生性和外源性c-myc的表达[18],当PTEN基因缺失或突变时,c-myc基因表达增加,二者协同或共同,引发癌症。
本实验结果显示,p33/ING1和P-gp/MDR1基因在食管鳞癌中的表达水平呈负相关。p33/ING1在食管鳞癌中的表达显著低于正常组织细胞,对γ射线及化疗药物和紫外线处理的敏感性也降低。然而促进p33/ING1转录水平升高可直接抑制肿瘤细胞的生长和阻止恶性转化。因而诱导p33/ING1mRNA表达升高的方法被认为是治疗食管鳞癌、白血病等恶性肿瘤的新手段。另有研究认为,MDR1基因的过量表达除了涉及到耐药外,也是肿瘤细胞生物学行为更进一步恶化的指标[19]。因此联合检测食管鳞癌组织中p33/ING1和P-gp/MDR1基因表达水平,可能为判断肿瘤恶性程度,并开展有效的治疗和预后评估提供一个重要的参考指标。虽然目前对p33/ ING1基因抑制癌细胞生长方面的机制和P-gp/ MDR1基因在肿瘤耐药性方面的机制分别较明确,但它俩在肿瘤的发生、发展、浸润转移及耐药方面的共同的作用环节点还不是很明确,有待进一步研究。
综上所述可得出以下结论:①c-myc的高表达、PTEN的低表达、p33/ING1的失活和P-gp/MDR1的高表达与食管鳞癌的发展、浸润、转移相关;②cmyc和PTEN在食管鳞癌中表达的负相关性提示可能共同参与食管鳞癌的发展、增殖、浸润、转移;③p33/ING1在食管鳞癌组织中表达的下降或缺失提示食管鳞状细胞癌可能发生了浸润甚至有淋巴结转移,预后不良。无论食管鳞癌的病变早晚、组织分化好坏及大体形态如何,从P-gp/MDR1基因表达的情况来看,食管癌都有相当高的耐药机率,合理选择药物化疗优为重要。
1犹东,高平.C-myc、P53、bcl-2、CD44V6、nm23-H1基因在食管鳞癌中表达及其与预后的关系.宁夏医学杂志,2010,32(3):206-208.
2Wang W,Xue L,Wang P.Prognostic value of β-catenin,c-myc, and cyclin D1 expressions in patients with esophageal squamous cell carcinoma.Med Oncol,2011,28(1):163-169.
3王伟,刘红涛,柴玉荣,等.食管鳞状细胞癌中Wnt2、β-catenin、cmyc和cyclinD1的表达及临床意义.肿瘤防治研究,2009,36(3): 213-215.
4张现伟,韩彪,刘健,等.食管鳞癌中pRb2/p130、Cdk4和c-myc的表达及意义.陕西医学杂志,2006,35(2):171-174.
5Kudo Y,Kitajima S,Sato S,et al.High expression of S-phase kinase-interacting protein 2,human F-box protein,correlates with poor prognosis in oral squamous cell carcinomas.Cancer Res,2001, 61(19):7044-7047.
6Tsuneoka M,Teye K,Arima N,et al.A novel Myc-target gene, mimitin,that is involved in cell proliferation of esophageal squamous cell carcinoma.J Biol Chem,2005,280(20):19977-19985
7Dominguez-Sola D,Ying CY,Grandori C,et al.Non-transcriptional control of DNA replication by c-Myc.Nature,2007,448(7152): 445-451.
8Schmid AC,Byrne RD,Vilar R,Woscholski R.Bisperoxovanadium compounds are potent PTEN inhibitors.FEBS Lett,2004,566(1-3): 35-38.
9Fenic I,Franke F,Failing K,et a1.Expression of PTEN in malignant and non-malignant human prostate tissues:comparison with p27 protein expression.J Patho1,2004,203(1):559-566.
10彭惠,杨光华.肿瘤抑制基因PTEN/MMAC1/TEP1在肿瘤研究中的进展.临床与实验病理学杂志,2001,17(4):342-344.
11李金,廖贵清.抑癌基因PTEN在口腔肿瘤的研究进展.国外医学口腔医学分册,2006,33(2):122-124.
12 Ghita C,Vilcea ID,Dumitrescu M,et a1.The prognostic value of the immunohistochemical aspects of tumor suppressor genes p53, bcl-2,PTEN and nuclear proliferative antigen Ki-67 in resected colorectal carcinoma.Rom J Morphol Embryol,2012,53(3):549-56.
13 Mayo LD,Dixon JE,Durden DL,et al.PTEN protects p53 from Mdm2 and sensitizes cancer cells to chemotherapy.J Biol Chem, 2002,277(7):5484-5489.
14 Cheung KJ Jr,Li G.The tumor suppressor ING1:structure and function.Exp Cell,2001,268(1):1-6.
15 Hamahan D,Folkman J.Paterns and emerging mechanisms of the angiogenesis swith during tumorgenesis.Cell,2007,86(1):354-364.
16 Park YN,Chae KJ,Kim YB.Apoptosis and proliferation inepatocarcino genesis elated to cirrhosis.Cancer,2001,92(11):2733-2738.
17房学东,任辉,张研,等.结直肠癌组织抑癌基因PTEN和癌基因C-myc蛋白表达及其相关性.吉林大学学报,2005,33(3):570-573.
18 Asano T,Yao Y,Zhu J,et al.The PI3-kinase/Akt signaling pathway is activated due to aberrant Pten expression and targets transcription factors NF-kappaB and c-Myc in pancreatic cancer cells. Oncogene,2004,23(53):8571-8580.
19王延明,王爱明,王艳军.多药耐药基因和多药耐药相关蛋白基因在食管、贲门癌中表达.中国胸心血管外科临床杂志,2000,7(1): 38-40.
Expression and significance of C-myc,PTEN,p33/ING1,and P-gp/MDR1 in esophageal squamous cell carcinoma
LENG Xue-qin1,JIA Hui-qiong1,CHEN Wen-xia2,LI Hui-e2,CHAO Chun-li1,SU Bing-zhong1.
1)Department of Gastroenterology,Inner Mongolia Medical University Affiliated Hospital,Hohhot 010059,China;2)Department of Gastroenterology,the First Hospital of Hohhot City,Hohhot 010010,China
ObjectiveTo explore the expression of C-myc,PTEN,p33/ING,and P-gp/MDR1 in esophageal squamous cell carcinoma and its relationship with pathological features.Methods RT-PCR method was used to detect the expression level of C-myc,PTEN,p33/ING,and P-gp/MDR1 in 60 cases of esophageal squamoue cell carcinoma,adjacent tissue,and normal esophageal mucosa.The differences and correlation of c-myc,PTEN,p33/ING,and P-gp/MDR1 expression in infiltration,division,metastasis of esophageal squamoue cell carcinoma were analyzed.Results The expression of C-myc and P-gp/MDR1 in normal esophageal tissues,adjacent tissues,esophageal squamous cell carcinoma tissues was gradually increased(P<0.05).PTEN and p33/ING1 in normal esophageal tissues,adjacent tissues,esophageal squamous cell carcinoma tissues were significantly decreased(P<0.05).The expression of C-myc was significantly higher in esophageal squamous cell carcinoma with lymph node metastasis,low differentiation,deep infiltration(P<0.05).The expression of PTEN and p33/ING1was significantly lower in esophageal squamous cell carcinoma with lymph node metastasis,low differentiation,deep infiltration(P<0.05).The positive expression rate of P-gp/MDR1with esophageal squamous cell carcinoma was not significantly different with the depth of invasion,lymph node metastasis(P>0.05).Conclusion The synergy C-myc with PTEN might participate in the development,invasion,and metastasis of esophageal squamous cell carcinoma.Combined detection of the expression of oncogene c-myc,tumor suppressor gene PTEN,p33/ING1 P-gp/MDR1gene in esophageal squamous cell carcinoma might provide guidance to the clinical diagnosis,chemotherapy and prognosis.
Esophageal squamous cell carcinoma;c-myc;PTEN;p33/ING;P-gp/MDR1
2014-08-12)
(本文编辑:南清振)
10.3969/j.issn.1672-2159.2015.03.001
1 010059内蒙古医科大学附属医院消化内科;2 010010呼和浩特市第一医院消化内科
内蒙古自然科学基金项目(2009MS1147)

