HPLC法测定大豆磷脂及其保健品中PC、PI、PE
李国辉,钟其顶,王道兵,高红波,熊正河,申世刚
(1.河北大学化学与环境科学学院,河北省分析科学技术重点实验室,“药物化学与分子诊断”省部共建重点实验室,河北保定071001;2.中国食品发酵工业研究院,北京100015)
HPLC法测定大豆磷脂及其保健品中PC、PI、PE
李国辉1,2,钟其顶2,王道兵2,高红波2,熊正河2,申世刚1
(1.河北大学化学与环境科学学院,河北省分析科学技术重点实验室,“药物化学与分子诊断”省部共建重点实验室,河北保定071001;2.中国食品发酵工业研究院,北京100015)
建立了高效液相色谱紫外检测器测定大豆保健品中磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇的测定方法。采用NH2色谱柱(3.0mm×150mm×5μm),流动相为乙醇∶乙腈∶水=50∶40∶10(体积比),流速0.4mL/min下,紫外检测器波长为206 nm处进行测定。样品经正己烷∶异丙醇=1∶1(体积比)混合液溶解并使用流动相稀释后直接进样分析。在线性范围内相关性良好,相关系数R2≥0.999,各添加水平回收率为91.12%~105.61%,RSD为4.85%,日内和日间精密度均小于4%,磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇定量限分别为1.5mg/L、1.2mg/L和0.9mg/L。本方操作简单、准确、成本低,适合于分析大豆磷脂及其保健品中三种主要磷脂的含量。
高效液相色谱;磷脂酰胆碱;磷脂酰乙醇胺;磷脂酰肌醇
磷脂作为构成生命的基础物质,它不仅以膜(线粒体膜、核膜、细胞膜,等)的形式存在人体的每一个细胞中,它还是脂质体(Liposome)制备的主要膜材,可在生物体内无毒性、无免疫原性降解,同时也可以作为天然的表面活性剂使用,目前广泛应用于饲料、医药、食品、和化妆品等相关领域[1-2]。依据来源划分,磷脂的主来源有大豆磷脂和蛋黄磷脂;大豆磷脂属于磷脂复合体,它是由磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰肌醇(phosphatidylinositol,PI)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)、磷脂酰丝氨酸(phosphatidylserine,PS)等成分组成,其中前三种最为典型。
随着脂质体开发技术的进步,纯度高、稳定性好的磷脂类化合物日益受到重视,其中高纯度磷脂类产品更是倍受关注的焦点。现今大豆磷脂保健品种类繁多,快速、高效的磷脂类物质检测方法对于及时分析产品以及原料中各类磷脂成分的含量以及精确评价大豆磷脂提取方法尤为重要。目前,磷脂类物质的分析测定方法种类较多,主要包括定磷法[3],薄层层析和薄层扫描色谱法[4-5]、紫外可见光吸收光谱分析法[6]、高效液相色谱法[7-11]、核磁共振光谱分析法[12]和液质联用法[13-15]等。其中,定磷法操作繁琐、耗时,并且需要消化、显色等一系列过程;而薄层扫描和薄层层析法由于其灵敏度较低,喷雾显色后定量误差较大,且易受多种因素干扰,目前主要用于定性分析;而液质联用技术虽然可以检测多种磷脂且灵敏度较高,但是仪器要求严格,成本较高。
虽然高效液相色谱法具有分析速度快、灵敏度高、系统密闭性好可以避免不饱和键氧化等优点,但在磷脂类物质测定方面的应用还存在一系列问题,例如:前处理操作与洗脱程序较为复杂,各组分分离效果较差等。目前,国标GB/T 21493-2008中推荐了测定大豆磷脂中PC、PE、PI的高效液相测定方法[16],但是检测限较高。且方法使用Si-60色谱柱。其他检出限较低的液相方法在分离柱的填料、流动相的选择方面也存在差异,不同的样品前处理与检测方法同样会对检测结果产生较大的影响。本文建立了利用氨基柱分离紫外检测器测定大豆磷脂及其保健品中PC、PE、PI的高效液相色谱方法,方法操作简单,灵敏度高,可用于大豆磷脂以及保健品中主要成分的质量控制。
1 材料与方法
1.1 仪器与试剂
Waters2695高效液相色谱仪,waters2998紫外检测器,InertsilNH2 column(3.0mm×150mm×5μm),分析天平(精度0.0001g),磷脂酰胆碱标准物质(纯度≥98%,购自Sigma),磷脂酰肌醇标准物质(纯度≥98%,购自Sigma),磷脂酰乙醇胺标准物质(纯度≥98%,购自Sigma);乙腈、乙醇、正己烷、异丙醇(色谱纯,均购自CNW),实验室用水为二次蒸馏水。
1.2 标准溶液配制
分别准确称取磷脂酰胆碱0.040 0 g,磷脂酰乙醇胺和磷脂酰肌醇各0.020 0 g,混合后用正己烷/异丙醇(1∶1,V/V)溶解,并定容至10mL。PC、PE、PI的最终浓度为4000、2000、2000mg/L,标准溶液-20℃下储存。
1.3 样品处理
直接将大豆磷脂保健品(胶囊需去掉囊衣取出内容物)准确称取100mg,加入15mL正己烷:异丙醇(1∶1,V/V)混合液中超声溶解30min,待完全溶解之后定容至25mL,-20℃下储存备用。根据样品标识的卵磷脂含量使用流动相稀释在线性范围内,0.45μm滤膜过滤后测定分析。
1.4 色谱条件
色谱柱:Inertsil NH2 column,3.0mm×150mm× 5μm(或性能相当);流动相:乙醇/乙腈/水=50∶40∶10(体积比);流速:0.4 mL/min,等度洗脱;进样体积:10μL;柱温:40℃;紫外检测波长:206 nm。
1.5 定性与定量
根据PC、PE、PI标准样品的保留时间,与待测样品中组分的保留时间进行比较定性,使用外标法定量。
2 结果与分析
2.1 分离度和线性
经过调整流动相中乙醇、乙腈和水的比例,最终确定流动相为乙醇∶乙腈∶水=50∶40∶10(体积比),样品中PE、PC、PI分离度良好,如图1所示。
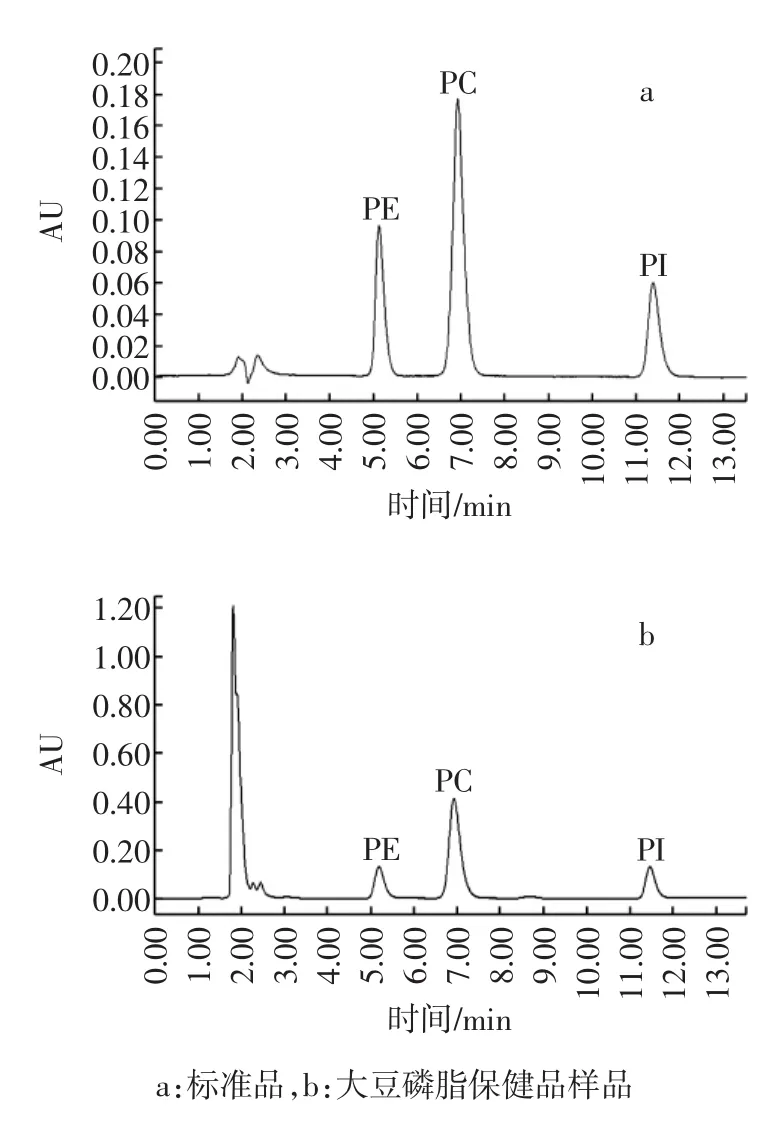
图1 PE、PC、PI经HPLC-UV测定色谱图Fig.1 HPLC-UV chromatograms of PE,PC and PI.
由于乙醇的最大紫外吸收为196 nm,由样品空白的色谱图可知,在PE、PC、PI保留时间处无干扰。取适量混标溶液储备液,使用流动相分别稀释200、100、50、25、8倍配制系列浓度梯度,进样分析相关性。如表1所示,各物质在浓度范围内线性良好,相关系数R2>0.999。与其他的液相色谱方法相比,本文建立的方法出峰时间快,分离度好。

表1 线性与相关系数Table1 Inearity and correlation coefficient
2.2 样品前处理条件优化
常规的使用紫外分光光度法测定的丙酮去油离心、蒸干、乙醇溶解的样品前处理方法[6,12]无法溶解样品中的PE,而柱层析[7,17]的前处理方法过于繁琐。目前,其他相对简单的前处理方法如样品直接经氯仿/甲醇溶解定容[6],以及正己烷/异丙醇/冰乙酸的前处理方法[16]的杂质干扰较大或需要特殊的色谱柱。
本文建立利用正己烷/异丙醇直接对大豆磷脂以及大豆磷脂保健品进溶解定容。大豆磷脂粗制或精制粉状样品,可直接称取0.0100g进行溶解定容,软胶囊类的磷脂保健品需去掉包衣取出内容物称重后溶解定容。对于在溶解过程中存在沉淀的个别样品,本文对溶解时间进行了探索,如图2所示。
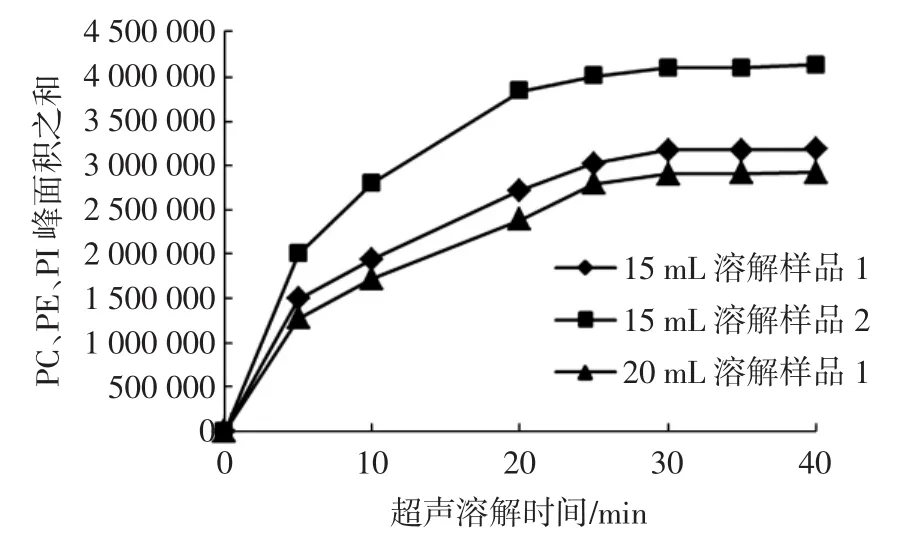
图2 超声时间对样品溶解的影响Fig.2 The influence of ultrasonic time on dissolving samples
在超声溶解30min时,PC、PE、PI的峰面积之和达到稳定,并且在溶解溶剂使用量加大至20mL时,结果一致。因此选定超声溶解的时间为30min,且有沉淀的样品需离心后取上清定容。
2.3 精密度和重复性
取同一样品在同一天内连续进样5次以及连续5天进样测定(每天连续测定3次取平均值),根据测定结果分析日内精密度和日间精密度。如表2所示。
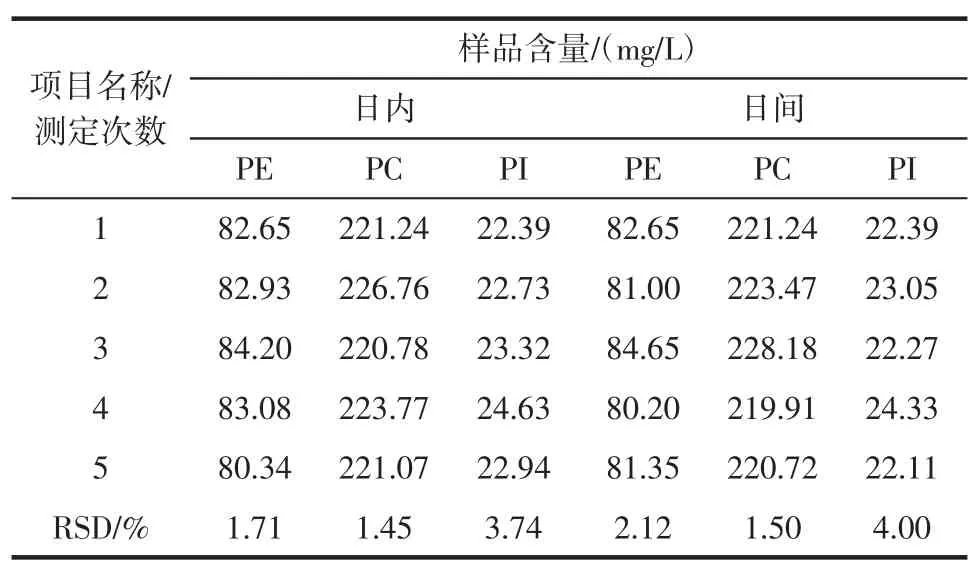
表2 日内和日间精密度Table2 Precision of intraday and interday
方法日内精密度和日间精密度均≤4%。因此,本文建立的HPLC测定大豆磷脂中三种主成分含量的方法精密度良好。
2.4 检出限
依据S/N=3原则,测得PE、PC、PI的检出限分别为1.2、1.5mg/L和0.9mg/L。
2.5 加标回收率
取定容稀释后的样品,分别添加不同浓度的混标溶液,分析该方法测定三种大豆磷脂的回收率,结果见表3。
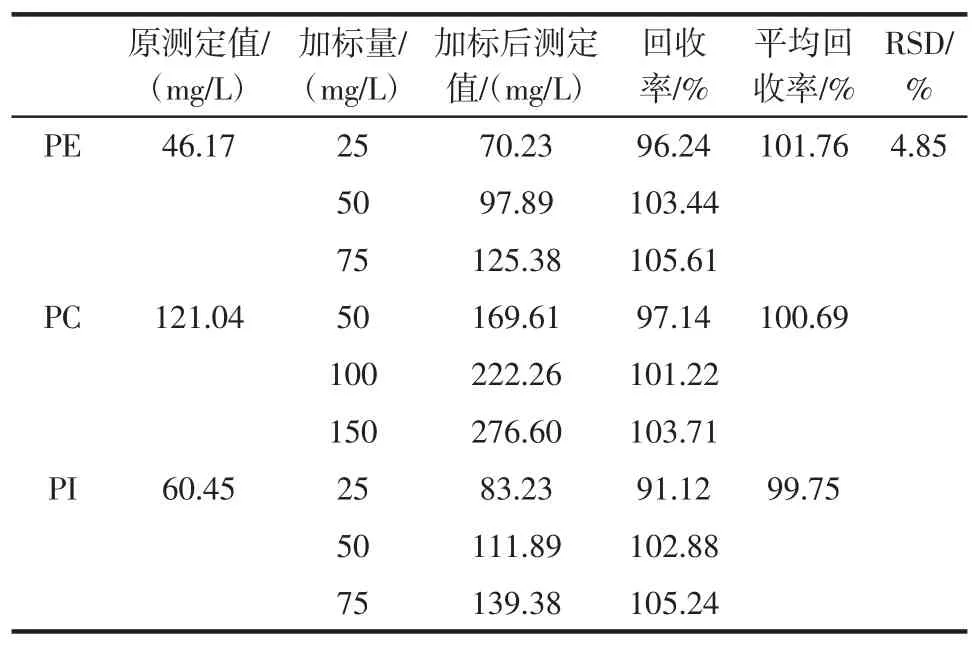
表3 不同添加水平回收率测定结果Table3 Recovery rate of PE,PC and PIin different spiked level
该方法对于大豆磷脂三种主成分含量的测定回收率为91.12%~105.61%之间,回收率RSD为4.85%。因此,应用本方法测定大豆磷脂中三种主要成分含量的准确度良好。
2.6 样品测定
随机挑选3个市售大豆磷脂粉和3个大豆磷脂保健品,依照前处理方法将样品准确称重后、溶解定容至25mL。经流动相稀释后测定样品中PE、PC、PI,根据标准曲线定量,每一样品重复测定3次。之后依据称取样品质量计算每100克样品中PE、PC、PI含量,测定结果如表4所示。
表4 大豆磷脂样品及保健品测定结果(n=3,±s)Table4 Determination results of soybean phospholipids(n=3,±s)g/100 g
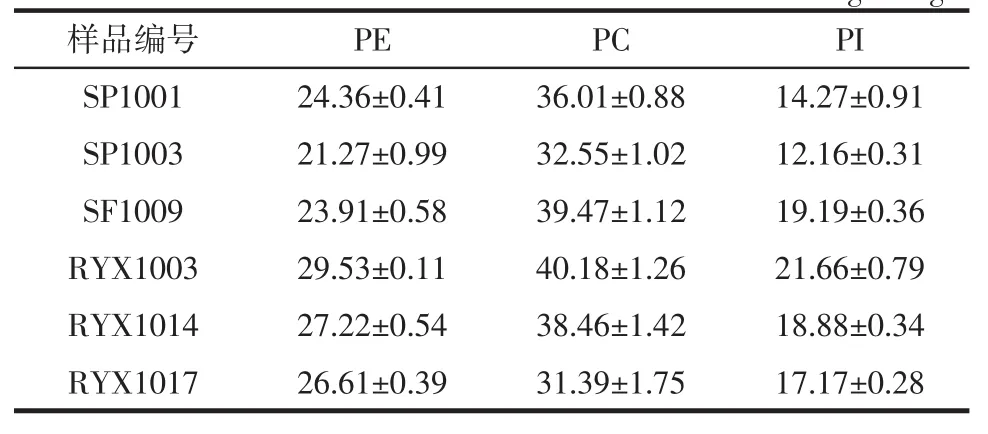
表4 大豆磷脂样品及保健品测定结果(n=3,±s)Table4 Determination results of soybean phospholipids(n=3,±s)g/100 g
样品编号 PE PC PI SP1001 24.36±0.41 36.01±0.88 14.27±0.91 SP1003 21.27±0.99 32.55±1.02 12.16±0.31 SF1009 23.91±0.58 39.47±1.12 19.19±0.36 RYX1003 29.53±0.11 40.18±1.26 21.66±0.79 RYX1014 27.22±0.54 38.46±1.42 18.88±0.34 RYX1017 26.61±0.39 31.39±1.75 17.17±0.28
其中,PC、PE、PI含量分别在31~41、21~30、12~30 g/100 g之间,含量结果基本符合《美国中央大豆公司磷脂指南》中提到的大豆磷脂中PC、PE、PI的含量比例。
3 结论
本试验采用高效液相色谱法-紫外检测器建立了大豆磷脂及其保健品中磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰肌醇快速测定方法,并对该方法进行了方法学验证。该方法灵敏度高,重复性好,操作简便,可广泛应用于大豆磷脂及其保健品中三种主要成分含量的测定,并为其质量评价提供可靠依据。
[1]王健,李明轩.前体脂质体研究进展[J].中国医药工业杂志, 2005,36(11):707-711
[2]齐文娟,岳红卫,王伟.大豆磷脂的理化特性及其开发与应用[J].中国油脂,2005,30(8):35-37
[3]庞玉珍,王玉静.速溶奶粉中卵磷脂含量的测定[J].中国乳品工业,1998,26(3):46-47
[4]郭勍,徐桂云,常理文.大豆磷脂组成的薄层色谱分析[J].分析化学,1998,26(1):81-84
[5]王岩,关明,陈坚.双波长薄层扫描法测定卵磷脂中磷脂酰胆碱的含量[J].新疆医科大学学报,2003,26(6):546-547
[6]关明,李燕,赵淑贤.紫外分光光度法测定卵磷脂胶囊中的磷脂酰胆碱[J].中国酿造,2008,23(200):95-96
[7]张德权,陈卫涛,张柏林.高效液相色谱法测定大豆中卵磷脂的含量[J].核农学报,2006,20(5):414-416
[8]汪凤云,周海凡,巩飚.HPLC法测定保健品卵磷脂胶囊中卵磷脂的含量[J].河南预防医学杂志,2009,20(1):17-18
[9]何新霞,郑孝华,郏海燕,等.HPLC法测定大豆磷脂中卵磷脂含量[J].食品科学,2000,21(2):57-59
[10]FB Jungalwala,JE Evans,R HMcCluer.High-performance liquid chromatography of phosphatidylcholine and sphingomyelin with detection in the region of200 nm[J].Biochem.J,1976,155:55-60
[11]王剑霞,黄光亮,陈禧翎,等.HPLC同时测定大豆磷脂中磷脂酰胆碱和溶血磷脂酰胆碱含量[J].中国现代应用药学,2011,28(6):564-566
[12]肖朝萍,王红,卓玉华.核磁共振磷谱与分光光度法联合测定卵磷脂样品中卵磷脂含量[J].广西化工,2000(81):196-196
[13]Ulf Sommer,Haya Herscovitz,Francine K.Welty,et al.LC-MS-based method for the qualitative and quantitative analysis of complex lipidmixturess[J].The Journal of Lipid Research,2006,4(47):804-814
[14]Semin Park,Soo Taek Kim,ChiYeon Kim,et al.Phospholipid profiling of 57 soybean (Glycinemax)varieties by high-performance liquid chromatography-tandem mass spectrometry and principal component analysis to classify Korean soybean germ plasm[J]. Biomedical Chromatography,2012,27(1):27-33
[15]Sung Joong Leea,Jin Young Choia,Semin Parka,et al.Determination of phospholipids in soybean (Glycine max(L.)Merr)cultivars by liquid chromatography–tandem mass spectrometry[J].Journal of Food Composition and Analysis,2010,23(4),314-318
[16]全国粮油标准化技术委员会.GB/T 21493-2008大豆磷脂中磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇的测定[S].北京:中国标准出版社,2008:1-3
[17]Christopher Beemann,Angelika Green.Lipid Class Separation by HPLC Combined with GC FA Analysis:Comparison of seed lipid compositions from different Brassa napus L.varieties.JAm OilChem SOc,2003,80(8):747-753
Determination of the Concentrations of Phosphatidylcholine,Phosphatidyl Ethanolamine and Phosphatidylinositol in Soybean Phospholipids and Health Care Products by HPLC
LI Guo-hui1,2,ZHONG Qi-ding2,WANG Dao-bing2,GAO Hong-bo2,XIONG Zheng-he2,SHEN Shi-gang1
(1.Key Laboratory of Analytical Science of Hebei Province;Key laboratory of Medical Chemistry and Molecular Diagnosis,Ministry of Education;College of Chemistry and Environmental Science,Hebei University,Baoding 071001,Hebei,China;2.China National Institute of Food and Fermentation Industries,Beijing100015,China)
A sensitive method for the determination of phosphatidylcholine,phosphatidyl ethanolamine and phosphatidylinositol in soybean phospholipids by high-performance liquid chromatographic analysis is described.A NH2 column (3.0 mm×150 mm×5μm)was used and the isocratic elution mobile phase was ethanol∶acetonitrile∶water(50∶40∶10,v/v/v).The flow rate was0.4mL/min and the detector was UV with 206nm.The sample was dissolved byn-hexane∶isopropanol(1∶1,v/v)and diluted by mobile phase for analyzed. The correlation coefficient of phosphatidylcholine,phosphatidyl ethanolamine and phosphatidylinositol was greater than 0.999 in linear range.The precision of interday and intraday of the three ingredients were less than 4%and the recoveries were between 91.12%-105.61%.The limit of detection of phosphatidylcholine,phosphatidyl ethanolamine and phosphatidylinositolwere 1.5mg/L,1.2mg/L and 0.9mg/L,respectively.The method is rapid,accurate and reliable,and can be used to determine three main components of soybean phospholipids and health care products.
HPLC;phosphatidylcholine;phosphatidyl ethanolamine;phosphatidylinositol
10.3969/j.issn.1005-6521.2015.06.018
2014-07-18
国家自然基金(31101333);国际合作项目(2011DFA33270);国家科技支撑计划(编号:2012BAK17B11);质检公益项目(编号:201210104)
李国辉(1986—),男(汉),博士研究生,主要从事食品分析研究。
*通信作者:钟其顶(1980—),男(汉),博士,高级工程师,主要从事食品安全及其真实性研究。

