碳点的制备及其生物成像与生物检测应用
陈 卓,刘国良,王 伟
(1.安徽理工大学 化学化工学院,安徽 淮南 232001; 2.盐城工学院 化学化工学院,江苏 盐城 224051)
碳点的制备及其生物成像与生物检测应用
陈卓1,2,刘国良2,王伟1,2
(1.安徽理工大学 化学化工学院,安徽 淮南232001; 2.盐城工学院 化学化工学院,江苏 盐城224051)
摘要:碳点(CDs)作为一种新的含碳荧光纳米粒子,由于其良好的生物相容性引起了广泛的关注。碳点不仅被用于生物成像探针,还被用来作为生物传感探针。目前,碳点的合成、结构与性质、荧光机理以及对生物相容性和生物应用的评价等方面都有了很大的进展。从碳点的合成方法、荧光性质以及在生物成像和生物检测应用方面进行了概述,重点阐述了碳点用于荧光比率传感的设计与构建,并对碳点研究的发展方向和应用前景进行了评述与展望。
关键词:碳点;荧光探针;生物成像;生物检测;传感;综述
在生命科学体系中,许多基本生命活动过程的研究依赖于对生物分子间以及生物分子与一些离子或小分子相互作用做出快速、灵敏、可靠和可重复的检测[1]。如今社会,随着人们对健康以及疾病诊断和治疗的关注度逐渐增加,对这些物质检测的关注也随之增加。但是生命体系的多样性和复杂性,使得对这些物质的检测也面临着挑战。荧光检测法由于灵敏度高、选择性好、操作性强等优点成为对这些物质进行检测的重要手段之一。此外,荧光领域有多样的荧光发色团可供选择,如荧光纳米粒子,包括量子点(QDs)、金属团簇、染料修饰的纳米粒子和稀土材料粒子,这些荧光发色团受到相关领域特别是生物领域的日益关切而快速发展。在过去的10年,对这些荧光物质的研究和开发重点主要集中在生物检测和生物成像方面[2-3],尤其含Cd的量子点(如CdSe,CdTe等)已经被证明在电磁波谱的可见范围内具有极高的量子产率和尺寸可调发射的性能[4-5]。不过,可惜的是,QDs合成一般都需要重金属(例如镉、铅等),这些重金属会对环境有潜在危害,并且它们的持久毒性限制了在生物体内的应用。出于这些考虑,研究者转向寻找性质温和的量子点以代替QDs,从而对环保、低毒的荧光纳米粒子的研究产生了很大的兴趣。
碳纳米材料(如碳纳米管、富勒烯、石墨烯等)由于其独特的光学性质成为目前研究的热点。碳点作为碳纳米材料的一种,是最有希望替代QDs的纳米材料[6]。 碳点的尺寸一般小于10 nm,具有尺寸和激发波长可调的荧光性质。碳点不仅具有良好的荧光性和耐光漂白性,还具有很好的水溶性、低细胞毒性以及良好的生物相容性。碳点的这些特性使其逐步取代传统重金属量子点在生物领域如细胞标记、生物成像与检测、药物释放等方面的应用[7-10]。
1碳点的制备
到目前为止,碳点的合成可分为:自上而下和自下而上两种路线。自上而下合成路线主要是通过激光消融、电化学氧化大块石墨烯碎片初始物的方法制备碳点;自下而上合成路线主要是通过冷凝和碳化前驱体来制备碳点,其方法主要有热解法、微波辅助法和水热法3种。
1.1 自上而下合成碳点
1.1.1激光消融法
Sun等[11]发明了激光消融法并成功运用此法将碳靶材等合成制得碳点,方法如下:首先将石墨粉和粘土混合物通过烘烤、成型、退火三步热处理制得碳靶材,然后采用 Q 开关 Nd:YAG (1 064 nm,10 Hz)激光器消融,得到不同尺寸的碳纳米颗粒初产物,再将初产物置于2.6 mol/L的硝酸中回流 12 h,得到无荧光性的纳米碳颗粒,最后将其表面进行简单的有机物钝化就使其从无荧光性的纳米碳颗粒变成荧光性纳米碳点。Hu等[12]通过对石墨或炭黑均匀分散的有机溶剂溶液进行激光消融也制得了碳点,方法是:用波长为1.064 mm,功率密度为60×106 W cm2的Nd:YAG激光器对上述溶液激光辐射2 h,得到粒子分散液,通过离心除去大颗粒的黑色碳不溶物,取上清液即可得到均匀分散的荧光纳米碳点。为了加快碳颗粒的运动,整个过程需要在超声作用下进行。研究表明,虽然用不同的初始物(碳或石墨)和表面钝化有机溶剂(PEG200N、水合肼、二乙醇胺)都可以方便有效地合成碳点,但是,表面钝化剂的不同会改变碳点的量子产率。用水合肼表面钝化的碳点荧光量子产率为 3.7%,而用二乙醇胺钝化的碳点可达7.8 %,因而可通过改变表面钝化有机试剂来调控碳点的不同荧光性能。
1.1.2电化学氧化法
电化学氧化法制备碳点简单、温和而又方便,用一个普通的电化学电池就可以制备。电化学电池由一个工作电极(WE)、一个参比电极(RE)、一个对电极(CE)和电解质组成,工作电极是碳材料,也可以是多壁碳纳米管、石墨棒、碳糊电极碳纤维[13-16]等。电化学法制备碳点的原理是:应用循环伏安法将工作电极在电解质中进行连续电压扫描,通过调节电压和电流密度精确地控制碳点合成。Bao等[17]用电化学氧化法成功合成了碳点,实验是以碳纤维作为工作电极,铂片和银线分别作为对电极和参比电极,0.1 mol/L的四丁基高氯酸铵(TBAP)乙腈溶液作为电解质,通过电压调节来控制碳点尺寸的大小。电压越大得到的碳点尺寸越小,对于粒径分布窄的碳点可以通过此方法直接获得而不需要进一步地分离或者表面钝化。显然,电化学方法具有易操作、低成本和高产量等优点。
1.1.3炭灰剥落法
蜡烛、煤油灯和植物等不完全燃烧时会产生碳纳米颗粒,它们之间因紧密连接而聚集。高温时,聚集的碳颗粒经过长时间强酸的作用而分解,形成碳点[18]。碳点在普通环境下放置几个月依然性能稳定,碳点还可以被单束波长的光激发,发射出很多颜色的光。Liu等[19]通过蜡烛灰制备并提纯了碳点,实验证明该碳点表面富含羧基基团,可使其通过与N-羟基琥珀酰亚胺(NHS)多肽缩合剂作用而进行生物大分子功能化。与这些炭灰相似的烧烤炭灰也可以用来合成明亮的荧光碳点,如烤牛肉的炭灰样品用丙酮洗涤,经过蒸发和热处理后,再在2.5 mol/L的硝酸溶液里回流,经离心去除上层悬浮物后再透析,便得到不同量子产率混和的具有稳定水溶性的碳点溶液。不同量子产率的碳点是由碳点表面钝化反应的不同进程造成的。将混合纳米材料的溶液在G-100凝胶柱里分馏,发现大多数纳米材料的荧光产率接近40%[20],表明高性能的碳点可以通过一系列丰富的可再生材料制备得到。
1.2 自下而上合成碳点
虽然自上而下的合成方法是非常有效的制备理想碳点的常用方法,但是自下而上的方法因其具有低成本和绿色合成等优点[21],而使其能够避免昂贵的碳源材料和繁多的实验步骤因此被广泛采用。

图1 碳点由蛋白质和碳水化合物制得的可能机理示意图[30]Fig.1 Schematic illustration of the possible mechanism of CDs formation from proteins and carbohydrates
目前,自下而上的碳点合成研究主要集中在绿色碳源上,例如,牛奶、橙汁、香蕉汁、柳树皮、鸡蛋、辣椒和树叶[22-29]等,这些碳源物质有的包含蛋白质,如胶原蛋白、大豆蛋白等,有的包含糖类,如淀粉、葡萄糖和果糖等,它们均已成功地合成了碳点。图1为从两种前驱体(蛋白质和碳水化合物)制备碳点的机理推测示意图[30]。
自下而上合成碳点的方法包括四个过程。用碳水化合物作碳源时,碳水化合物经过水解、脱水和分解反应得到单糖类物质(可溶性化合物糠醛和酮类);用蛋白质为碳源时,蛋白质完全水解得到氨基酸混合物。聚合和冷凝上述物质成为可溶性的聚合物,这些聚集体在过度饱和而超过临界浓度的时候会核破裂形成碳点。如果需要提高碳点的荧光性质可以对其进行碳化。
目前,自下而上合成碳点的方法主要有热解法、微波辅助法和水热法。
1.2.1热解法
热解是一种简单且大规模制备碳点的方法[31-32],该方法制得的荧光碳点具有激发波长可调、pH可调和上转换荧光性能等优点。此外,碳点表面存在的羟基和羧基基团,使其具有较好的水溶性。Jia等[33]直接对抗坏血酸的水溶液加热到90 ℃,合成了重量超过6.0 g的碳点,其形状为粒径达(3.20±0.72) nm的球形,晶格间距为0.208 nm,具有很好的分散性。Wang等[34]以十八烯为溶剂,十六胺为钝化试剂,通过热解柠檬酸得到油溶性碳点;再改变反应溶剂和包覆试剂,又可制得水溶性碳点。
图2a为合成的油溶性碳点的荧光发射图,图2b和图2c分别是反应5 min和180 min后碳点的紫外与荧光发射谱。由图2a可以看出,在不同的激发波长下,碳点发出不同颜色的荧光。由图2b可以看出,随着激发波长的增大,荧光发射图的波峰发生红移,半峰宽(FWHM)为100 nm,远远大于其它半导体的量子点;此外,随着反应时间的延长,油溶性碳点的激发波长也变大。反应为5 min时,油溶性碳点只能在很窄的波长范围(340~480 nm) 内激发;反应为3 h时,激发波长范围变大并且显著地向长波长转变(340~560 nm)。同时,发射谱的强度也随之增大(图2c)。当激发波长为360 nm时,油溶性碳点的最高荧光产率达到53%,并且在两个月后也几乎不变。
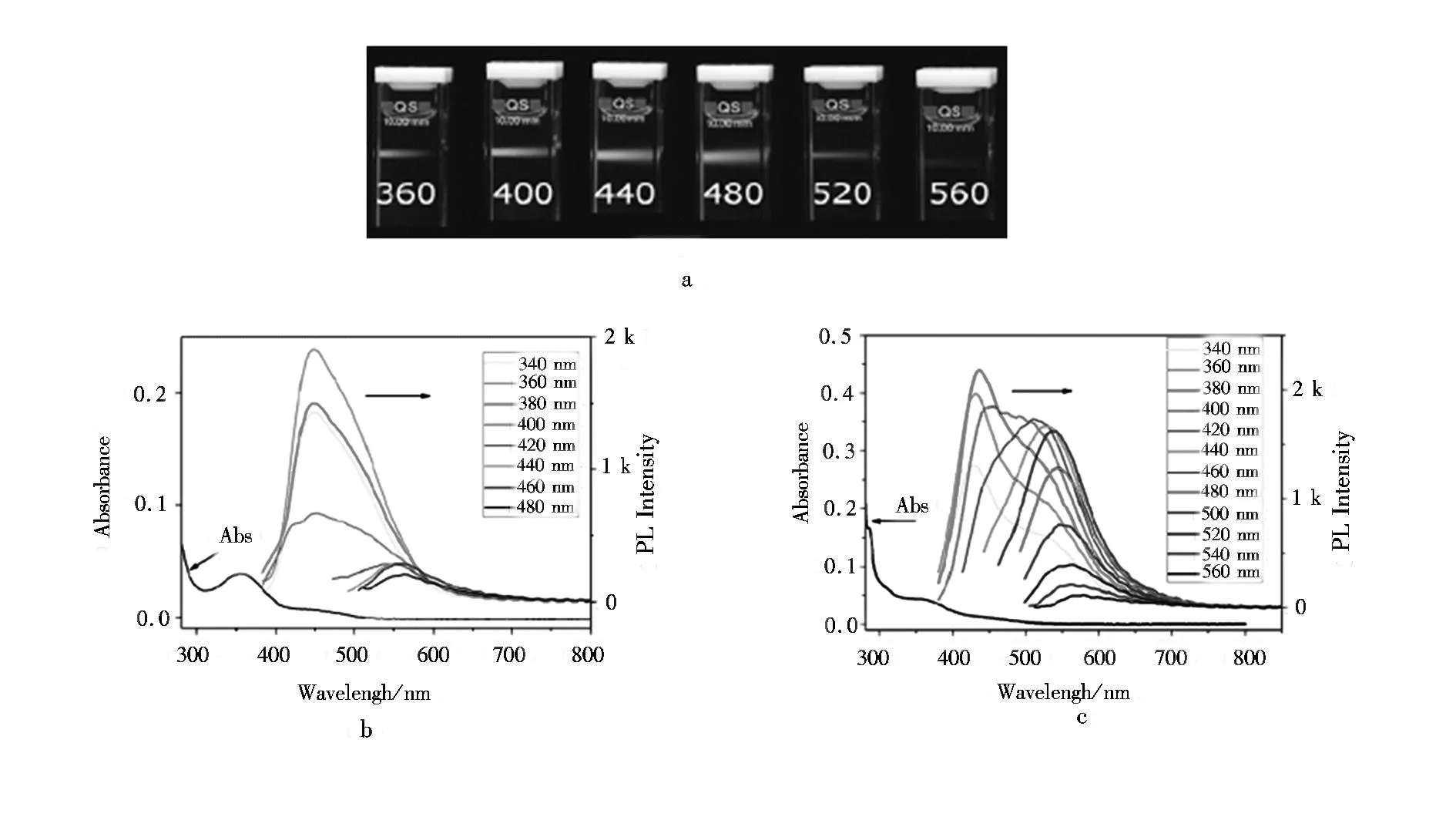
图2 (a)在激发180 min之后的油溶性碳点的图片[34];在反应5 min(b) 和180 min;(c)后的紫外和荧光发射谱Fig.2 (a)Photograph of the toluene solution of oil soluble CDs after a 180 min reaction excited by a fluorescent, and the absorption and photoluminescence emission spectra of the oil-soluble CDs reacted for (b) 5 min (c) 180 min.
1.2.2微波辅助法
微波因能集中高效的能量并节约反应时间,而吸引了研究者对微波辅助法合成碳点的广泛兴趣。Chowdhury等[35]用微波辅助法以壳聚糖凝胶为碳源合成了碳点,通过动态光散射(DLS)法测得其粒径为0.6~8.7 nm。该碳点荧光性能表现为:当激发波长从300 nm逐渐增加到400 nm时,碳点的发射波长逐渐红移,相应的荧光强度逐渐减弱。Safavi等[36]以离子液体OPPF6作为前体,用微波方法合成了碳点。在合成过程中,将与水不混溶的OPPF6离子液体置于试管内,放在微波炉里于450 W下加热2 min左右,离子液体逐渐由无色变为黄色,最后变为深棕色的碳点。该碳点的FWHM值为17 nm,比之前报道的大多数碳点的FWHM值要小,表明合成的碳点高度分散。通过高分辨率的透射电镜(HRTEM)观察,该碳点的平均大小为6 nm,晶格间距为3.22 Å,与石墨的002面相符。该碳点在pH值为4~9的溶液中,荧光强度比较稳定;以硫酸奎宁为参比,荧光量子产率为27%。
1.2.3水热法
水热法合成碳点的典型路线是把碳源混合液放进聚四氟乙烯反应釜中,在180~240 ℃的温度下放置数小时即可完成。在此合成过程不需要多步钝化与昂贵的试剂以及精密仪器[37-39]。Zhang等[40]以牛血清蛋白(BSA)为碳源,以4,7,10-三氧-1和13-十三烷二胺(TTDDA)为表面钝化剂和稳定剂,通过水热法合成了荧光量子产率为11%的碳点。该碳点量子产率是以硫酸奎宁为参比液计算得到的,其量子产率较高的原因是因为TTDDA的作用。TTDDA作为表面钝化剂不仅可以增强碳点的荧光性,还可以避免碳点在水热过程中聚集,形成较大的碳点颗粒。该碳点在360 nm激发时,在448 nm处有很强的荧光发射峰。Sahu等[23]以橘子汁为碳源,在较低的温度(120 ℃)下反应不到150 min,就得到高产量的绿色碳点,其荧光量子产率为26%。从碳点的HRTEM图像可以清晰地看出,该碳点是球形的且分散性很好;尺寸分布很窄(1.5~4.5 nm),以2.5 nm尺寸的碳点为最多;晶格间距0.18 nm,归因于石墨碳晶面。这种部分晶体结构的碳点荧光强度既强又稳定,并且随着激发波长和溶液pH值的改变而改变。高荧光性能的碳点可以通过对柠檬酸和乙二胺水处理得到,此方法制备出的碳点荧光产率高达80%[41]。
2影响碳点荧光性质的因素
碳点最显著的特点是它的荧光性能,碳点的荧光性能使其在生物成像和生物检测等方面应用广泛。目前,虽然碳点的荧光机理仍未研究透彻,但已有的研究表明:量子限域效应、原子结构/含氧基团、自由的弯折位置和/或边缘缺陷等与碳点的荧光性能有关,该方面的理论已被大多数研究者认同。
2.1 碳点尺寸对其荧光性能的影响
较大的碳粒子(例如平均粒径为30~50 nm)比较小的碳粒子荧光性能差,但其荧光量子产率却比较小的粒子高。所以,在碳点表面必然有一个能量量子限域,也就是说,碳点粒子要有足够大的表面体积比才能使粒子表现出强的荧光性能。用目前方法合成的碳点都是由不同尺寸粒子组成的混合物,其荧光谱图大多数是很宽的,发射谱覆盖了可见波长区域,甚至可以延伸到近红外区域[42]。因此,目前制备的碳点需要通过离心过滤设备进行超滤分离。Li等[43]通过柱层析法分离提纯了合成好的碳点,得到了尺寸分布窄的不同尺寸的碳点。图3a为其中4种尺寸类型的碳点在日光和紫外光照射下的光谱图。从图3a可以看出,碳点具有很强的荧光性;不同尺寸的碳点发射出不同颜色的光,在紫外光下分别呈现湖蓝色、绿色、黄色和红色;当分子量增加时,碳点的激发光谱和发射光谱都发生红移,表明荧光性质与碳点的量子尺寸有关。图3b为4种碳点在紫外光下的荧光曲线图,图中红色、黑色、绿色和蓝色荧光曲线分别对应于图3a中紫外灯辐射下湖蓝色、绿色、黄色和红色碳点的荧光谱。图3c为碳点尺寸与荧光性质的关系图。从图3c可以看出,1.2 nm的小尺寸碳点发射紫外光(350 nm左右);1.5~ 3.0 nm的中等尺寸的碳点发射可见光(400~700 nm);3.8 nm的大尺寸碳点发射紫外光(800 nm左右)。图3d为最高已占轨道(HOMO)与最低未占轨道(LUMO)间的带隙与石墨烯碎片尺寸的关系。从图3d可以看出,当碎片尺寸变大时,带隙逐渐减少。从直径为14~22Å石墨烯碎片可以得到可见光范围内的隙能,这与粒径低于3 nm的碳点可见光发射一致。因此,我们可以得出结论,碳点的强荧光发射来源于其自身量子尺寸的石墨烯结构。
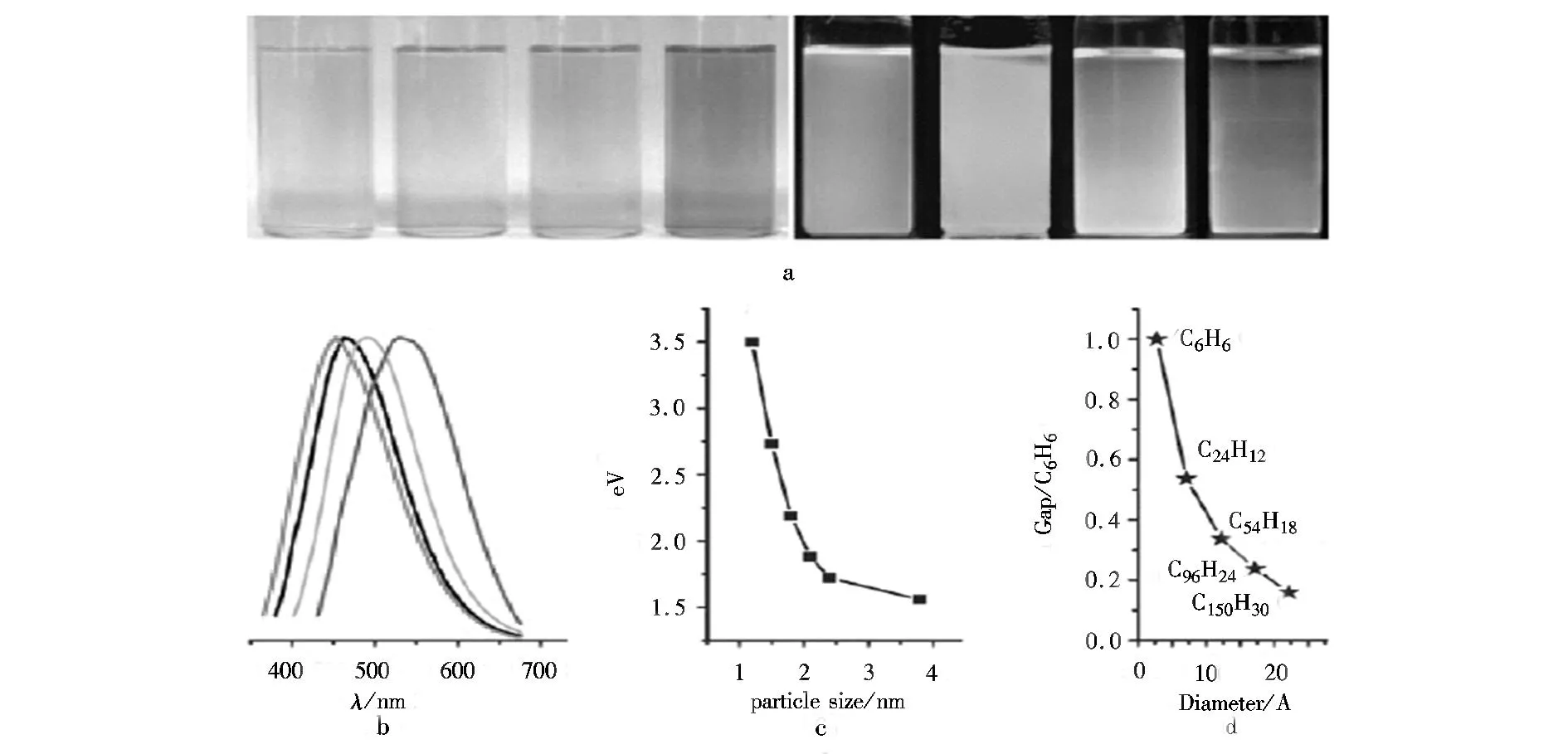
图3 (a)4种类型尺寸的碳点在日光(左边)和紫外光(右边:365 nm)下的光谱图[44];(b)4种类型尺寸的碳点在紫外光下的荧光曲线图[44];(c)碳点尺寸与荧光性质的关系图;(d)HOMO-LUMO隙能与石墨烯碎片大小的关系。Fig.3 (a)Typical sized CDs optical images illuminated under white (left; daylight lamp) and UV light (right; 365 nm). (b) PL spectra of typical sized CDs: the red, black, green, and blue lines are the PL spectra for blue-, green-, yellow-, and red-emission CDs, respectively. (c) Relationship between the CDs size and the PL properties. (d) HOMO-LUMO gap dependence on the size of the graphene fragments.
2.2 碳点表面结构对其荧光性质的影响
不仅碳点的尺寸会影响其荧光性质,碳点表面结构对其荧光性质也有很大影响。表面结构主要来自其表面氧化,表面氧化使碳点表面存在缺陷。不同的表面缺陷会有不同的发射峰位置,从而导致发射光谱强度发生变化。值得注意的是,碳点表面氧化程度越高,其表面缺陷越严重,从而捕捉到更多的激子,捕捉到的更多激子在其整个辐射过程即荧光发射过程会引起红移[44]。碳点表面没有带隙吸收,表面缺陷结构必须直接从基态获得。因此,激发态能量最有可能在缺陷(吸收和发射)间获得[45]。
3碳点的应用
3.1 细胞成像
Ray等[46]以硝酸氧化烟灰的方法制得碳点,并将其用于细胞成像。实验选取Ehrlich腹水癌细胞(EAC)作为研究对象。在接种癌细胞7 d后从成年雌性小鼠的腹腔内提取EAC,浓度大约为107个/mL。取1 mL上层悬浮液与0.01~0.1 mL的碳点溶液混合并培育30 min,置于转速为2 000 rpm/min的离心机中离心3 min,将得到的细胞溶于PBS。重复此操作2次,最终得到PBS细胞溶液。在载玻片上滴1滴此细胞溶液做成像实验,用Olympus IX71荧光显微镜观察并用DP70数码相机拍摄图片,如图4所示。从图4可以看出,细胞溶液在紫外激发下变为光亮的蓝绿色,在蓝光激发下变为黄色,而在未加入碳点溶液的对比实验中细胞是无色的。由此说明,细胞在紫外与蓝光激发下的颜色变化是由于其在碳点作用下自动发出荧光的结果。因此,利用纳米粒子的荧光性质可以通过普通的荧光显微镜在细胞内示踪碳点的位置。
3.2 生物检测
碳点已被广泛用于生物传感器检测DNA、维生素、碳水化合物和蛋白质,然而,作为荧光探针在生物分析检测中的应用却仍处于初期阶段。碳点由于其有机表面的可调谐功能,以及很好的荧光性和高稳定性,可以在生物传感器中作为荧光信号。下面主要从荧光共振能量转移(FRET)比率荧光传感器、电子转移比率荧光传感器以及其它新型的碳点灵敏生物传感器进行概述。
3.2.1FRET比率荧光传感器
FRET是供体分子被激发后将能量转移给受

图4 加入碳点(上排)与未加入碳点(下排)的 EAC细胞荧光对比图[46]Fig.4 Fluorescent CD-based labeling(up) and non-labeling(down) of EAC cells
体的非辐射过程。FRET因其作为传感的方便性以及业已形成的理论基础,被广泛应用于比率检测。在一个FRET过程中,以两个相互连接的荧光信号作为探针可以有效避免背景干扰和环境干扰。在以碳点为模板制备的FRET比率荧光传感器中,碳点不仅可以作为供体还可以作为受体[47]。图5为FRET比率荧光传感器示意图。Yu等[48]证明了碳点可以与有机染料构建FRET模式,并在水溶液、生物体内和细胞内检测H2S。该模式中碳点为供体,其检测H2S的机理是:制备传感器时,将萘二甲酸亚胺(用作H2S探针)共价耦合到碳点表面,当其与H2S特异性反应时,萘酰亚胺成为能量受体,并在425 nm附近有吸收峰,在526 nm附近有发射峰。该生物传感器具有很好的选择性和灵敏性,检出限可低至 10 nm。如果将上面传感器的能量受体换为NO,就可以制得检测NO的比率荧光传感器[49],该传感器可以在细胞内示踪NO,如HeLa细胞和L929 细胞。
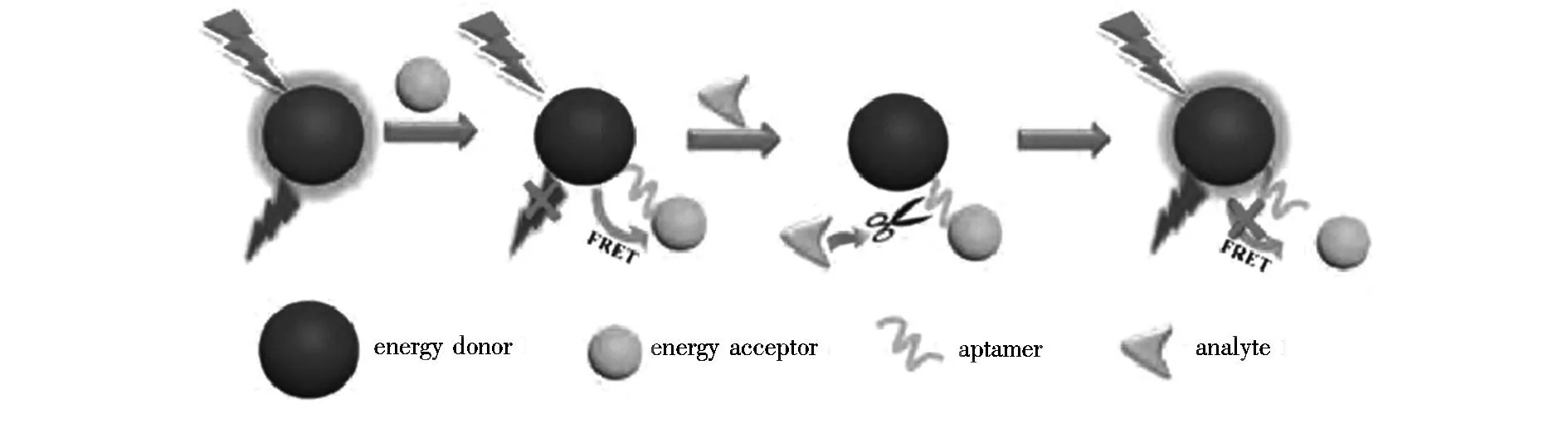
图5 FRET比率荧光传感器示意图Fig.5 Schematic illustration of the FRET ratiometric fluorescent biosensor
3.2.2电子转移比率荧光传感器
碳点之所以有超高的荧光性能是因为激子的辐射作用,然而,碳点的荧光可以被电子受体或者电子供体有效地猝灭,也就是说电子受体或者电子供体影响着激子的辐射。在电子转移(ET)过程中会有非辐射的电子-空穴对产生,如果碳点表面的电子转移过程被中断,碳点的荧光就会恢复。人们利用这种“off-on”的过程,成功地设计了基于碳点的生物分子传感器。Wang等[50]发现在大量铜离子存在的碳点溶液,碳点的荧光强度被猝灭;加入谷胱甘肽后,碳点的荧光又被部分地恢复;当加入谷胱甘肽的浓度从0.01~200 mmol/L逐渐增加时,碳点的荧光强度逐渐增强,并在100 mmol/L时趋于稳定。因此,通过荧光碳点的“off-on”效应可以实现对谷胱甘肽的检测。该传感器检测的线性范围是0.5~80 mmol/L,检出限是0.48 nm。Zong等[51]发现被铜离子猝灭的碳点荧光可以被L-半胱氨酸恢复,原因是L-半胱氨酸不仅能够阻隔碳点的荧光被铜离子猝灭,还能与铜离子结合,使其离开碳点表面从而恢复碳点荧光。由此,人们设计了检测L-半胱氨酸的传感器,该传感器检出限可低至0.34 nm。Du等[52]报导了检测碘的传感器,其原理是被汞离子猝灭的碳点荧光可以被碘化物恢复,因而可以据此检测碘化物。此生物传感器可应用于水溶液和尿液中检测碘。
3.2.3芬顿反应荧光传感器
生物检测是碳点最重要的应用领域之一。虽然已有许多基于FRET或ET过程的检测乙酰胆碱、葡萄糖的传感器,以及检测多巴胺和金属离子的生物传感报道,但这些研究几乎未被实际应用于生物检测中。这主要是因为在生物催化过程中包含对荧光特性的化学控制,以及碳点在常见的氧化还原介质如双氧水溶液中展现出较强的耐光性[53],限制了碳点的实际应用。Wei等[54]首次报导了以聚乙烯吡咯烷酮(PVP)合成了荧光性能好的水溶性碳点对羟基自由基的反应,打开了碳点在检测领域的应用。图6A为该碳点在H2O2(0.5
mmol/L)或 Fe2+(0.5 mmol/L)溶液中的荧光稳定性。从图6A可以看出,含0.5 mmol/L H2O2的碳点溶液在410 nm处的荧光强度几乎保持不变,含0.5 mmol/L Fe2+的碳点溶液也基本如此,表明碳点对H2O2和Fe2+是惰性的。图6B为碳点在加入0.338 mmol/L Fe2+和25 μmol/L H2O2后随时间变化的荧光猝灭图。由图6B可以看出,在H2O2和Fe2+同时存在的情况下,碳点荧光强度降低。由此可以猜想,碳点必须在H2O2和Fe2+同时存在的情况,其荧光才猝灭。在酸性条件下,H2O2与Fe2+反应生成羟基自由基(·OH),即芬顿反应,因此,很有可能是芬顿反应产生的·OH使得碳点荧光猝灭。基于此,人们成功地设计了检测H2O2的碳点生物传感器。该传感器在最优实验条件下,对H2O2的最低检出限是0.1 μmol/L。另外,人们还设计了以碳点为荧光探针轻松检测乙酰胆碱(Ach)和胆碱的环境友好且灵敏的生物传感器。图6C为该传感器对乙酰胆碱(Ach)和胆碱的检测图。由图6C可知,该传感器对胆碱的检测线性范围为0.1~40 μmol/L,检出限为0.1 μmol/L;对乙酰胆碱的检测线性范围是0.5~60 μmol/L,检出限为0.5 μmol/L。
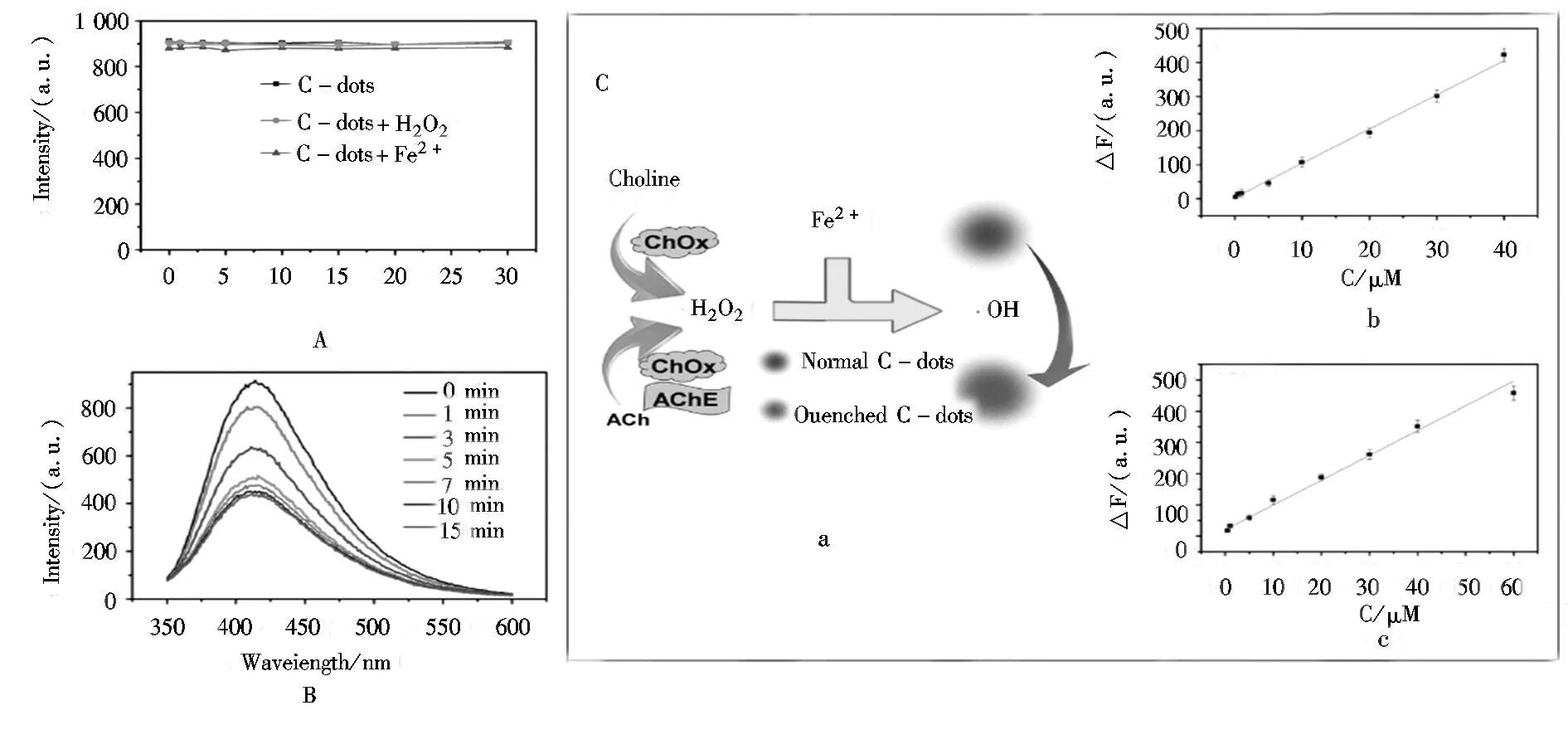
图6 (A)碳点在H2O2(0.5 mmol/L)或Fe2+(0.5 mmol/L)的荧光稳定性[55]。(B) 含H2O2(25 μmol/L)和Fe2+(0.338 mmol/L)的碳点溶液随反应时间的荧光变化图。(C)胆碱和Ach的检测;(a)以碳点为探针基于H2O2的检测机理图。(b)检测胆碱的线性图。(c)检测乙酰胆碱线的线性图。Fig.6 (A)Stability of CDs in the presence of H2O2 (0.5 mmol/L) or Fe2+ (0.5 mmol/L). (B)Time-dependent fluorescence changes of CDs in the presence of H2O2 (25 μmol/L) and Fe2+ (0.338 mmol/L). (C)Detection of choline and Ach; (a)the detection mechanism based on the detection of H2O2 using CDs as probes, (b)the detection curve of choline, and (c) the detection curve of Ach.
4结论与展望
碳点由于其独特的光学性质、低的细胞毒性以及良好的生物相容性成为生物领域不可或缺的新型纳米材料。目前,碳点的制备以及表面修饰技术已经达到成熟阶段,而碳点的生物应用却处于初级阶段,其应用主要集中于生物成像和生物检测领域。最新的研究报导将碳点用作生物荧光纳米载体,给碳点在生物领域的应用带来了新的希望。此外,随着碳点磁性响应性质的新发现,相信其在生物领域会有更多元的应用。
参考文献:
[1]Ute R G, Markus G, Sara C J, et al. Quantum dots versus organic dyes as fluorescent labels[J].Nat. Methods, 2008,5(9):763-775.
[2]He X, Tan L, Wu X, et al. Electrospun quantum dots/polymer composite porous fibers for turn-on fluorescent detection of lactate dehydrogenase[J].J. Mater. Chem., 2012,22(35):18 471-18 478.
[3]Wang X, Liu H, Chen D, et al. Multifunctional Fe3O4@P(St/MAA)@Chitosan@Au core/shell nanoparticles for dual imaging and photothermal therapy[J].ACS Appl. Mater. Inter., 2013,5(11):4 966-4 971.
[4]Zhao C, Yuan H, Wang X, et al. Cdse/Zns quantum dots with multi-shell protection: Synthesis and application in the detection of ractopamine residue in swine urine[J].Sci. Adv. Mater., 2013,5(3):285-294.
[5]Sun H, Zhang F, Wei H, et al. The effects of composition and surface chemistry on the toxicity of quantum dots[J].J. Mater. Chem.B, 2013,1(47):6 485-6 494.
[6]Li H, Zhu Y, Cao H, et al. Preparation and characterization of photocatalytic carbon dots-sensitized electrospun titania nanostructured fibers[J].Mater. Res. Bull., 2013,48(2):232-237.
[7]Zhang Y, Wang L, Zhang H, et al. Graphitic carbon quantum dots as a fluorescent sensing platform for highly efficient detection of Fe3+ions[J].RSC Adv., 2013,3(11):3 733-3 780.
[8]Ming H, Ma Z, Liu Y, et al. Large scale electrochemical synthesis of high quality carbon nanodots and their photocatalytic property[J].Dalton T., 2012,41(31):9526-9531.
[9]Yu B and Kwak S. Carbon quantum dots embedded with mesoporous hematite nanospheres as efficient visible light-active photocatalysts[J].J. Mater. Chem., 2012,22(17):8 345-8 353.
[10]Long Y, Zhou C, Zhang Z, et al. Shifting and non-shifting fluorescence emitted by carbon nanodots[J].J. Mater. Chem., 2012,22(13):5 917-5 920.
[11]Sun Y, Zhou B, Lin Y, et al. Quantum-sized carbon dots for bright and colorful photoluminescence[J].J. Am. Chem. Soc., 2006,128(24):7 756-7 757.
[12]Hu S, Niu K, Sun J, et al. One-step synthesis of fluorescent carbon nanoparticles by laser irradiation[J].J. Mater. Chem., 2009, 19(4): 484-488.
[13]Zhou J, Booker C, Li R, et al. An electrochemical avenue to blue luminescent nanocrystals from multiwalled carbon nanotubes (MWCNTs)[J].J. Am. Chem. Soc., 2007,129(4):744-745.
[14]Zheng L, Chi Y, Dong Y, et al. Electrochemiluminescence of water-soluble carbon nanocrystals released electrochemically from graphite[J].J. Am. Chem. Soc., 2009,131(13):4 564-4 565.
[15]Zhao Q L, Zhang Z L, Huang B H, et al. Facile preparation of low cytotoxicity fluorescent carbon nanocrystals by electrooxidation of graphite[J].Chem. Commun., 2008,41(41):5 116-5 118.
[16]Xu Z H, Yu J G, Liu G. Fabrication of carbon quantum dots and their application for efficient detecting Ru(bpy)32+in the solution[J].Sensor. Actuat. B, 2013,181(5):209-214.
[17]Bao L, Zhang Z, Tian Z, et al. Electrochemical tuning of luminescent carbon nanodots: From preparation to luminescence mechanism[J].Adv. Mater., 2011,23(48):5 801-5 806.
[18]De B and Karak N. A green and facile approach for the synthesis of water soluble fluorescent carbon dots from banana juice[J].RSC Adv., 2013,3(22):8 286-8 290.
[19]Liu H, Ye T, Mao C. Fluorescent carbon nanoparticles derived from candle soot[J].Angew. Chem. Int. Edit., 2007,46(34):6 593-6 595.
[20]Wang J, Sahu S, Sonkar S, et al. Versatility with carbon dots-from overcooked BBQ to brightly fluorescent agents and photocatalysts[J].RSC Adv., 2013,3(36):15 604-15 607.
[21]Khanam A, Tripathi S K, Roy D, et al. A facile and novel synthetic method for the preparation of hydroxyl capped fluorescent carbon nanoparticles[J].Colloid. Surface. B, 2013,102:63-69.
[22]Zhu C, Zhai J, Dong S. Bifunctional fluorescent carbon nanodots: green synthesis via soy milk and application as metal-free electrocatalysts for oxygen reduction[J].Chem. Commun., 2012,48(75):9 367-9 369.
[23]Sahu S, Behera B, Maiti T K, et al. Simple onestep synthesis of highly luminescent carbon dots from orange juice: Application as excellent bio-imaging agents[J].Chem. Commun., 2012,48(70):8 835-8 837.
[24]De B, Karak N. A green and facile approach for the synthesis of water soluble fluorescent carbon dots from banana juice[J].RSC Adv., 2013,3(22):8 286-8 290.
[25]Wang J, Wang C, Chen S. Amphiphilic egg-derived carbon dots: rapid plasma fabrication, pyrolysis process, and multicolor printing patterns[J].Angew. Chem. Int. Edit., 2012,51(37):9 431-9 435.
[26]Yin B, Deng J, Peng X, et al. Green synthesis of carbon dots with down- and up-conversion fluorescent properties for sensitive detection of hypochlorite with dual-readout assay[J].Analyst, 2013,138(21):6 551-6 557.
[27]Zhu L, Yin Y, Wang C, et al. Plant leaf-derived fluorescent carbon dots for sensing, patterning and coding[J].J. Mater.Chem. C, 2013,1(32):4 925-4 932.
[28]Qin X, Lu W, Asiri A, et al. Green, low cost synthesis of photoluminescent carbon dots by hydrothermal treatment of willow bark and their application as an effective photocatalyst for fabricating Au nanoparticles-reduced graphene oxide nanocomposites for glucose detection[J].Catal. Sci. Technol., 2013,3(4):1 027-1 035.
[29]Mewada A, Pandey S, Shinde S, et al. Green synthesis of biocompatible carbon dots using aqueous extract of Trapa bispinosa peel[J].Mater. Sci. Eng. C, 2013,33(5):2 914-2 917.
[30]Safavi A, Sedaghati F, Shahbaazi H, et al. Facile approach to the synthesis of carbon nanodots and their peroxidase mimetic function in azo dyes degradation[J].RSC Adv., 2012,2(19):7 367-7 370.

[32]Zhang R, Liu Y, Yu L, et al. Preparation of highquality biocompatible carbon dots by extraction, with new thoughts on the luminescence mechanisms[J].Nanotechnol., 2013,24(22):225 601-225 605.
[33]Jia X, Li J, Wang E. One-pot green synthesis of optically pH sensitive carbon dots with upconversion luminescence[J].Nanoscale, 2012,4(18):5 572-5 575.
[34]Wang F, Pang S, Wang L. Onestep synthesis of highly luminescent carbon dots in noncoordinating solvents[J].Chem. Mater., 2010,22(16):4 528-4 530.
[35]Chowdhury D, Gogoi N, Majumdar G. Fluorescent carbon dots obtained from chitosan gel[J].RSC Adv., 2012,2(32):12 156-12 159.
[36]Safavi A, Sedaghati F, Shahbaazi H, et al. Facile approach to the synthesis of carbon nanodots and their peroxidase mimetic function in azo dyes degradation[J].RSC Adv., 2012,2(19):7 367-7 370.
[37]Cao B, Yuan C, Liu B, et al. Ratiometric fluorescence detection of mercuric ion based on the nanohybrid of fluorescence carbon dots and quantum dots[J].Anal. Chim. Acta., 2013,786(13):146-152.
[38]Lu W, Qin X, Liu S, et al. Economical, green synthesis of fluorescent carbon nanoparticles and their use as probes for sensitive and selective detection of mercury(II) ions[J].Anal. Chem., 2012,84(12):5 351-5 357.
[39]Zhou L, He B, Huang J. Amphibious fluorescent carbon dots: one-step green synthesis and application for light-emitting polymer nanocomposites[J].Chem. Commun., 2013,49(73):8 078-8 080.
[40]Zhang Z, Hao J, Zhang J, et al. Protein as the source for synthesizing fluorescent carbon dots by a one-pot hydrothermal route[J].RSC Adv., 2012,2(23):8 599-8 601.
[41]Zhu S, Meng Q, Wang L, et al. Highly photoluminescent carbon dots for multicolor patterning, sensors, and bioimaging[J].Angew.Chem. Int. Edit., 2013,52(14):4 045-4 049.
[42]Li H, Liu R, Kong W, et al. Carbon quantum dots with photo-generated proton property as efficient visible light controlled acid catalyst[J].Nanoscale, 2014,6(2):867-873.
[43]Li H, He X, Kang Z, et al. Water-soluble fluorescent carbon quantum dots and photocatalyst design[J].Angew. Chem. Int. Edit., 2010,49(26):4 532-4 434.
[44]Sun Y, Wang X, Lu F, et al. Doped carbon nanoparticles as a new platform for highly photoluminescent dots[J].J. Phys. Chem. C, 2008,112(47):18 295-18 298.
[45]Wang X, Cao L, Yang S T, et al. Bandgap-like strong fluorescence in functionalized carbon nanoparticles[J].Angew. Chem. Int. Edit., 2010,49(31):5 438-5 442.
[46]Ray S, Saha A, Jana N, et al. Fluorescent carbon nanoparticles: synthesis, characterization, and bioimaging application[J].J. Phys. Chem. C, 2009,113(43):18 546-18 551.
[47]Shi H T, Wei J F, Li Q, etal. Fluorescent carbon dots for bioimaging and biosensing applications[J].J. Biomed. Nanotechnol., 2014,10(10):2 677-2 699.
[48]Yu C, Li X, Zeng F, et al. Carbon-dot-based ratiometric fluorescent sensor for detecting hydrogen sulfide in aqueous media and inside live cells[J].Chem. Commun., 2013,49(4):403-405.
[49]Yu C, Wu Y, Zeng F, et al. A fluorescent ratiometric nanosensor for detecting NO in aqueous media and imaging exogenous and endogenous NO in live cells[J].J. Mater. Chem. B, 2013,1(33):4 152-4 159.
[50]Wang Q, Liu X, Zhang L, et al. Microwave-assisted synthesis of carbon nanodots through an eggshell membrane and their fluorescent application[J].Analyst, 2012,137(22):5 392-5 397.
[51] Zong J, Yang X, Trinchi A, et al. Carbon dots as fluorescent probes for “off-on” detection of Cu2+and L-cysteine in aqueous solution[J].Biosens Bioelectron, 2013,51:330-335.
[52]Du F, Zeng F, Ming Y, et al. Carbon dots-based fluorescent probes for sensitive andselective detection of iodide[J].Microchim. Acta, 2013,180(5-6):453-460.
[53]Dong Y Q, Wang R X, Li, G L, et al. Polyamine-functionalized carbon quantum dots fluorescent probes for selective and sensitive detection of copper ions[J].Anal. Chem., 2012,84(14):6 220-6 224.
[54]Wei J, Ren J, Liu J, et al. An eco-friendly, simple, and sensitive fluorescence biosensor forthe detection of choline and acetylcholine based on C-dots and the fenton reaction[J].Biosens Bioelectron, 2014,52(4):304-309.
Carbon Dots for Bioimaging and Biosensing Application
CHEN Zhuo1,2,LIU Guoliang2,WANG Wei1,2
(责任编辑:孙新华)

Abstract:Because of the outstanding biocompatibility, carbon dots (CDs), which are attracting extensive attention as new nanosized carbon-containing fluorescent nanoparticles, have been used as probes for bioimaging and biosensing. Major advances have been made in the synthesis, structure, properties, mechanism of fluorescence, and evaluation of biocompatibility and bio-applications. Investigations of preparation methods, fluorescent properties and applications as biosensors and in bioimaging for carbon dots are stated. This review highlights on the design and construct of a carbon dot based fluorescent ratiometric biosensing system. Meanwhile, this review provides perspectives on future opportunities and application.
Keywords:carbon dots; fluorescent probe; bioimaging; biosensing; sensors;review
作者简介:陈卓(1991-),女,江苏宿迁人,硕士生,主要研究方向为光化学传感。
收稿日期:2015-03-15
中图分类号:O657.34
文献标识码:A
文章编号:1671-5322(2015)02-0049-10
doi:10.16018/j.cnki.cn32-1650/n.201502010

