苦参对铜绿假单胞菌生物膜干预作用的体外研究
苦参对铜绿假单胞菌生物膜干预作用的体外研究
宋鸿1,金瑛2,王明胜2
(1.遵义医学院 微生物学教研室,贵州 遵义563099;2.遵义医学院 医学与科技学院,贵州 遵义563099)
[摘要]目的 观察在体外苦参水煎液对铜绿假单胞菌(Pseudomonas aeruginosa,P.a)生物膜(Biofilm,BF)的影响及其与左氧氟沙星(Levofloxacin,LFX)的协同杀菌作用。方法 试管二倍稀释法测定药物的最低抑菌浓度(Minimum Inhibitory Concentration,MIC);将不同浓度苦参水煎液作用于P.a, 结晶紫染色法及激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)评价药物对菌株黏附力的影响;苦参水煎液单独或联合LFX作用于BF,采用连续稀释法计数及CLSM对BF进行分析。结果 苦参水煎液能抑制P.a的黏附力;与LFX联合作用后,BF内存活菌数明显减少(P ≤0.05)。结论 苦参水煎液能抑制P.a生物膜的形成,并可增强LFX对BF内细菌的杀菌作用。
[关键词]苦参;铜绿假单胞菌;细菌生物膜
在自然界中细菌常以浮游菌、菌落及生物膜(Biofilm,BF)3种形式存在,其中BF是细菌在自然界中生长最为普遍的一种模式。据美国CDC的统计,65% 的人类细菌性感染疾病都与BF的形成有关[1]。铜绿假单胞菌(Pseudomonasaeruginosa,P.a)是一种常见的医院感染条件致病菌,近年来研究发现该菌感染后在机体中常以BF的形式存在,BF的形成常使得P.a逃逸宿主免疫和抗菌药物的杀伤作用,导致临床治疗时间延长,易产生耐药[2]。中药是我国医药文化中的瑰宝,它的作用机理广泛,细菌对其不易产生耐药性,近年来有研究报告有些中药能抑制和破坏细菌BF的作用[3-6],这为临床治疗此类感染性疾病提供了一定的参考依据。本课题主要探讨苦参水煎液对P.a生物膜的影响,并与喹诺酮类抗菌药物左氧氟沙星联用后,对P.a的BF内细菌的抗菌活性影响,为临床中西医结合用药治疗P.a感染提供更多的实验依据。
1材料与方法
1.1菌株铜绿假单胞菌PAO1由遵义医学院微生物学教研室提供。
1.2主要试剂及仪器苦参为干烤的生药,由遵义医学院附属医院中药房提供。苦参水煎液按文献方法制备[7],生药浓度为1g/L,4 ℃保存,有效期为2周。LFX(扬子江药业,批号:12051431)。荧光DNA染料SYTO9/PI购自美国Molecular Probes公司。激光共聚焦显微镜(德国Leica公司),酶标仪318C(上海三科有限公司),麦氏比浊仪(法国生物梅里埃公司)。
1.3最低抑菌浓度MIC(Minimum Inhibitory Concentration,MIC)的测定参照临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)推荐的试管2倍稀释法确定苦参水煎液及LFX的MIC值。
1.4苦参水煎液对PAO1黏附性及BF形成的影响将细菌在LB液体培养基中培养过夜,用比浊仪将菌液调定为0.5麦氏单位,取10 μL加入到96孔板,立即加入不同浓度苦参水煎液,药物终浓度为1/8MIC、1/4MIC及1/2MIC,空白对照组则不加任何药物,于37 ℃培养箱中孵育。24 h后小心吸出培养液,用生理盐水冲洗2次,置通风处倒置,待风干后以每孔加入0.25g/L的结晶紫染液,室温下染色 20 min,用生理盐水冲洗3次,倒置风干后每孔加入95%乙醇150μL,10 min后检测其在570 nm波长处的吸光度值(A570)。同时将无菌盖玻片置于6孔板内,将不同浓度苦参水煎液与铜绿假单胞菌共同培养7 d,用SYTO9 /PI孵育,在氩激光(488 nm)激发下,CLSM观察苦参水煎液对BF形成的影响,SYT09呈绿色荧光,表征活菌,PI呈红色荧光,表征死菌[8]。
1.5苦参水煎液和左氧氟沙星对铜绿假单胞菌成熟生物膜的影响分空白对照组、1MIC苦参组、1MIC LFX组及1MIC苦参联合1MIC LFX组4组。将0.5麦氏单位的菌悬液稀释50倍,加入放置有无菌盖玻片的6孔板中,37 ℃培养7 d形成成熟生物膜,各组分别加入药物作用4、8、24 h后;取出盖玻片,用无菌生理盐水漂洗3次以充分洗脱浮游菌,将盖玻片放入装有10 mL无菌生理盐水离心管中,超声振荡10 min,使玻片表面的生物膜脱落到试管内形成菌悬液,再用连续稀释法进行活菌计数,重复3次计算平均值。同时将药物作用24 h后盖玻片用SYTO9 /PI孵育,CLSM观察生物膜的情况。
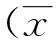
2结果
2.1药物的MIC测定试验菌株PAO1对苦参水煎液、LEV的MIC分别为64 mg/mL,10 μg/mL。
2.2苦参水煎液对铜绿假单胞菌黏附性的影响用吸光度A值表示苦参对P.a黏附性的影响,1/8MIC、1/4MIC及1/2MIC苦参组吸光度值分别为(0.274±0.149)、(0.243±0.129)和(0.178±0.095),与空白对照组(1.512±0.034)相比较,差异有统计学意义(P≤0.01)(见图1)。这表明1/8MIC、1/4MIC及1/2MIC苦参可抑制细菌黏附性。
苦参水煎液与P.a共同培养7d,经SYTO9 /PI染色,SYTO9标记的是活菌,呈绿色荧光;PI标记的是死菌,呈红色荧光;橙色或橘黄色荧光代表死菌和活菌重叠部分。图2可见,空白对照组整个视野大量细菌黏附平铺在载体上,细菌密集叠加在一起,有的呈片状(见图2 A)。苦参组仅有少量细菌黏附于载体(见图2 B、C、D)。
2.3成熟BF经不同组合药物作用后BF的改变及BF内的活菌数变化苦参水煎液单独使用对生物膜内细菌的影响与空白对照组相比较,差异无统计学意义(P>0.05)。与空白对照组相比较,LFX单独使用对生物膜内细菌有一定杀菌作用(P≤0.05),但苦参水煎液与LFX联用,能使生物膜内活菌数显著减少,与LFX相比较,差异有统计学意义(P≤0.05,见表1)。
*与空白对照组比较,P≤0.01。 图1 铜绿假单胞菌经不同浓度苦参作用后结晶紫半定量结果

A:空白对照组;B:1/2MIC苦参组;C:1/4MIC苦参组;D:1/8MIC苦参组。图2 苦参对铜绿假单胞菌黏附力的影响(×630)

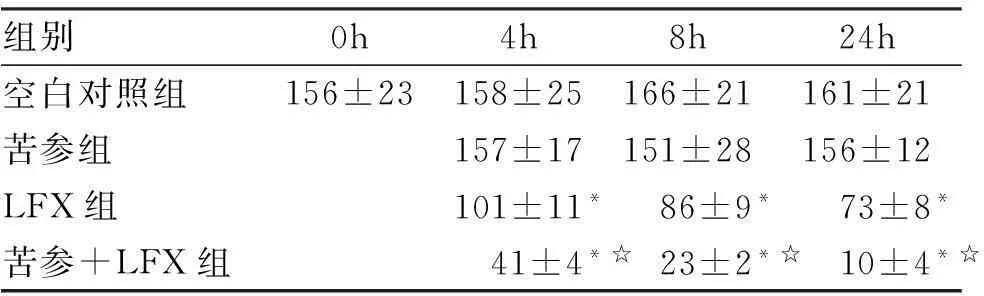
组别0h4h8h24h空白对照组156±23158±25166±21161±21苦参组157±17151±28156±12LFX组101±11*86±9*73±8*苦参+LFX组41±4*☆23±2*☆10±4*☆
*P≤0.05,与空白对照组比较;☆P≤0.05,LFX组比较。
CLSM观察(见图3),经SYTO9 /PI染色,可见空白对照组、苦参组载体上细菌黏附浓密,活菌量明显多于死菌量(见图3 A,B),LFE组、苦参与LFX联合组可见死菌量明显增多,呈红色荧光(见图3 C,D)。

A:空白对照组;B:苦参组;C: LEX组;D:苦参联合LFX组。图3 药物对成熟BF的影响(×630)
3讨论
苦参来源于豆科植物苦参的根,其主要有效成份为生物碱和黄铜类化合物,有清热解毒、祛风杀虫等作用。本研究结果显示,1/8MIC、1/4MIC及1/2MIC的苦参水煎液作用P.a,CLSM下可见空白对照组载体上有大量的细菌黏附聚集,形成成熟BF,而苦参水煎液组载体表面几乎没有BF形成,仅见散在极少数P.a黏附其上。这表明苦参对P.a黏附有抑制作用。通过结晶紫半定量实验可见对照组A570值>1.0,说明P.a生物膜形成能力较强,而各苦参水煎液组A570值均≤0.3,说明苦参抑制P.a形成生物膜。细菌黏附于物体表面是其生物膜形成的第一步。因此,苦参对P.a黏附力的抑制作用可能是其抑制BF形成的机制之一。
虽然蔬菜的腌制已经有非常悠久的历史,腌制的蔬菜深受人们的喜爱,但是这些腌制的食品中含有亚硝酸盐,亚硝酸盐的含量如果过高,人体在食用之后不仅会出现组织缺氧等现象,严重时还会引发癌变[6]。对食品中的亚硝酸盐进行具体测定时,需要与实际情况进行结合,将所有样品的温度控制在35℃以下,并且保证一定的干燥性。脂对亚硝酸盐含量测定的影响如表3所示。
CGF特殊的纤维蛋白网状结构,也是骨组织再生的基础。3D立体网格的结构可以增强上述生长因子渗透能力,促进干细胞的迁徒分化能力,加快细胞的增殖,使得骨的形成时间缩短,增加骨组织形成量。
研究显示铜绿假单胞菌PAO1在体外培养3d能形成早期BF,7d形成成熟BF[9]。有成熟BF包裹的P.a由于物理屏障的保护作用对环境因子的耐受性增强。此外,BF内细菌由于氧、营养物质等缺乏其代谢率降低,也导致BF内细菌对外界因子不敏感。因此,许多对浮游菌敏感的药物由于不能渗入BF内或渗入BF内的药物浓度降低,而不能发挥有效的抗菌作用。近年来研究发现单用1MIC或2MIC苦参水煎液不能有效杀灭生物膜内的细菌[10],而LFX虽然杀菌活性不依赖于细菌的生长率,其对BF也有一定的渗透力, 但单用LFX也只能杀灭BF内部分细菌[11]。本次研究选用成熟BF 的模型进行抗菌实验,研究发现苦参水煎液与LFX联合作用可见BF内活菌数量较单独用药组显著减少,提示苦参水煎液能有效增强LFX对BF的渗透性,对清除BF内P.a起到增效作用,这为临床中西医结合用药治疗P.a引起的相关性感染疾病提供了实验依据。但关于苦参对LFX增效作用机制还有待进一步研究。
[参考文献]
[1] Costerton J W,Stewart P S,Greenberg E P,et al.Bacterial biofilms:a common cause of persistent infections[J].Science,1999,284(5418):1318-1322.
[2] Tunney M M, Ramage G, Field T R, et al. Rapid Colorimetric Assay for Antimicrobial Susceptibility Testing ofPseudomonasaeruginosa[J]. Antimicrob Agents Chemother, 2004,48(5):1879-1881.
[3] 李军,陈卫民. 慢性难治性感染、细菌生物膜形成与中西医结合治疗[J]. 中医中药,2011,9(32):383-385.
[4] 曹林忠,党永生,张晓刚,等. 中药干预细菌生物膜形成的研究进展[J]. 中医正骨,2013,25(1):35-37.
[5] 穆海霞,陈俊清. 五倍子与阿奇霉素协同对金黄色葡萄球菌生物被膜的体外抗菌作用[J]. 国际检验医学杂志,2011,32(1):93-94.
[6] 向丽,李蓉,周铁军,等. 五倍子鞣质对生物被膜型白假丝酵母的干预作用[J]. 安徽农业科学,2012,40(27):13262-13269.
[7] 徐叔云. 药理实验方法学[M]. 第3版.北京:人民卫生出版社,2002:1647-1661.
[8] 陈波曼,余加林,刘官信,等. SYT09/PI荧光探针标记的铜绿假单胞菌PAO1菌株生物被膜形成的动态观察[J]. 第三军医大学学报,2008,30(5):390-392.
[9] 温红侠,陈一强,朱莲娜,等. 绿原酸对铜绿假单胞菌生物膜干预作用的体外研究[J]. 中华医院感染学杂志,2009,19(12):1478-1481.
[10] 周强,邓晨晖,张文,等. 苦参提取物与头孢他啶联用对铜绿假单胞菌生物被膜清除作用影响的体外研究[J]. 新中医,2008,40(12):98-99.
[11] 孔晋亮,刘晓岚,陈一强,等. 黄芩水煎液联合左氧氟沙星对铜绿假单胞菌生物被膜的影响[J]. 天津医药,2008,36(5):331-333.
[收稿2015-04-23;修回2015-05-28]
(编辑:谭秀荣)

Intervention of sophora flavescen aqueous-extracts onPseudomonasaeruginosabiofilm in vitro
SongHong1,JinYing2,WangMingsheng2
(1.Department of Microbiology, Zunyi Medical University,Zunyi Guizhou 563099,China;2.Medicine & Technology School Zunyi Medical University,Zunyi Guizhou 563099,China)
[Abstract]Objective To observe the inhibitory effects of sophora flavescen aqueous-extracts on biofilm of Pseudomonas aeruginosa and the synergism of bactericidal effect between sophora flavescen aqueous-extracts and levofloxacin (LFX) on biofilm of Pseudomonas aeruginosa in vitro.Methods Minimal inhibitory concentrations (MICs) were measured by doubling dilution. The effects of sophora flavescen aqueous-extracts at different concentrations on Pseudomonas aeruginosa adhesion were evaluated by crystal violet staining methods for biofilm quantitation and confocal laser scanning microscopy for biofilm formation. After the biofilm was treated by sophora flavescen aqueous-extracts, LFX and the combination of both, the effects on Pseudomonas aeruginosa biofilm were measured by serial dilutions for viable bacterial counts and observed through confocal laser scanning microscopy for biofilm destruction.Results Compared with control group, sophora flavescen aqueous-extracts groups inhibited Pseudomonas aeruginosa to adhere onto the surface of the object after incubation for 7 days. Combined with sophora flavescen aqueous-extracts, LFX obviously reduced the amount of viable bacteria on Pseudomonas aeruginosa biofilm compared with sophora flavescen aqueous- extracts or LFX alone (P ≤0.05).Conclusion Sophora flavescen aqueous- extracts can inhibit biofilm formation of Pseudomonas aeruginosa and enhance the bactericidal effect of LFX on Pseudomonas aeruginosa within biofilm in vitro.
[Key words]sophora flavescens; Pseudomonas aeruginosa;bacterial biofilm
[文献标志码][中图法分类号] R379 A
[文章编号]1000-2715(2015)03-0235-04
[基金项目]贵州省科学技术基金资助项目(NO:黔科合G字LKZ[2011]37);遵义医学院与科技学院大学生创新性实验计划项目(NO:[2011]1906)。

