淋球菌OmpA蛋白的克隆表达、保守性及抗原表位分析
淋球菌OmpA蛋白的克隆表达、保守性及抗原表位分析
黄健1,黄美容2,骆诗露3,肖质会3,聂鑫3,闵迅1
(1.遵义医学院附属医院 医学检验科,贵州 遵义563099;2. 遵义医学院附属医院 输血科,贵州 遵义563099;3.遵义医学院 医学检验系,贵州 遵义563099)
[摘要]目的 了解OmpA蛋白在不同型别淋球菌间的保守性,分析OmpA蛋白的B细胞抗原表位,并通过大肠杆菌表达系统获取其重组蛋白。方法 从Genebank数据库中获取不同型别淋球菌的OmpA蛋白氨基酸序列,利用ClustalX 2.1软件对序列保守性进行分析。利用DNASTAR软件预测分析OmpA蛋白B细胞抗原表位。构建ppSUMO-ompA重组表达载体,转化至大肠杆菌BL21(DE3)菌株中表达OmpA重组蛋白,以SDS-PAGE检测表达的重组蛋白。结果 OmpA蛋白在不同型别淋球菌菌株间保守性高达99.6%,OmpA蛋白抗原表位可能位于28-37、78-86、95-102、147-154、159-165、201-208、213-218等氨基酸区段。SDS-PAGE检测大肠杆菌中表达出OmpA蛋白,主要以包涵体形式存在。结论 成功构建ppSUMO-ompA重组表达载体,获得包涵体形式的OmpA蛋白,且OmpA蛋白可能是一种保守性较好的淋球菌蛋白疫苗候选分子。
[关键词]淋球菌;OmpA蛋白;原核表达;保守性;抗原表位
淋球菌(Neisseria gonorrhoeae,NG)是淋病的唯一病原体,其主要引起泌尿生殖系统化脓性感染[1]。资料显示,每年全球约有62 000 000新增淋病患者[2]。目前,淋球菌感染仍是严重威胁公共卫生安全的一种重要的性传播疾病。如何有效预防和控制淋病,成为全世界普遍关注的公共卫生问题。目前,抗生素是治疗其感染的主要手段,但随着淋球菌耐药菌株的广泛出现及播散[3],对其防治带来严峻挑战。近年研究显示,保守的淋球菌疫苗能诱导杀菌性抗体的产生,从而能有效地清除淋球菌感染[4]。因此,积极发展有效的淋球菌疫苗将成为预防和控制淋病的重要手段。
OmpA(outer membrane protein A)是淋球菌的一种外膜蛋白质,研究显示其在粘附和入侵宫颈癌细胞和子宫内膜细胞扮演了一个重要作用[5]。此外,在小鼠感染模型中,ompA基因敲除菌株与野生型菌株相比,其感染小鼠能力显著降低[5]。提示OmpA蛋白是淋球菌致病过程中的重要毒力因子,可能是一种较好的蛋白疫苗候选靶点。因此,本研究拟首先对其保守性进行分析,并对其B细胞抗原表位进行分析,最后通过大肠杆菌表达系统获取其重组蛋白,从而为下一步以OmpA蛋白为基础的疫苗研究奠定基础。
1材料与方法
1.1菌株及质粒淋球菌ATCC49226标准菌株,大肠杆菌DH5α和BL21(DE3)菌株,ppSUMO质粒为本课题组保存。
1.2主要试剂PrimerStar高保真DNA聚合酶、DNA marker、T4DNA连接酶、限制性内切酶EcoRI和XhoI、DNA片段纯化试剂盒、蛋白质分子量marker均购于大连TaKaRa公司;异丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素、LB培养基购于生工生物工程(上海)股份有限公司;质粒抽提试剂盒购于美国Omega公司;基因组DNA提取试剂盒购于北京天根公司。
1.3保守性分析本研究从Genebank数据库中获取不同型别淋球菌的OmpA蛋白氨基酸序列,以ClustalX 2.1软件对序列保守性进行分析。
1.4B细胞抗原表位预测利用DNASTAR Lasergene v7.1软件基于Kyte-Doolittle法、Karplus-Schulz法、Jameson-Wolf法、Emini法,分别对OmpA蛋白亲水性、可塑性、抗原指数、表面可能性进行分析,以预测OmpA蛋白B细胞抗原表位。
1.5引物的设计及合成用Primer Premier 5.0软件设计引物,上 游 引 物 F : 5'- GGAATTCATGACTTTCTTCAAACCCTC-3'(下划线为EcoRI酶切位点); 下游引物R: 5'- CCGCTCGAGTTACATGTGCCGTGCGGCGTT-3',(下划线为XhoⅠ酶切位点),引物由生工生物工程(上海)股份有限公司合成。
1.6ompA基因的扩增用基因组DNA提取试剂盒提取淋球菌DNA,并以此为模板扩增ompA基因,反应体系为50 μL:ddH2O 32 μL、5×PS Buffer 10 μL、dNTP Mixture 4 μL、淋球菌模板DNA 1.5 μL、上游引物F和下游引物R各1 μL、Prime Star酶0.5 μL。PCR反应条件:98 ℃ 20 s; 55 ℃ 15 s,72 ℃35 s,30个循环。PCR产物行1%琼脂糖凝胶电泳鉴定。将扩增成功的PCR产物按DNA纯化试剂盒说明书进行纯化。
1.7ppSUMO-ompA重组质粒的构建、筛选及鉴定将ppSUMO质粒和ompA基因片段用限制性内切酶EcoRI和XhoI进行双酶切,酶切条件:37 ℃,6 h,然后行1%琼脂糖凝胶电泳鉴定。按摩尔比5∶1比例将质粒和目的基因混合后,以T4 DNA连接酶16 ℃连接16 h。连接产物全部转化大肠杆菌 DH5α感受态细胞中,铺于含50μg/L卡那霉素的平板上筛选克隆。挑取单个克隆,行菌液PCR鉴定,阳性克隆过夜增菌后提取重组质粒行双酶切鉴定[6]。
1.8重组蛋白的诱导表达将重组质粒ppSUMO-ompA转化至大肠杆菌BL21(DE3)感受态细胞中,挑选、鉴定阳性克隆后,接种于LB培养液(含50 μg/L卡那霉素)中,37 ℃培养至光密度A600=0.5~0.6时,加入终浓度为0.2 mmol/L的IPTG,18 ℃诱导12 h,12 000×g离心10 min收集菌体,超声破菌后SDS-PAGE鉴定蛋白表达形式。
2结果
2.1OmpA蛋白保守性分析从Genebank数据库中获得不同型别淋球菌OmpA蛋白氨基酸序列:NG 19(登录号:EEZ46032.2)、NG MS11(登录号:EEZ48208.2)、NG F62(登录号:EFF40036.1)、NG NCCP11945(登录号:ACF30492.1)、NG FA 1090(登录号:AAW90192.1)、NG DGI2(登录号:EFE04719.1),对序列进行比对分析,结果显示OmpA蛋白在不同型别菌株间保守性达99.6%。

图1 不同型别淋球菌间OmpA蛋白保守性分析
2.2B细胞抗原表位分析从图2可见,4种基于亲水性、可塑性、抗原指数及表面可能性方法预测的OmpA蛋白B细胞抗原表位位置较为吻合,综合结果显示其较可能成为B细胞抗原表位的氨基酸区段为28-37、78-86、95-102、147-154、159-165、201-208、213-218。
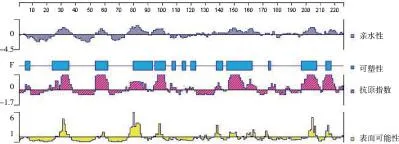
图2 OmpA蛋白B细胞抗原表位分析
2.3ompA基因扩增ompA基因PCR扩增产物行1%琼脂糖凝胶电泳分析,在675bp处可见单一条带,其大小与预期相符(见图3)。
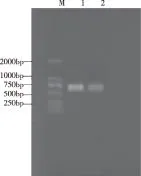
M:DNA Marker;1-2:ompA基因扩增产物。图3 PCR扩增omp A基因
2.4重组表达载体的构建ompA基因扩增产物克隆于ppSUMO质粒后转化大肠杆菌DH5α,得到多个克隆,经菌液PCR鉴定,第1、2、5、8、10、11、13号克隆为阳性克隆,其余克隆为假阳性(见图4)。ppSUMO-ompA重组质粒经EcoRI、XhoI双酶切,可见675bp大小的酶切片段(见图5)。

M:DNA Marker;1-13:不同克隆中ompA基因扩增产物。图4 菌液 PCR扩增ompA基因

M:DNA Marker;1:ompA基因对照;2:重组质粒ppSUMO-ompA双酶切产物。图5 ppSUMO-ompA重组质粒双酶切鉴定
2.5重组蛋白的诱导表达由图6可见,表达菌经IPTG诱导表达后可见一条明显增粗的蛋白条带,其相对分子量约为39.4kD大小,即等于23.4kD大小 Omp A蛋白与16kD SUMO标签蛋白的分子量之和,与预期相符。对超声破菌液分析显示,OmpA蛋白主要位于破菌液沉淀中,表明该蛋白主要以包涵体形式表达(见图6)。

M:蛋白质分子量marker;1:未诱导的空载菌;2:未诱导的表达菌;3:诱导的表达菌;4:表达菌超声破菌液;5:表达菌超声破菌液沉淀;6:表达菌超声破菌液上清。图6 Omp A重组蛋白表达SDS-PAGE鉴定图
3讨论
蛋白质疫苗以其具有保守性好、免疫原性好、生产成本低等优点,将成为未来淋球菌疫苗研究的重要方向。筛选保守有效的蛋白质疫苗对于未来淋球菌防治具有重要现实意义。目前,已发现一些蛋白质疫苗可以诱导宿主产生针对淋球菌的杀菌性抗体。如Por A蛋白诱导宿主产生的抗体水平与血清抗菌活性直接相关,由于其免疫原性及保守性好,是目前较好的疫苗候选靶点[7]。另外,最近研究显示NspA蛋白在小鼠模型中可以诱导产生特异性杀菌抗体及有效的调理吞噬作用[8]。但目前总体来说,淋球菌蛋白疫苗靶点的筛选进展还较缓慢,其中较为重要的原因是淋球菌可产生频繁的抗原变异,这对于筛选保守的蛋白疫苗靶点带来巨大挑战;此外,由于有效的抗生素治疗使得淋球菌疫苗研究投入减少[9]。但近年来的耐药监测发现,目前已有淋病奈瑟菌对临床使用的所有抗生素产生耐药抵抗的报道,对其治疗面临无药可用的危险[10]。因此,积极筛选保守有效的蛋白质疫苗对于未来淋球菌的防治有重要的理论与现实意义。
OmpA蛋白是淋球菌中的一种膜蛋白,在其致病过程中的发挥着重要作用。本研究首先对OmpA蛋白保守性进行分析,显示其在不同型别淋球菌间具有较高的保守性,提示其可能为较好的蛋白疫苗候选靶点。进一步利用DNASTAR软件对OmpA蛋白抗原表位分析,发现本研究选取的4种方法预测的抗原表位位置较为吻合,提示氨基酸区段28-37、78-86、95-102、147-154、159-165、201-208、213-218成为抗原表位的可靠性较大,这可为后续抗原表位鉴定奠定了结构基础。为获取以OmpA蛋白作为免疫原的蛋白疫苗,本研究通过原核表达系统对其蛋白进行重组表达。我们构建了ppSUMO-ompA重组质粒,并在大肠杆菌中成功大量表达出OmpA蛋白。对蛋白表达形式分析显示,其主要以包涵体形式表达。蛋白包涵体的形成受翻译速率、折叠速率等因素影响,当蛋白的翻译速率远大于折叠速率时,就容易导致产生错误折叠的空间构象而导致包涵体形成[8]。而重组蛋白表达过程中翻译速率、折叠速率又受多种因素的影响,如诱导剂浓度、摇床的转速、诱导温度等[11]。本研究分别采用不同诱导时间、不同诱导剂浓度、不同转速等表达条件,但均未获得以可溶形式表达的OmpA蛋白,这可能与载体在宿主表达菌株中的高水平表达有关。包涵体的致密结构可以形成空间屏障,阻止蛋白酶的水解作用,有利于重组蛋白的保留,且通过合适的变性复性条件,在多数条件下可以从包涵体中获得纯度达90%以上的重组蛋白[12]。因此,在下一步工作中,我们拟对包涵体进行纯化、变性、复性,以期获得纯度较好的可溶性免疫原,用于后续蛋白疫苗研究。
[参考文献]
[1] Roth A,Mattheis C, Muenzner P,et al.Innate recognition by neutrophil granulocytes differs between Neisseria gonorrhoeae strains causing local or disseminating infections[J]. Infect Immun,2013,81(7):2358-2370.
[2] Olsen B, Pham T L, Golparian D,et al.Antimicrobial susceptibility and genetic characteristics of Neisseria gonorrhoeae isolates from Vietnam, 2011[J]. BMC Infectious Diseases, 2013, 13(40):1-8.
[3] 黄健,黄美容,於薇,等.遵义地区淋病奈瑟菌多抗原序列分型及耐药性分析[J].临床检验杂志,2014,32(10):796-798.
[4] Gulati S,Zheng B,Reed G W,et al.Immunization against a saccharide epitope accelerates clearance of experimental gonococcal infection[J].PLoS Pathog,2013,9(8):e1003559. doi: 10.1371/journal.ppat.1003559.
[5] Serino L,Nesta B,Leuzzi R,et al.Identification of a new OmpA-like protein in Neisseria gonorrhoeae involved in the binding to human epithelial cells and in vivo colonization[J]. Mol Microbiol,2007 ,64(5):1391-1403.
[6] 姜婧怡,葛正龙.αA晶体蛋白基因启动子与HSP70融合基因表达载体的构建及鉴定[J]. 遵义医学院学报,2013,36(1):13-20.
[7] Holst J,Martin D, Arnold R, et al.Properties and clinical performance of vaccines containing outer membrane vesicles from Neisseria meningitidis[J]. Vaccine, 2009, 27(Suppl2):3-12.
[8] Li G,Jiao H,Jiang G,et al.Neisseria gonorrhoeae NspA induces specific bactericidal and opsonic antibodies in mice[J]. Clin Vaccine Immunol,2011,18(11):1817-1822.
[9] Jerse A E, Bash M C, Russell M W.Vaccines against gonorrhea: current status and future challenges[J]. Vaccine,2014,32(14):1579-1587.
[10] Blomquist P B,Miari V F,Biddulph J P,et al.Is gonorrhea becoming untreatable?[J].Future Microbiol,2014,9(2):189-201.
[11] 罗莉,何勇智,张勇侠,等.功能性包涵体的研究进展[J].中国生物工程杂志,2013,33(1):114-121.
[12] 于波,张其中.黄颡鱼免疫球蛋白 M 重链基因原核表达研究[J].生态科学, 2013, 32(1): 44-50.
[收稿2015-05-06;修回2015-05-26]
(编辑:王福军)
临床医学研究
Clone and expression of OmpA protein from Neisseria gonorrhoeae and analysis of its conservation and B cell epitopes
HuangJian1,HuangMeirong2,LuoShilu3,XiaoZhihui3,NiXin3,MinXun1
(1.Department of Laboratory Medicine,Zunyi Guizhou 563099,China;2.Department of Blood Transfusion,The Affiliated Hospital of Zunyi Medical University,Zunyi Guizhou 563099,China;3.Department of Laboratory Medicine ,Zunyi Medical University,Zunyi Guizhou 563099,China)
[Abstract]Objective To understand the conservation of OmpA protein among different , and to analyze the B cell antigen epitope of OmpA protein, and expression OmpA protein in E.coli. Methods Amino acid sequences of OmpA protein in different types of Neisseria gonorrhoeae were obtained from the Genebank database,The sequence conservation of OmpA proteins were analyzed using ClustalX 2.1 software. B cell antigen epitope of OmpA protein were predictively analyzed by DNASTAR software. Recombinant expression vector ppSUMO-ompA was constructed and identified. OmpA protein was expressed in E.coli BL21 (DE3) strains and recombinant proteins were analyzed by SDS-PAGE.Results The conservation of OmpA proteins among different types of Neisseria gonorrhoeae strain was up to 99.6%. The most possible epitopes of OmpA protein were located within or nearby its N-terminal NO.78-86, 28-37, 147-154, 159-165, 201-208, and 213-218. OmpA protein was successfully expressed in E. coli, and it mainly exists in the form of the inclusion body.Conclusion Recombinant expression vector ppSUMO-ompA was successfully constructed and inclusion bodies of OmpA protein were obtained. OmpA protein may be a good conservative vaccine candidate targets of Neisseria gonorrhoeae.
[Key words]neisseria gonorrhoeae;ompA protein;prokaryotic expression; conservative; antigen epitope
[文献标志码][中图法分类号] R378.1 A
[文章编号]1000-2715(2015)03-0261-05
[基金项目]国家自然科学基金资助项目(NO:81460317);贵州省科技厅资助项目(NO:2012GZ80958);遵义市科技局与遵义医学院附属医院联合基金(NO:遵义市科合社字[2014]72)。[通信作者]闵迅,男,博士,教授,硕士生导师,研究方向:细菌致病分子机制研究,E-mail:2815400619@qq.com。

