姜黄素对鱼藤酮损伤的多巴胺能神经元的保护作用
姜黄素对鱼藤酮损伤的多巴胺能神经元的保护作用
潘峰△
南阳市中心医院神经内科 南阳 473000
△男,1985年4月生,硕士,主治医师,研究方向:癫痫及神经系统变性病变,E-mail:pppfff850423@163.com
关键词姜黄素;鱼藤酮;内源性抗氧化酶;多巴胺能神经元
帕金森病(Parkinson′s disease,PD)是最常见的神经系统变性疾病之一。目前PD治疗以应用多巴胺的替代品左旋多巴或多巴胺受体激动剂为主,这些药物虽能有效缓解PD的临床症状,但长期用药会产生疗效减退、症状波动、运动及非运动并发症。原则上PD一旦被诊断就应及早予以保护性治疗,其目的是延缓疾病的发展、改善患者的症状。氧化应激在PD的进展过程中占有主导地位[1-2]。氧化应激损伤涉及氧化应激和抗氧化系统的失衡,早期给以抗氧化剂可能限制氧化损伤。姜黄素(curcumin,Cur)是从姜黄中提取的酚性色素,为姜黄的主要有效成分,具有抗氧化作用[3]。作者以鱼藤酮(rotenone,Ro)损伤大鼠肾上腺嗜铬细胞瘤细胞株PC12细胞为氧化应激损伤模型,观察Cur对损伤细胞的保护作用,为Cur对PD治疗的基础研究打下基础。
1材料与方法

1.2细胞模型的建立[4]PC12细胞(中国典型培养物保藏中心,武汉大学),在含PRIP 1640培养基(含体积分数10%马血清、体积分数5% FBS、2 mmol/L谷氨酰胺、双抗)塑料培养瓶中,37 ℃、体积分数5% CO2条件下培养。对数生长期细胞用含体积分数1% FBS的培养基进行饥饿培养,8 h后用含50 μg/L NGF、体积分数1% FBS的培养基培养,隔天2/3原体积换液。诱导7 d待细胞间长出网状纤维、形成类交感神经元细胞即为帕金森病细胞模型建立。
1.3MTT检测细胞活性对数生长期细胞按每孔1×104mL-1的密度种入96孔板内,每孔200 μL。设对照组,Ro组(1 μmol/L),Ro+0.5、1.0、2.5、5.0、10.0、20.0 μmol/L Cur组,0.5、1.0、2.5、5.0、10.0、20.0 μmol/L Cur组,每组设5个复孔。对数生长期细胞诱导7 d,Ro组加入1 μmol/L Ro,Ro+0.5、1.0、2.5、5.0、10.0、20.0 μmol/L Cur组加入1 μmol/L Ro和对应浓度的Cur,0.5、1.0、2.5、5.0、10.0、20.0 μmol/L Cur组只加入对应浓度的Cur,对照组只加培养基,培养24 h。每孔加5 g/L MTT溶液20 μL。继续孵育4 h后终止培养,吸尽孔内上清液,每孔加150 μL DMSO,振荡10 min。酶标仪在波长570 nm处读取吸光度(A)值。细胞活性=(A实验组-A空白组)/(A对照组-A空白组)。
1.4活性氧(reactive oxygen species,ROS)水平测定对数生长期细胞按每孔4×104mL-1的密度种入24孔板内,每孔600 μL。设Ro组、Cur组、Ro组+Cur组、(活性氧阳性)对照组,每组设4个复孔。对数生长期细胞诱导7 d,药物处理24 h后,离心弃上清,按ROS检测试剂盒说明进行操作后,按200 μL/孔加入96孔板,激发波长488 nm,发射波长535 nm,用荧光酶标仪检测荧光量,即为ROS水平。
1.5总谷胱甘肽含量测定对数生长期细胞按每孔4×104mL-1的密度种入12孔板内,每孔1.2 mL。设Ro组、Cur组、Ro组+ Cur组、对照组,每组3个复孔。对数生长期细胞诱导7 d,药物(1 μmol/L的Ro和Cur)处理24 h后,收集细胞,离心尽弃上清。按总谷胱甘肽检测试剂盒要求操作后,将96板中待测物在酶标仪下用波长412 nm测A值,即为细胞内总谷胱甘肽含量。

1.7统计学处理采用SPSS 16.0分析,各组细胞活性变化的比较采用单因素方差分析,各组细胞内ROS水平、总谷胱甘肽含量以及Nrf2蛋白表达量的比较采用2×2析因设计的方差分析,检验水准α=0.05。
2结果
2.1各组PC12细胞活性的变化见表1。

表1 各组PC12细胞活性比较
F=15.877,P<0.001;*:与对照组比较,P<0.05;#:与Ro组比较,P<0.05。
2.2各组PC12细胞内ROS水平见表2。

表2 各组PC12细胞内ROS水平
FRo=35.010,P<0.001;FCur=60.010,P<0.001;FCur×Ro=101.853,P<0.001。
2.3各组PC12细胞内总谷胱甘肽含量见表3。

表3 各组PC12细胞内总谷胱甘肽含量
FRo=35.481,P<0.001;FCur=53.371,P<0.001;FCur×Ro=37.781,P<0.001。
2.4各组PC12细胞胞质与胞核中Nrf2蛋白表达量见图1、2和表4、5。Ro组、对照组中Nrf2蛋白几乎全部定位在细胞质中,而Cur处理之后,细胞胞质中Nrf2蛋白量急剧减少,Nrf2几乎全部定位于胞核。Cur可激活Nrf2,使其从胞质移位于胞核。
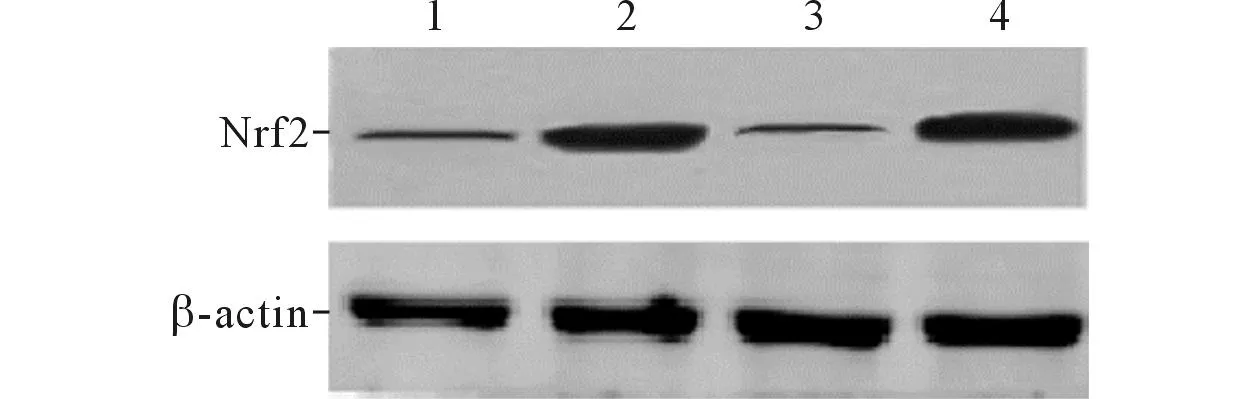
1:Cur组;2:Ro组;3:Cur+Ro组;4:对照组。图1 各组细胞胞质中Nrf2蛋白的表达

1:Cur组;2:Ro组;3:Cur+Ro组;4:对照组。图2 各组细胞胞核Nrf2蛋白的表达

RoCur+-+0.20±0.020.87±0.04-0.28±0.030.89±0.07
FRo=65.351,P<0.001;FCur=37.278,P<0.001;FCur×Ro=56.832,P<0.001。
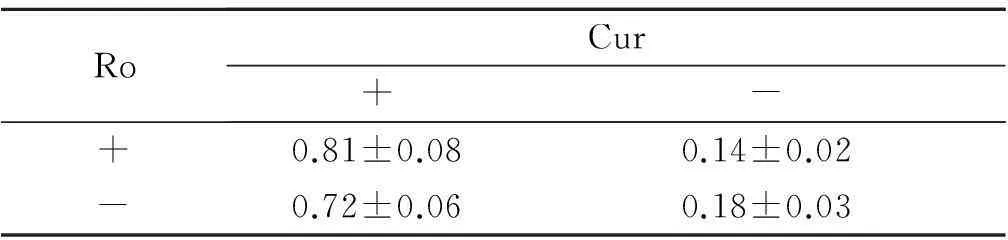
表5 各组细胞胞核中Nrf2表达水平的比较
FRo=38.721,P<0.001;FCur=54.321,P<0.001;FCur×Ro=72.241,P<0.001。
3讨论
Ro是一种从鱼藤胶中分离的化学物质,毒性很大,脂溶性很强,易穿过血脑屏障和细胞膜,穿过细胞膜进入细胞后在亚细胞器内发生聚集。研究[4]表明PC12细胞对Ro的作用较为敏感,10 nmol/L即可引起PC12 细胞凋亡,且随药物浓度的增加而增加,并在1 μmol/L Ro作用下出现半数致死[5]。张海娜等[6]用Ro成功地模拟了PD的两个主要特征:黑质DA 能神经元的变性死亡和胞质内Lewy小体的形成,即细胞凋亡和蛋白聚集,初步建立了Ro作用下PC12细胞损伤的PD细胞模型。在NGF的诱导下,PC12细胞向类似神经元方向分化,在形态、生理、生化及功能等方面接近于中脑的DA能神经元,被广泛应用于研究PD的细胞模型[7]。
PD是一种常见的神经系统变性疾病,其基本的病理特征为黑质致密部DA能神经元进行性变性、死亡。氧化应激被在PD的进展过程中占有主导地位。氧化应激是细胞氧化-抗氧化失衡而导致的应激损伤状态,在这种状态下细胞的抗氧化防御系统不能使ROS维持在非细胞毒性水平,当ROS的生成增加而其清除减少,或者对氧化修饰的大分子修复减少时,氧化应激就会发生[8]。DCFH-DA是一种自身不发荧光的化合物,它能自由透过细胞膜,被胞质内ROS氧化为荧光化合物DCF。DCF能发出很强的荧光,通过检测DCF的荧光强度,反映细胞内ROS水平。
Nrf2是转录因子家族成员,其调控作用通过抗氧化物反应元(antioxidant response elements,ARE)实现[9]。Nguyen等[10]发现Nrf2/ARE系统能够诱导机体产生抗氧化酶,从而增强了细胞清除ROS的能力,以此来维持细胞内氧化还原状态的平衡和降低氧化损伤。研究[11-12]结果提示,Nrf2/ARE信号通路对于多种类型细胞(胚胎成纤维细胞、肝细胞等)抵抗氧化应激介导的细胞毒性具有重要意义。Cur被证实在视网膜细胞、肝细胞中能通过激活Nrf2/ARE信号通路、诱导多种的表达,提高细胞内源性抗氧化能力,从而细胞发挥保护作用。Cur对MPP介导的PC12细胞的凋亡提供显著的细胞保护作用[13]。
在采用6-OHDA建立的PD动物模型中[14],Cur可抑制黑质酪氨酸羟化酶阳性细胞凋亡,并能维持纹状体的DA水平。潘静等[15]指出在建立的MPTP诱导的PD小鼠模型中,Cur可以有效地拮抗MPTP诱导小鼠黑质多巴胺能神经元的丢失,其机制可能与Cur降低黑质多巴胺能神经元活性氧含量以及抑制炎症反应等作用有关。然而,Cur在上述PD模型中的细胞保护机制是否与Nrf2/ARE信号通路活化有关,并未得到深入的研究。该研究结果显示:1.0 μmol/L Cur处理后, PC12细胞活性较Ro组增加最多,保护作用最强。作为外源性Nrf2诱导剂,Cur在低浓度范围内能通过激活Nrf2/ARE信号通路诱导细胞内抗氧化酶,主要是内源性抗氧化酶(还原性谷胱甘肽)的活性,清除细胞内ROS,发挥抗氧化作用,从而使ROS的产生与抗氧化的不平衡状态改善,从而减轻了Ro诱导的PC12 细胞的损伤,但随着浓度增加,保护作用降低,甚至起促氧化作用。总谷胱甘肽是脑组织内重要的非蛋白性抗氧化剂及氧化还原调节因子。研究[16]发现,Cur可以提高多巴胺能神经元细胞内的总谷胱甘肽水平,并经silico模型实验表明,这一效应是由Cur诱导的GCL基因转录上调所致。该研究结果表明,经Cur处理过的致损PC12细胞,Nrf2蛋白的表达主要出现在细胞核内,而对照组和Ro组中Nrf2蛋白的表达主要出现在细胞质内。
综上所述,Cur可能通过激活Nrf2/ARE信号通路发挥较强的抗氧化活性及细胞(包括神经元)保护作用。
参考文献
[1]中华医学会神经病学分会帕金森病及运动障碍学组.中国帕金森病治疗指南[J].中华神经科杂志,2009,42(3):352
[2]MILLER RL,JAMES-KRACKE M,SUN GY,et al.Oxidative and inflammatory pathways in parkinson′s disease[J].Neurochem Res,2009,34(1):55
[3]M KHOPDE S,PRIYADARSINI KI,VENKATESAN P,et al.Free radical scavenging ability and antioxidant efficiency of curcumin and its substituted analogue[J].Biophys Chem,1999,80(2):85
[4]胡丹,孙圣刚.鱼藤酮对大鼠嗜铬细胞瘤细胞PC12的毒性作用[J].神经损伤与功能重建,2008,3(5):298
[5]王翔宇,杨红卫,梅元武.姜黄素对多巴胺诱导PC12细胞凋亡的保护作用[J].西安交通大学学报(医学版),2013,34(1):115
[6]张海娜,胡国华,陈秋惠,等.帕金森病细胞模型的建立及鱼藤酮对多巴胺能神经元的毒性作用[J].吉林大学学报(医学版),2007,33(5):811
[7]WANG G,QI C,FAN GH,et al.PACAP protects neuronal differentiated PC12 cells against the neurotoxicity induced by a mitochondrial complex Ⅰ inhibitor, rotenone[J].FEBS Lett,2005,579(18):4005
[9]CHEN F,SHI XL.Intracellular signal transduction of cells in response to carcinogenic metals[J].Crit Rev Oncol Hematol,2002,42(1):105
[10]NGUYEN T,SHERRATT PJ,PICKETT CB.Regulatory mechanisms controlling gene expression mediated by the antioxidant response element[J].Annu Rev Pharmacol Toxicol,2003,43(2):233
[11]李强,赵曙光,王旭霞,等.姜黄素激活转录因子Nrf2对人肝细胞氧化应激的影响[J].胃肠病学和肝病学杂志,2010,19(2):154


[15]潘静,丁健青,陈生弟.姜黄素对帕金森病小鼠模型黑质多巴胺能神经元损伤的保护作用[J].中国现代神经疾病杂志,2007,7(5):447
[16]JAGATHA B,MYTHRI RB,VALI S,et al.Curcumin treatment alleviates the effects of glutathione depletion in vitro and in vivo: therapeutic implications for Parkinson's disease explained via in silico studies[J].Free Radic Biol Med,2008,44(5):907
doi:10.13705/j.issn.1671-6825.2016.02.034

