PKM2在肝癌组织中的表达及与临床病理特征的关系
芦东徽,于瀚卿,汪 勤,刘加涛,孙国平
(1.中国人民解放军第105医院肿瘤四科,安徽 合肥 230031;
2.安徽医科大学第一附属医院肿瘤科,安徽 合肥 230022)
PKM2在肝癌组织中的表达及与临床病理特征的关系
芦东徽1,于瀚卿2,汪勤2,刘加涛2,孙国平2
(1.中国人民解放军第105医院肿瘤四科,安徽 合肥230031;
2.安徽医科大学第一附属医院肿瘤科,安徽 合肥230022)
摘要:目的探讨M2型丙酮酸激酶同工酶(PKM2)在人肝癌组织与癌旁组织中的表达及其与临床病理特征之间的关系。方法采用免疫组化方法对手术确诊的144例肝癌及癌旁组织标本进行PKM2检测,并分析其表达与临床病理、生化之间的关系。结果肝癌组织中PKM2阳性表达为53.5%,癌旁组织中PKM2阳性表达为27.1%;PKM2的表达与γ-谷氨酰转移酶、碱性磷酸酶、肿瘤大小和分化程度呈显著相关(P<0.05),与性别、年龄、肝炎病史、肝硬化病史、甲胎蛋白、谷草转氨酶、谷丙转氨酶以及临床分期无显著相关(P>0.05)。结论PKM2在肝癌组织中的表达明显高于癌旁组织,且其表达与肝癌的肿瘤大小和分化程度密切相关,有望成为肝癌诊断的新指标及潜在的治疗靶点。
关键词:肝癌;M2型丙酮酸激酶同工酶;免疫组织化学法
原发性肝细胞癌(Hepatocellular carcinoma, HCC)在全球恶性肿瘤发病率中占第六位[1],第五常见的是男性肿瘤,第七常见的是女性肿瘤[2],每年新发病例564 000例,每年的死亡例数为30~50万[3-4]。在我国,原发性肝癌的发病率约为(70~80)/10万[5],肿瘤相关死亡率仅次于肺癌[6]。甲胎蛋白(AFP)作为肝癌的唯一肿瘤标志物,多用于术后监测和疗效评估,且有一部分病人敏感性不高。M2型丙酮酸激酶同工酶(PKM2)是一个重要的肿瘤启动和发展因子,通过调控Warburg效应影响癌症的发生、发展进程,在多种肿瘤组织中都有高表达[7-8]。将PKM2作为新的肿瘤标志物,对肿瘤进行诊断、动态监测及疗效评估等已成为目前国内外研究的热点[9-10],但PKM2与原发性肝癌的关系少见报道。我们通过制作肝癌组织及癌旁组织的组织芯片,采用免疫组化的方法检测PKM2在HCC病人肝癌组织及癌旁组织的表达,探讨其与HCC临床病理、生化特征的关系。
1对象与方法
1.1一般资料144例肝癌组织取自2001—2007年就诊于安徽医科大学第一附属医院的经病理证实为肝细胞癌的患者的病理标本作为肝癌组织,并取同一标本距癌组织边缘>5 cm且经HE染色证实无肿瘤细胞浸润、无明显细胞增生等病变的肝组织作为癌旁组织,制作组织芯片。病理确诊依据参照WHO诊断标准。排除标准为:患者于术前接受过任何形式的放疗和(或)化疗。144例病例中,男性119例,女性25例;年龄21~84岁,平均年龄50.93岁,中位年龄50岁;肿瘤大小(癌结节直径)≤5 cm者58例,>5 cm者86例;依据WHO诊断标准,高分化44例,中分化61例,低分化39例;依据UICC/AJCC(2010)分期标准,Ⅰ期3例,Ⅱ期111例,Ⅲ期26例,Ⅳ期4例。
1.2方法与试剂
1.2.1组织芯片的制备根据芯片微阵列的设计,提前制作TMA受体蜡块待用。病理蜡块切片经HE染色后在光镜下观察,选取最适宜的取材部位,使用组织芯片制作机在供体蜡块上打孔,孔径以1~1.5 mm为宜,并将其转移到提前准备好的受体蜡块中;依次选取所有标本,将构建好的芯片蜡块妥善固定,放入55℃温箱中加热10 min后室温下冷却,放入4℃冰箱中保存备用。
1.2.2免疫组化染色组织芯片制作4 μm连续切片,烤片后二甲苯脱蜡,梯度酒精水化,柠檬酸盐微波修复抗原,3%H2O2避光孵育封闭内源性过氧化酶,10%正常羊血清37℃封闭,PKM2兔抗人单克隆抗体4℃孵育过夜,复温后37℃孵育二抗,DAB显色,苏木素复染后中性树胶封片。阴性对照组一抗使用磷酸盐缓冲液(PBS)。
1.2.3主要试剂PKM2兔抗人单克隆抗体购自abcam公司(货号:ab154816),稀释溶度为1∶200;内源性过氧化物酶阻断剂、酶标羊抗小鼠/兔 IgG 聚合物、DAB 染色液、苏木素染液等均购自中杉金桥公司(货号:PV-6000-D)。
1.3结果判定PKM2染色采用半定量积分方法评定阳性表达:分别在肿瘤和癌旁组织中随机选择5个高倍视野,依据视野下染色强度和阳性细胞百分比联合评分。染色强度:未显色计为0分,弱阳性显色(淡黄色)计为1分,中等阳性显色(棕黄色)计为2分,强阳性显色(黄褐色)计为3分;阳性细胞百分比:未显色计为0分,小于25%计为1分,25%~50%计为2分,>50%计为3分。两项得分相乘结果≥3分为阳性表达,<3分为阴性表达。
1.4统计学方法所有数据使用SPSS 17.0软件进行统计学处理,应用χ2检验分析肝癌组织与癌旁组织中PKM2表达的差异,χ2检验或非参数检验分析PKM2与各临床病理特征之间的关系。以P<0.05为差异有统计学意义。
2.结果
2.1PKM2在肝癌和癌旁组织中的表达PKM2的阳性显色为黄色至棕褐色,主要定位于细胞浆,详见图1。 肝癌组织中PKM2阳性表达有77例(53.5%),阴性表达有67例(46.5%);癌旁组织中PKM2阳性表达有39例(27.1%),阴性表达有105例(72.9%);肝癌组织中PKM2的表达显著高于癌旁组织,差异具有统计学意义(χ2=28.283,P<0.001),见表1。

表1 PKM2在肝癌和癌旁组织中的表达

图1PKM2的阳性及阴性表达
注:A:肿瘤组织PKM2阳性表达(×100);B:肿瘤组织PKM2阳性表达(×400);C:肿瘤组织PKM2阴性表达(×100);D:肿瘤组织PKM2阴性表达(×400)。
2.2PKM2表达与肝癌临床病理特征的关系在肝癌组织中,PKM2的表达与临床病理特征的关系见表2。表2数据显示:PLM2的表达与性别(χ2=0.078,P=0.708)、年龄(χ2=0.009,P=0.923)、肝炎病史(χ2=0.102,P=0.749)、肝硬化病史(χ2=0.323,P=0.570)、甲胎蛋白(AFP)(χ2=0.235,P=0.628)、谷草转氨酶(AST)(χ2=1.51,P=0.469)、谷丙转氨酶(ALT)(χ2=3.295,P=0.069)以及临床分期(Z=-1.012,P=0.312)等临床病理特征无显著相关(P>0.05);而与γ-谷氨酰转移酶(γ-GT)(χ2=4.052,P=0.044)、碱性磷酸酶(ALP)(χ2=4.656,P=0.031)、肿瘤大小(χ2=4.197,P=0.041)和分化程度(Z=-4.130,P<0.001)等因素呈显著相关(P<0.05)。
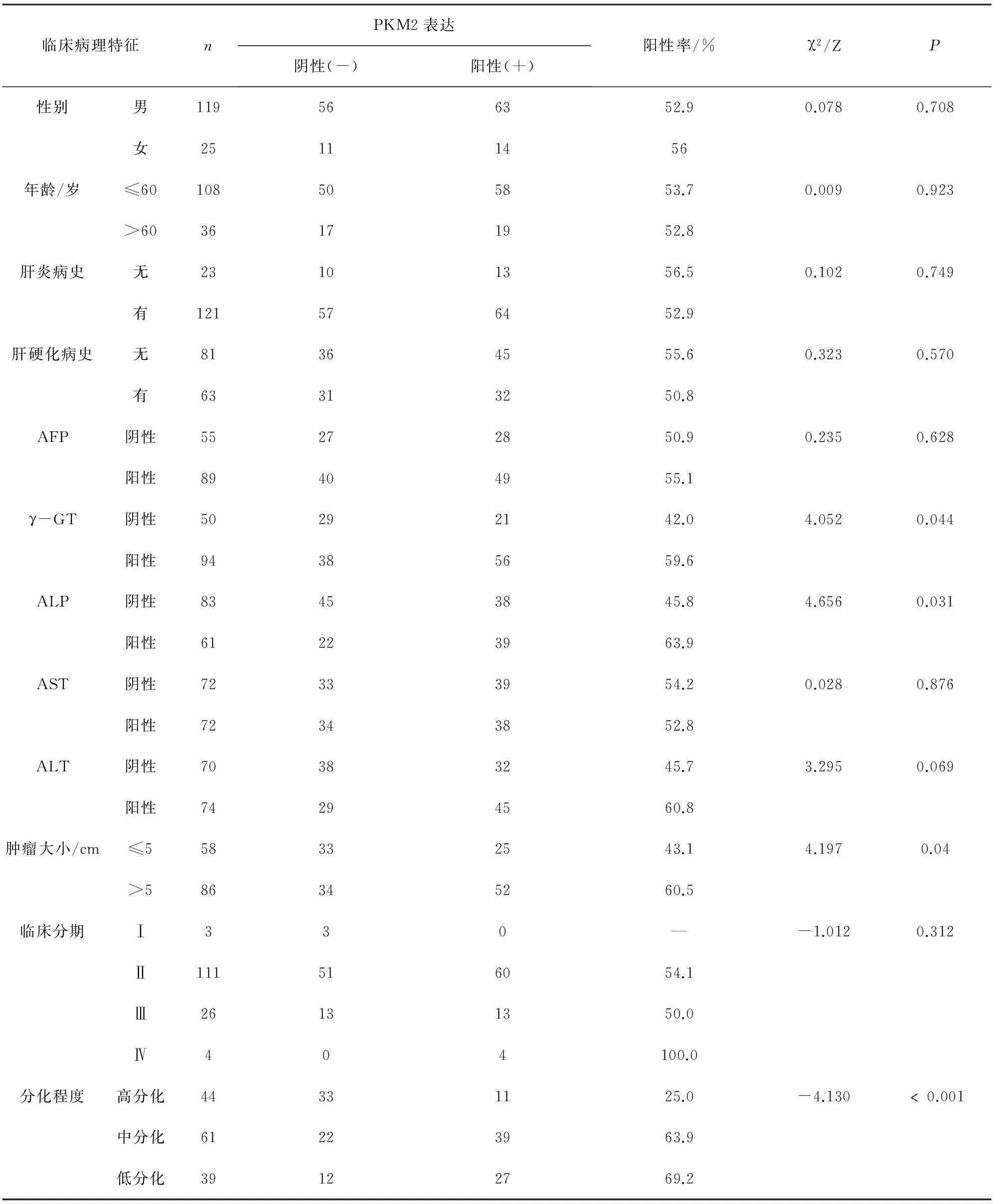
表2 PKM2表达与肝癌临床病理特征的关系
3讨论
肿瘤细胞即使在氧供应充足的条件下,仍主要采用产能效率较低的糖酵解方式进行葡萄糖代谢,而不是线粒体氧化磷酸化,这一有氧糖酵解代谢模式即Warburg效应[11]。丙酮酸激酶(pyruvate kinase,PK)是糖酵解途径的三个关键酶之一,主要功能是催化磷酸烯醇式丙酮酸生成丙酮酸。丙酮酸激酶共有L、R、M1、M2四种同工酶。研究发现,肿瘤细胞有氧糖酵解异常活跃与其PKM2高表达有关,PKM2高表达的细胞恶性度高,生长速度快,提示PKM2可以通过增强糖代谢而加速肿瘤细胞的生长,临床研究也证实胃、结肠、脑、肺等多种肿瘤组织均存在PKM2的高表达[12-16]。本研究发现,肝癌组织中PKM2阳性率为53.5%,而癌旁组织中PKM2阳性率仅为27.1%,肝癌组织中PKM2的表达显著高于癌旁组织,差异具有统计学意义(P﹤0.001),提示PKM2蛋白的表达可能与肝癌的发生、发展相关。
本研究对PKM2表达与HCC的临床病理特征进行了相关分析,研究结果显示PKM2的表达和患者的性别、年龄、肝炎和肝硬化病史均无明显相关性。进一步分析表明,分化程度与PKM2的表达呈现负相关,分化程度越差的患者PKM2表达越高(低分化表达率为69.2%,高分化表达率为25.0%),可能与肿瘤分化程度越低,增殖越活跃,对能量需求更高有关。由此也表明PKM2的高表达与肝癌细胞的增殖、侵袭及转移等恶性行为有密切联系。随着肿瘤体积的增大,能量需求随之提高,本研究结果也显示PKM2的表达与肿瘤大小具有相关性,直径>5 cm的肿瘤其PKM2表达明显高于<5 cm的肿瘤。
γ-GT和ALP广泛存在于机体的多种组织中。肝脏中γ-GT由肝细胞线粒体产生,局限于肝细胞浆及肝内胆管内皮细胞中,从胆道排泄,肝癌细胞的逆分化犹如胚胎期,使γ-GT增多。ALP由肝细胞合成分泌至胆道排泄,当肝细胞受损,胆管内压增高,可使肝脏合成增加,胆道排泄减少,血中ALP升高。本研究发现γ-GT和ALP高的患者PKM2表达高,且具有统计学差异,提示PKM2与肝癌患者肝功能受损的严重程度有一定的关系。
PKM2的表达与肿瘤的临床分期有关,本研究3例I期患者PKM2表达均为阴性,而4例IV期患者PKM2表达均为阳性,但由于样本量太少全组未出现统计学差异。
综上所述,人肝癌组织中的PKM2表达明显高于其癌旁组织,且与肿瘤大小和分化程度密切相关,提示PKM2的表达在肝癌的发生、发展中发挥重要作用。PKM2有望成为原发性肝癌的诊断标记物和重要的治疗靶点。
参考文献:
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012 [J].International Journal of Cancer,2015,136(5):E359-E386.
[2]Bosetti C,Turati F,La Vecchia C.Hepatocellular carcinoma epidemiology [J].Best Practice & Research Clinical Gastroenterology,2014,28(5):753-770.
[3]Shariff MI,Cox IJ,Gomaa AI,et al.Hepatocellular carcinoma:current trends in worldwide epidemiology,risk factors,diagnosis and therapeutics [J].Expert Rev Gastroenterol Hepatol,2009,3(4):353-367.
[4]Yang JD,Roberts LR.Hepatocellular carcinoma:a global view [J].Nat Rev Gastroenterol Hepatol,2010,7(8):448-458.
[5]Yuen MF,Hou JL ,Chutaputti A.Hepatocellular carcinoma in the Asia pacific region [J].Gastroenterol Hepatol,2009,24(3):346-353.
[6]汤钊猷.从肝癌看癌症临床研究 [J].肿瘤,2009,29(1):1-4.
[7]Hacker H,Steinberg P,Bannasch P.Pyruvate kinase isoenzyme shift from L-type to M2-type is a late event in hepatocarcinogenesis induced in rats by a choline-deficient/DL-ethionine-supplemented diet [J].Carcinogenesis,1998,19(1):99-107.
[8]Christofk HR,Vander Heiden MG,Wu N,et al.Pyruvate kinase M2 is a phosphotyrosine-binding protein [J].Nature,2008,452(7184):181-186.
[9]Kwon OH,Kang TW,Kim JH,et al.Pyrurate kinase M2 promotes the growth of gastric cancer cells via regulation of Bcl-xL expression at transcriptional level [J].Bioehem Biophys Commun,2012,423(1):38-44.
[10] Zhou CF,Li XB,Sun H,et al.Pyruvate kinase type M2 is upregulated in colorectal cancer and promotes proliferation and migration of colon cancer cells [J].IUBMB Life,2012,64(9):775-782.
[11] Vander Heiden MG,Cantley LC,Thompson CB.Understanding the Warburg effect:the metabolic requirements of cell proliferation [J].Science,2009,324(5930):1029-1033.
[12] Christolk HR,Vander Heiden MG,Harris MH,et al.The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth [J].Nature,2008,452(7184):230-233.
[13] Jung Y,Jang YJ,Kang MH,et al.Metabolic signature genes associated with susceptibility to pyruvate kinase,muscle type 2 gene ablation in cancer cells [J].Mol Cells,2013,35(4):335-341.
[14] Christofk HR,Vander Herden MG,Wu N,et al.Pyruvate kinase M2 is a phosphotyro-sine-binding protein [J].Nature,2008,45297(184):181-186.
[15] Bluemlein K,Gruning NM,Feichtinger RG,et al.No evidence for a shift in pyruvate kinase PKM1 to PKM2 expression during tumorigenesis [J].Oncotarget,2011,2(5):393-400.
[16] Liu Z,Feng JG,Tuersun A,et al.Proteomic identification of differentially-expressed proteins in esophageal can cer in three ethnic groups in Xinjiang [J].Mol Bio Rep,2011,38(5):3261-3269.
Expression of pyruvate kinase M2 in hepatocellular carcinoma and its clinical significance
LU Dong-hui1,YU Han-qing2,WANG Qin2,et al
(1.The4thtumorDiagnosisandTreatmentCenter, 105thHospitalofPLA,Hefei,Anhui230031,China.2.DepartmentofOncology,TheFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei,Anhui230022,China)
Abstract:Objective To explore the expression of PKM2 and clinical significance in hepatocellular carcinoma (HCC). Methods The expression of PKM2 in 144 surgically resected specimens of hepatocellular carcinoma cancer was evaluated by immunohistochemical, and the clinical and pathological features were further analyzed.Results The positive rate for PKM2 expression in hepatocellular carcinoma tissues and paraneoplastic tissues was 53.5% and 27.1%, respectively. The expression of PKM2 was positively correlated with tumor size, pathological grade and the expression of γ-GT and ALP(P<0.05). However, the expression of PKM2 was not correlated with the patients gender, age, hepatitis history, liver cirrhosis, AFP, AST, ALT and clinical stages(P>0.05). ConclusionsThe expression level of PKM2 in HCC tissues is significantly higher than the paraneoplastic tissues, and the expression of PKM2 was correlated with tumor size and pathological grade, suggested that PKM2 may serve as a valuable biomarker for diagnosing and a potential target for treating HCC.
Key words:hepatocellular carcinoma;PKM2;immunohistochemical
(收稿日期:2016-04-18)
doi:10.3969/j.issn.1009-6469.2016.04.024
通信作者:孙国平,男,教授,博士生导师,研究方向:肿瘤学,E-mail:sunguoping@ahmu.edu.cn
基金项目:国家自然科学基金项目(No 81572430)

