促渗肽协同抗癌药物作用于肿瘤细胞的生物活性评价
李晓晖,王燕云,田甜,汪晴Δ
(1.大连理工大学 生命科学与技术学院,辽宁 大连 116024;2.大连理工大学 制药科学与技术学院,辽宁 大连 116024)
促渗肽协同抗癌药物作用于肿瘤细胞的生物活性评价
李晓晖1,王燕云1,田甜2,汪晴2Δ
(1.大连理工大学 生命科学与技术学院,辽宁 大连 116024;2.大连理工大学 制药科学与技术学院,辽宁 大连 116024)
目的 探讨促渗肽TD-34协同抗癌药对几种肿瘤细胞活性的影响。方法 采用多肽固相合成法合成促渗肽TD-34,分别与抗癌药物盐酸阿霉素(DOX·HCl)和甲氨蝶呤(MTX)形成混合物,MTT法检测细胞毒性,倒置荧光显微镜和流式细胞仪定性和定量考察细胞对药物的吸收及保留情况。结果 与单独给药相比,TD-34与DOX·HCl混合处理后,MCF-7(人乳腺癌细胞)的细胞存活率由67.0%下降为21.5%,细胞吸收增加了26.7%,24 h后的吸收强度仍有50.4%;Caco-2(人结肠腺癌细胞)的细胞存活率为48.5%,细胞吸收提高了8.6%,24 h后的吸收强度仍有44.0%。TD-34与MTX混合处理后,非抗性细胞系MCF-7以及抗性细胞系MDA-MB-231(人乳腺癌细胞)的细胞存活率分别由65.6%降为37.8%、96.0%降为48.3%,Caco-2的细胞存活率下降了30.0%以上。结论 促渗肽TD-34可增强药物对细胞的毒性,克服癌细胞的耐药性,增加药物的细胞吸收和保留时间,是抗癌药的有效促渗剂。
促渗肽;固相合成;耐药性
一般的抗癌药物由于靶向性差、药效低、易产生耐药性等问题达不到理想的治疗效果,为了解决这些问题,设计和报道了很多输送药物系统[1-2]。促渗肽作为生物类促渗剂,是一类少于30个氨基酸残基的短肽,能携带多肽、蛋白质、核酸、纳米颗粒以及其他生物活性分子穿透细胞膜或皮肤,发挥生物学作用[3]。因其具有入胞速度快,转导效率高,生理状态下稳定、无毒、无免疫性等优势,为药物输送开辟了一条崭新途径,在细胞生物学、基因治疗以及药学等领域具有一定研究价值[4]。促渗肽与药物作用的方式主要有物理混合[5]、共价连接[6]、形成融合蛋白[7]和修饰药物载体[8]等。
促渗肽TD-1(ACSSSPSKHCG)是具有11个氨基酸残基的环肽,能够携带大分子胰岛素通过透皮给药方式来降低体内血糖浓度,从而达到治疗糖尿病的效果[9],还有研究证明TD-1能帮助siRNA[10]、A型肉毒神经毒素[11](BoNT-A)完成透皮作用。本课题组之前以TD-1为模板设计合成的TD-34(ACSSKKSKHCG),表现出更好的跨膜转运和经皮促渗活性[12]。TD-34作为透皮肽,主要用于经皮给药研究,本文旨在探讨 TD-34 的细胞促渗活性。
盐酸阿霉素(Doxorubicin hydrochlorid,DOX·HCl)和甲氨蝶呤(Methotrexate, MTX)是目前临床上常用的2种抗癌药物,化学结构如图1,因其不良反应大、口服吸收差以及耐药性的产生限制了他们的临床应用,耐药性的产生主要是由药物入胞减少或细胞的主动外排导致的[13],因此,克服盐酸阿霉素和甲氨蝶呤的耐药性,促进其细胞吸收,胞内积累及保留对肿瘤的治疗具有重要意义。

图1 盐酸阿霉素和甲氨蝶呤的化学结构Fig.1 Structures of doxorubicin hydrochloride and methotrexate
1 材料与方法
1.1 材料
1.1.1 细胞:人乳腺癌细胞MCF-7、MDA-MB-231,人结肠腺癌细胞Caco-2来自中科院上海细胞库。
1.1.2 实验试剂:Wang树脂、保护氨基酸、缩合试剂HOBt、 HBTU 、DIEA、BOP、DCC、DMAP(上海吉尔生化有限公司);Sephadex LH-20(Amersham瑞士公司); DMEM、胰蛋白酶、双抗、优级胎牛血清(美国Hyclone公司);MTT(美国Amresco公司);盐酸阿霉素DOX·HCl(大连美仑生物有限公司);甲氨蝶呤MTX(上海化成工业发展有限公司);色谱纯试剂(美国TEDIA公司);分析纯试剂(天津科密欧化学试剂公司)。
1.1.3 实验仪器:Waters 2487型双波长检测高效液相色谱仪(美国Waters公司);电喷雾电离质谱仪器(美国惠普公司);冷冻干燥机(美国Labcono公司);低温离心机(德国赛默飞世尔仪器有限公司);BD FACSCalibur流式细胞仪(美国BD公司);XDS-IB倒置荧光显微镜(重庆光电光学仪器有限公司);二氧化碳培养箱(美国Heraeus公司);SpectraMax Plus 384酶标仪(美国Molecular Devices公司)。
1.2 方法
1.2.1 促渗肽的合成
① Fmoc-Gly-OH导入Wang树脂: Wang 树脂溶胀30 min后加入Fmoc-Gly-OH(1 eq)、DCC(3 eq)、DMAP(0.5 eq),常温搅拌15 h,得到Fmoc-Gly-Wang树脂。
② 促渗肽合成:加入20%哌啶/DMF,室温搅拌30 min,脱除Fmoc保护基后,加入Fmoc-AA-OH(3 eq)、HOBt(3 eq)和HBTU(3 eq)溶于DMF中,加入DIEA(5 eq),室温下搅拌1 h,反应由Kaiser法监测,反应重复进行直至合成所需肽段,TFA裂解树脂,得到直链肽段。采用碘氧化法形成二硫键,冷冻干燥得到TD-34粗产品。用Sephadex LH-20 对粗肽进行纯化,洗脱液为DMF,HPLC分析,冰乙醚沉淀,真空干燥。
③ 结构分析:用RP-HPLC分析促渗肽的纯度,色谱柱为Chromolith RP-18e (5 μm, 250 mm×4.6 mm),流动相A:0.1%TFA/水,流动相B:0.1%TFA/乙腈,洗脱梯度B为10%~100%15 min,流速为1 mL/min,检测波长为220 nm,进样量为10 μL。用电喷雾电离质谱(ESI-MS)检测产物相对分子量。
1.2.2 细胞培养:MCF-7、MDA-MB-231培养在含有10% 胎牛血清、100 IU/mL青霉素和100 μg/mL 链霉素的DMEM培养基中,37 ℃、5%CO2条件下培养;Caco-2细胞在含有10%胎牛血清、1%非必须氨基酸、2 mmol/L谷氨酰胺、100 IU/mL青霉素和100 μg/mL 链霉素的DMEM培养基中,37 ℃、5%CO2饱和湿度条件下培养,每周更换3次培养基,细胞长满培养瓶底约80%后,按1:3进行传代。
1.2.3 MTT法检测抗肿瘤活性:抗肿瘤活性的检测选择MCF-7(人乳腺癌细胞),MDA-MB-231(人乳腺癌细胞)和Caco-2(人结肠腺癌细胞)3种细胞系。取对数期细胞,以1×104个/孔的密度接种于96孔板,过夜培养待细胞贴壁,去除完全培养基,替换为含不同药物浓度的无血清培养基,每孔加200 μL,每个浓度重复3次。培养箱中孵育24 h,加20 μL MTT溶液(5 mg/mL),培养4 h。去除MTT,加200 μL DMSO,酶标仪检测570 nm OD值,计算存活率。
1.2.4 定性检测细胞吸收:取对数生长期 MCF-7、Caco-2细胞,以密度为1×105个/孔接种于12孔板,每孔加完全培养基1 mL,过夜培养待细胞贴壁,去除完全培养基,更换为含药的新鲜培养基(DOX·HCl,DOX·HCl+TD-34)1 mL培养2 h后,用冷的PBS清洗3次。置于倒置荧光显微镜下,观察DOX发出的红色荧光的强弱,定性比较不同处理组细胞对DOX·HCl的摄取情况。
1.2.5 定量检测细胞吸收:取对数生长期MCF-7细胞,以密度为1×106个/孔接种于6孔板,每孔加完全培养基2 mL。过夜培养待细胞贴壁,去除完全培养基,更换为含药的新鲜培养基(DOX·HCl,DOX·HCl+TD-34)1 mL培养2 h。用冷的 PBS 清洗2次。0.25%胰酶/0.53 mM EDTA消化1 min,800 r/min离心3 min,弃上清,PBS 清洗3次,200 μL PBS 悬浮细胞。流式细胞仪检测荧光吸收,激发波长为488 nm,吸收波长为575 nm。通过FlowJo软件对数据进行整合,比较不同处理组的吸收强度。
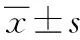
2 结果
2.1 促渗肽合成 TD-34经Sephadex LH-20分离纯化后,反相高效液相色谱检测纯度为97%,保留时间为2.827 min,ESI-MS检测[M+H]+为1133.4,与计算值1132.5一致,证明成功合成了目的物。
2.2 抗肿瘤活性检测 MTT结果显示促渗肽TD-34对肿瘤细胞无明显毒性作用,TD-34与DOX·HCl混合给药后,提高了DOX·HCl对MCF-7以及抗性细胞系模型Caco-2的细胞毒性,存活率分别由67.0%下降为21.5%,86.0%降为71.9%。TD-34与MTX混合给药后提高了MTX对MCF-7以及抗性细胞系 MDA-MB-231 的细胞毒性,存活率分别由65.6%下降为37.8%,96.0%降为48.3%,且对抗性细胞的作用效果更明显。见表1。

表1 肿瘤细胞存活率的比较
*P<0.05,**P<0.01,与单独药物处理组比较,compared with doxorubicin or methotrexate alone;-:未处理组,untreated group
2.3 不同摩尔比的混合物对Caco-2细胞活性的影响 从表1可以看出,混合处理后,Caco-2的细胞活性下降不如其他组肿瘤细胞明显,与单独药物处理相比,细胞存活率只下降了15%左右。改变混合物中药物和促渗肽的浓度,考察不同摩尔比的混合物处理后Caco-2的细胞活性。
结果如图2所示:DOX·HCl对Caco-2几乎无毒性作用,即使将DOX·HCl的浓度提高到100 μM,细胞存活率仍在80%以上,说明以Caco-2作为DOX·HCl的抗性细胞系模型是可行的。当混入TD-34后,毒性有所提高,细胞存活率最低可达到48.3%,同样地,MTX对Caco-2的抑制率只有19.0%,当MTX为10 μM时,混入TD-34后,细胞存活率下降了10%~20%;但当MTX为100 μM时,细胞存活率显著下降了30%以上。表明对于Caco-2细胞,TD-34对MTX的促渗作用较DOX·HCl更明显,且加入低浓度的TD-34就可起到促渗作用。

图2 不同摩尔比混合物处理后的Caco-2细胞活性(n=3)Fig.2 Viability of Caco-2 cells which were treated with mixtures in different mixture ratio(n=3)
2.4 DOX·HCl及混合物细胞摄取定性分析 结果显示,MCF-7细胞对照组无红色荧光,与DOX·HCl处理组相比,混合物组处理2 h后荧光较强且主要分布在细胞膜周围,说明TD-34促进了DOX·HCl的细胞吸收,且主要通过与细胞膜的相互作用完成促渗。处理24 h后,DOX·HCl处理组几乎观察不到荧光,混合物处理组仍能观察到红色荧光,说明混入TD-34后DOX·HCl的保留性较单独使用DOX·HCl有所增强。见图3。

图3 DOX·HCl及混合物不同处理时间下的MCF-7细胞摄取结果(×250)Fig.3 Fluorescent images of cellular uptake in MCF-7 with DOX·HCl and mixtures in different times(×250)
2.5 DOX·HCl及混合物对Caco-2细胞的影响 与DOX·HCl处理组比较,混合物处理组随着处理时间的延长,细胞单层膜的完整性逐渐被破坏,粗糙程度逐渐增加(见图4)。证明 TD-34 有可能打开Caco-2细胞间的连接结构,通过旁路途径促进药物吸收。

图4 DOX·HCl及混合物不同处理时间下MCF-7细胞显微图片(×250)Fig.4 Micrograph of Caco-2 cells which were treated with DOX·HCl and mixtures in different times(×250)
2.6 细胞吸收定量分析 利用流式细胞仪对DOX·HCl的细胞吸收进行定量分析。研究结果与2.5研究结果一致,MCF-7细胞处理2 h后,混合物处理组较DOX·HCl处理组的荧光强度上升了26.7%,处理24 h后,DOX·HCl处理组几乎没有荧光吸收,而混合物处理组的荧光吸收仍有50.4%;Caco-2细胞处理2 h 后,混合物处理组较DOX·HCl处理组的荧光强度上升了8.6%,24 h后,DOX·HCl处理组的荧光吸收明显降低,而混合物处理组的荧光强度仍有44.0%,再次证明了TD-34可促进DOX·HCl的细胞吸收及延长保留时间。见图5。

图5 流式细胞法测定MCF-7、Caco-2对DOX·HCl及混合物的细胞吸收Fig.5 Cellular uptake of DOX·HCl and mixtures in MCF-7 and Caco-2 cells by Flow Cytometry
3 讨论
目前常用的抗癌药物如氟尿类、阿霉素、氨甲喋呤、喜树碱、姜黄素等,在治疗过程中通常存在毒性大、输送效率低、易产生抗药性、靶向性差等缺点[14],促渗肽与传统的物理和化学促渗方法相比,具有生物相容性良好、输送效率高等优点,开发有效的促渗肽,寻求高效的药物输送体系是提高药效、增加给药途径、克服抗药性的有效途径,对解决抗癌药现存的一些问题具有重大意义。
本研究选择Caco-2作为DOX·HCl的抗性细胞模型,考察DOX·HCl及不同摩尔比的混合物对Caco-2的细胞毒性、形态变化及细胞摄取与保留的影响,并与非抗性细胞系MCF-7比较,结果发现TD-34可以提高DOX·HCl的药效,增加药物的细胞吸收和保留时间。其促渗机理可能是TD-34的阳离子电荷与细胞表面的阴离子成分发生静电相互作用,从而增加药物与细胞膜的相互作用,促进其渗透细胞膜。此外,TD-34可打开Caco-2细胞间的连接结构,破坏细胞单层膜的完整性,打开其旁路通道。
MTX多药抗性主要是由于多聚谷氨酸水平下降以及介导甲氨喋呤吸收的还原型叶酸载体(reduced folate carrier,RFC)的表达量下降或其结构改变所引起的[17]。人乳腺癌细胞MDA-MB-231是一种抗甲氨喋呤的癌细胞,其耐药的产生主要是由于RFC的表达量下降而导致的,而RFC主要介导MTX进入细胞[18]。
因此,本研究选择了MTX与TD-34进行混合,通过比较混合物与单独药物在MCF-7、Caco-2、MDA-MB-231三种细胞系中的细胞活性差异,发现TD-34提高了MTX对抗性细胞系MDA-MB-231的细胞毒性,且较其他2种细胞系毒性作用更加显著。
综上所述,TD-34可以作为药物的促渗剂,为药物的胞内输送和耐药性的克服方面开辟了新途径。
[1] Brannon-Peppas L,Blanchette JO.Nanoparticle and targeted systems for cancer therapy[J].Adv Drug Deliv Rev,2012,64:206-212.
[2] Petros RA,DeSimone JM.Strategies in the design of nanoparticles for therapeutic applications[J].Nat Rev Drug Discov,2010,9(8):615-627.
[3] Zorko M,Langel ü.Cell-penetrating peptides:mechanism and kinetics of cargo delivery[J].Adv Drug Deliv Rev,2005,57(4):529-545.
[4] 何俊,李晓晖,常明明,等.促进药物经皮吸收的促渗肽研究进展[J].中国药学杂志,2014,8:001.
[5] Hou YW,Chan MH,Hsu HR,et al.Transdermal delivery of proteins mediated by non-covalently associated arginine-rich intracellular delivery peptides[J].Exp Dermatol,2007,16(12):999-1006.
[6] Lee SW,Kim JH,Park MC,et al.Alleviation of rheumatoid arthritis by cell-transducible methotrexate upon transcutaneous delivery[J].Biomaterials,2012,33(5):1563-1572.
[7] Ruan R,Wang S,Wang C,et al.Transdermal delivery of human epidermal growth factor facilitated by a peptide chaperon[J].Eur J Med Chem,2013,62:405-409.
[8] Shah PP,Desai PR,Channer D,et al.Enhanced skin permeation using polyarginine modified nanostructured lipid carriers[J].J Control Release,2012,161(3):735-745.
[9] Prausnitz MR,Langer R.Transdermal drug delivery[J].Nat Biotechnol,2008,26(11):1261-1268.
[10] Lin CM,Huang K,Zeng Y,et al.A simple,noninvasive and efficient method for transdermal delivery of siRNA[J].Arch Dermato Res,2012,304(2):139-144.
[11] Carmichael NME,Dostrovsky JO,Charlton MP.Peptide-mediated transdermal delivery of botulinum neurotoxin type A reduces neurogenic inflammation in the skin[J].PAIN,2010,149(2):316-324.
[12] Chang M,Li X,Sun Y,et al.Effect of cationic cyclopeptides on transdermal and transmembrane delivery of insulin[J].Mol Pharm,2013,10(3):951-957.
[13] Slovak ML,Hoeltge GA,Dalton WS,et al.Pharmacological and biological evidence for differing mechanisms of doxorubicin resistance in two human tumor cell lines[J].Cancer Res,1988,48(10):2793-2797.
[14] 潘显道,王存英.天然抗肿瘤药喜树碱衍生物的研究进展[J].药学学报,2003,38(9):715-720.
[15] Hilgers AR,Conradi RA,Burton PS.Caco-2 cell monolayers as a model for drug transport across the intestinal mucosa[J].Pharm Res,1990,7(9):902-910.
[16] Lindgren M,Rosenthal-Aizman K,Saar K,et al.Overcoming methotrexate resistance in breast cancer tumour cells by the use of a new cell-penetrating peptide[J].Biochempharmacol,2006,71(4):416-425.
(编校:吴茜)
Biological activity evaluation of penetrating peptide enhances cytotoxicity of anti-cancer drugs to cancer cell
LI Xiao-hui1, WAMG Yan-yun1, TIAN Tian2, WANG Qing2Δ
(1.School of Life Science and Biotechnology, Dalian University of Technology, Dalian 116024, China;2.School of Pharmaceutical Science and Technology, Dalian University of Technology, Dalian 116024, China)
ObjectiveTo investigate the effect of penetration peptide TD-34 combined with anti-cancer drugs on cancer cell cytotoxicity.MethodsPenetration TD-34 was synthesized by solid-phase synthesis method, forming mixtures with two anti-cancer drugs, DOX·HCl and MTX. Cytotoxicity was tested by MTT method. Qualitative and quantitative study of cell uptake and retention were detected by inverted fluorescence microscopy and flow cytometry, respectively. ResultsCompared with drug treated alone, in TD-34 and DOX·HCl’s mixtures treated group, cell viability rate decreased from 67.0%to 21.5% of MCF-7, increase 26.7% in cellular uptake, absorption intensity was still 50.4% after 24 h; cell viability rate of Caco-2 was 48.5%, cellular uptake increased 8.6%, absorption intensity was still 44% after 24 h; in TD-34 and MTX’s mixtures treated group, cell viability decreased from 65.6% to 37.8%of MCF-7 and 96.0% to 48.3% of resistance cell line MDA-MB-231, respectively; cell viability decreased by more than 30% of Caco-2. ConclusionPenetration peptides TD-34 can enhance cytotoxic of drugs, overcome resistance of cancer cells, increase cellular uptake and retention time of drugs, can be used as an effective anticancer drug penetration enhancers.
penetration peptide;solid-phase synthesis;drug resistance
李晓晖,女,博士,副教授,研究方向:多肽药物化学,E-mail:lxhxh@dlut.edu.cn;汪晴,通信作者,男,博士,教授,研究方向:生物大分子经皮/跨膜给药系统研究;功能性材料及缓控释给药系统的研究;经皮给药计算机模拟与PK/PD相关性研究;药品和化妆品研究开发,E-mail:qwang@dlut.edu.cn。
R966
A
10.3969/j.issn.1005-1678.2016.05.04

