内皮素对哈萨克公羊生理生化指标的影响
王丽芳,徐新明,王 琴,张 丹,闫书平,卡力比夏提·艾木拉江,哈力旦·阿合买提,赵红琼*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.新疆畜牧科学院畜牧研究所,新疆乌鲁木齐 830000)
内皮素对哈萨克公羊生理生化指标的影响
王丽芳1,徐新明2,王琴1,张丹1,闫书平1,卡力比夏提·艾木拉江1,哈力旦·阿合买提1,赵红琼1*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.新疆畜牧科学院畜牧研究所,新疆乌鲁木齐 830000)
为探究内皮素(ET)对羊生理生化指标的影响,选取5只新疆哈萨克公羊,采用不完全拉丁方试验设计,每只羊一次性静脉注射0.7 nmol/kg ET-1或ET-3,对照组注射1 g/L BSA生理盐水。结果显示,注射ET-1或ET-3后同对照组比,心率降低21%~36%(P<0.01),红细胞总数增加10% ~14%(P<0.01),血红蛋白含量增加14%~17%(P<0.05),红细胞比容增加14%~16%(P<0.05);血糖含量增高27%~53%(P<0.05),而且从这些指标改变的幅度和持续时间看,ET-1比ET-3作用强。在整个试验过程中未观察到羊呼吸频率、白细胞总数及分类计数和血浆蛋白浓度的影响(P> 0.05)。研究结果提示,ET可调控反刍动物心血管活动、红细胞比容,并参与血糖稳态调节,而且这些作用可能主要是通过内皮素A受体(ET-A)介导的。
内皮素;绵羊;心率;红细胞比容;血糖
内皮素(endothelin,ET)是由21个氨基酸组成的具有强收缩血管效应的多肽[1-2]。在哺乳动物体内,ET主要由内皮素-1(ET-1)、内皮素-2(ET-2)和内皮素-3(ET-3) 3种多肽组成。ET对机体的调节作用主要由内皮素A受体(ET-A)、内皮素B受体(ET-B)两种受体亚型介导[3-4]。ET-1和ET-2 同ET-A和ET-B两种受体亚型结合力均强,而ET-3同ET-B结合力强,但是同ET-A结合力较弱[5]。因此,在ET的内源性配体中用ET-3可初步判定其作用的受体亚型。ET广泛存在于动物的实质器官、血管以及胃肠道等部位。ET除了具有收缩血管的功能,还具有调节肾上腺素、垂体激素及其他激素的分泌作用,进而调控生长[6-7]。此外,ET还参与肺动脉高压[8]、高血压[9]和心力衰竭[10]等疾病的发病机制。近年来,国内外学者对于ET的研究多见于人[11]和鼠[12-13]的研究,而关于ET对反刍动物生理生化指标影响的研究较少。因此,本试验通过给羊注射ET-1和ET-3,探究ET对反刍动物生理生化指标的影响以及可能的ET受体亚型,以期为将ET及其相关产品用于反刍动物生长调控提供理论依据。
1 材料与方法
1.1材料
1.1.1试验用动物试验选用5只新疆哈萨克公羊,体重为30 kg ± 3 kg,新疆乌鲁木齐市米泉三道坝养殖场提供。每只羊每天饲喂混合料(为麦草、麸皮和玉米粉按1∶1∶1比例加少量水混匀的混合料)和苜蓿草2次(即09:00和19:00),每次5只动物共计饲喂3.5 kg苜蓿草、1.5 kg混合料。在动物自由采食苜蓿草30 min后再饲喂混合料。在试验前1 d,给动物颈静脉插一个留置针导管,便于注射药液和采集血样。导管内用肝素(10 IU/mL,Wako,日本)抗凝。在整个试验过程中羊均拴在保定柱上,在一定范围里可以随意走动,盐砖和水均可自由采食。
1.1.2多肽ET-1(CSCSSLMDKECVYFCHLDIIW,分子质量2 498 u,UniProtKB access number Q9BG76)和 牛 ET-3(CTCFTYKDRECVYYCHLDIIW,分子质量2 675 u,UniProtKB access number A6QLQ7),日本带广畜产大学动物生产学部化学实验室桑山秀人教授馈赠;EDTA-Na2,中国北京鼎国昌盛生物科技有限公司产品;肝素,江苏万邦生化医药股份有限公司产品;葡萄糖(GLU)、白蛋白(ALB)和总蛋白(TP)检测试剂盒,北京利德曼生化股份有限公司产品;全自动动物血液细胞分析仪,南京普朗医疗设备有限公司产品。
1.2方法
1.2.1给药程序和血样采集按照不完全拉丁方试验设计,每只羊在11:00时注射1 g/L BSA 生理盐水(作为对照组)、0.7 nmol/kg ET-1和0.7 nmol/kg ET-3,随后立即注射2 mL肝素钠盐水冲洗留置针导管。每只羊注射药液的体积为5 mL,用1 g/L BSA生理盐水稀释10 mg/mL ET-1或ET-3至预定剂量。每只羊均接受3种处理,同一只羊的不同处理之间都间隔1 d。在之前的研究中,这2种合成多肽均已被证明具有生物学活性[14-15]。在给药前,ET-1和ET-3以10 mg/mL溶解于双蒸水,置-20 ℃保存备用。0.7 nmol/kg浓度的 ET-1和ET-3的注射剂量分别等同于1.75 μg/kg和1.87 μg/kg,以上注射剂量是基于在之前牛的研究[14]和另一报道给羊注射3.3 μg/kg ET-1后导致其死亡[16]确定的。
每次试验每只羊共采集9个血样:-10、0 min(在注射前采血)、5、10、15、20、30、45、60 min;在每个采血时间点用一次性注射器抽取4 mL~5 mL血液;另外,在-10、5、15、30、60 min时间点多抽取1 mL置于预冷的含有EDTA-Na2(抗凝剂量3.8 μmol/mL血液)的试管中,用于血液生理指标的测定。将抽取的4 mL血样立即转移至预冷并肝素化的离心管(内含肝素8 IU/mL血液)中。4 ℃、3 000 r/min离心20 min并分离血浆,置-20 ℃冷冻备用。
1.2.2羊呼吸频率和心率的监测在相对于注射药物时间的-5、 3、33、63 min测定羊呼吸频率和心率。呼吸频率是通过观察动物的胸部和腹部的起伏来确定;心率的测定是将听诊器的拾音部分轻轻地放在羊胸部的左侧,监听其心跳的次数。
1.2.3血液生理和生化指标的测定血液生理指标检测使用全自动动物血液细胞分析仪检测指标包括:红细胞计数(RBC)、红细胞比容(HCT)、血红蛋白(HGB)、白细胞计数(WBC)和白细胞分类计数(淋巴细胞(LY)、单核细胞(Mid)和粒细胞(GR))。分别用双缩脲法、溴甲酚绿法和葡萄糖氧化酶法检测血浆中GLU、ALB和TP浓度。
1.2.4数据统计与处理试验结果以均值 ± 标准误(Mean ± SEM)表示,用SPSS 19.0软件进行双因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1内皮素对羊心率和呼吸的影响
图1A显示了一次性静脉注射ET-1 和ET-3对羊心率的影响。从图1可见,注射前(-5 min)3个组羊心率无差异(P>0.05),其均值为82 次/min±2 次/min。ET-1在注射3、33、63 min后,与对照组相比心率分别减慢了36%、27%和21%(P<0.01),ET-3在注射3 min和33 min后与对照组相比心率分别减慢了36%和21%(P<0.01),而且无论在减慢心率幅度,还是在持续时间方面ET-1作用强于ET-3。 图1 B显示了ET-1 和ET-3对羊呼吸的影响。从图可知,在整个试验过程中3个组试验动物的呼吸频率差异不显著(P>0.05),均值为34次/min±3次/min 。

**和##分别表示ET-1和ET-3对应时间点与对照之间差异显著(P<0.01);图标空心的表示与注射前(-5 min)差异显著(P<0.05)
** (ET-1) and ## (ET-3) indicate that the value is different from the corresponding value of control group(P<0.05),while same double symbols mean(P<0.01);Open symbols indicate that the value is different from the group value of pre-injection (-5 min,P<0.05)
图1内皮素对心率(A)和呼吸(B)的影响
Fig.1Effects of endothelin on heart rate (A) and respiratory rate (B)
2.2内皮素对羊红细胞总数的影响
图2显示了一次性静脉注射ET-1 和ET-3对红细胞总数的影响。从图2可见,注射前(-10 min)3个组羊红细胞总数无差异(P>0.05),其均值为7.4×1012/L±0.2×1012/L。ET-1在注射5、15、30 min后,与对照组相比红细胞总数分别增加了12%、12%和11%(P<0.01),ET-3在注射5 min和 30 min后与对照组相比,红细胞总数分别增加了14%和10%(P<0.01),在增加红细胞总数方面ET-1(30 min)较ET-3(20 min)持续时间长。
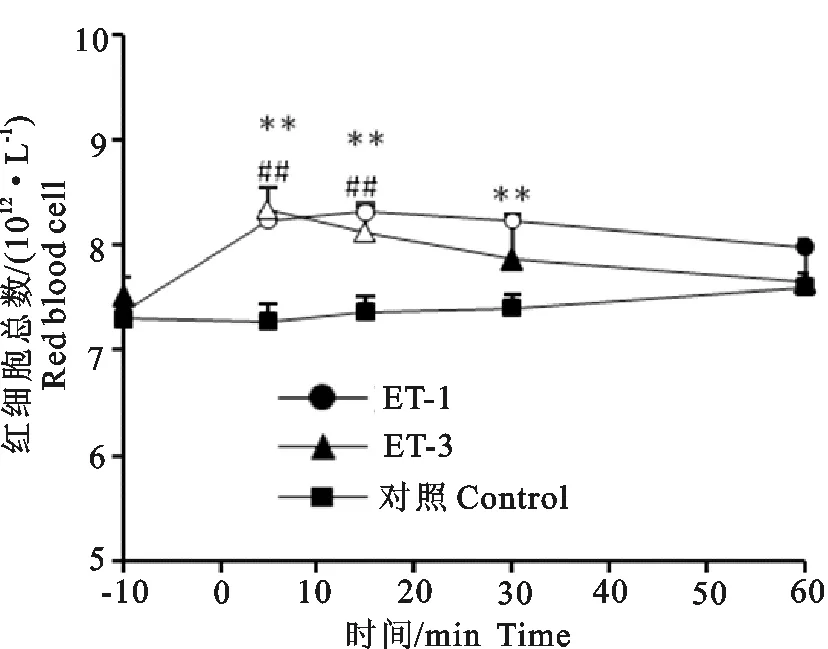
**和##分布表示ET-1和ET-3对应时间点与对照之间差异显著(P<0.01);图标空心的表示与注射前(-10 min)差异显著(P<0.05)
**(ET-1) and ##(ET-3) indicate that the value is different from the corresponding value of control group (P<0.05), while same double symbols mean (P<0.01);Open symbols indicate that the value is different from the group value of pre-injection (-10 min,P<0.05)
图2内皮素对红细胞总数的影响
Fig.2Effects of endothelin on red blood cell counts
2.3内皮素对血红蛋白的影响
图3显示了一次性静脉注射ET-1 和ET-3对血红蛋白的影响。从图3可见注射前(-10 min)3个组羊血红蛋白含量无差异(P>0.05),其均值为94.0 g/L±4.4 g/L。ET-1在注射5 min和30 min后,与对照组相比血红蛋白分别增加了16%和14%(P<0.05),在15 min后有升高但未达到显著水平(P>0.05),ET-3在注射后5 min与对照组相比血红蛋白增加了17%(P<0.05)。
2.4内皮素对红细胞比容的影响
图4显示了一次性静脉注射ET-1和ET-3对红细胞比容的影响。从图可见,注射前(-10 min)3个组羊红细胞比容无差异(P > 0.05),其均值为27.4% ± 1.1%。ET-1在注射5 min、15 min和30 min后 与对照组相比红细胞比容分别增加了16%、14%和14%(P<0.05),ET-3仅在注射后5 min显著增加16%(P<0.05),其他时间点均不显著,且ET-1(30 min)较ET-3(5 min)增加红细胞比容作用持续时间长。

*表示ET-1对应时间点与对照之间差异显著(P<0.05),#表示ET-3对应时间点与对照之间差异显著(P<0.05);图标空心的表示与注射前(-10 min)差异显著(P<0.05)
* (ET-1) and # (ET-3) indicate that the value is different from the corresponding value of control group (P<0.05);Open symbols indicate that the value is different from the group value of pre-injection (-10 min,P<0.05)
图3内皮素对血红蛋白的影响
Fig.3Effects of endothelin on hemoglobin

*表示ET-1对应时间点与对照之间差异显著(P<0.05),#表示ET-3对应时间点与对照之间差异显著(P < 0.05);图标空心的表示与注射前(-10 min)差异显著(P<0.05)
* (ET-1) and # (ET-3) indicate that the value is different from the corresponding value of control group (P<0.05);Open symbols indicate that the value is different from the group value of pre-injection (-10 min,P<0.05)
图4内皮素对红细胞比容的影响
Fig.4Effects of endothelin on hematocrit
2.5内皮素对白细胞总数及淋巴细胞、单核细胞和粒细胞百分比的影响
图5显示了一次性静脉注射ET-1 和ET-3对白细胞总数的影响。表1显示了一次性静脉注射ET-1 和ET-3对淋巴细胞、单核细胞和粒细胞百分比的影响。从图5可知,3个组处理之间的白细胞总数及淋巴细胞、单核细胞和粒细胞百分比差异不显著(P>0.05)。注射前白细胞总数为9.4×109/L±1.1×109/L,淋巴细胞百分比为52.4%±2.6%、单核细胞百分比4.7%±0.6%、粒细胞百分比42.9%±3.0%。
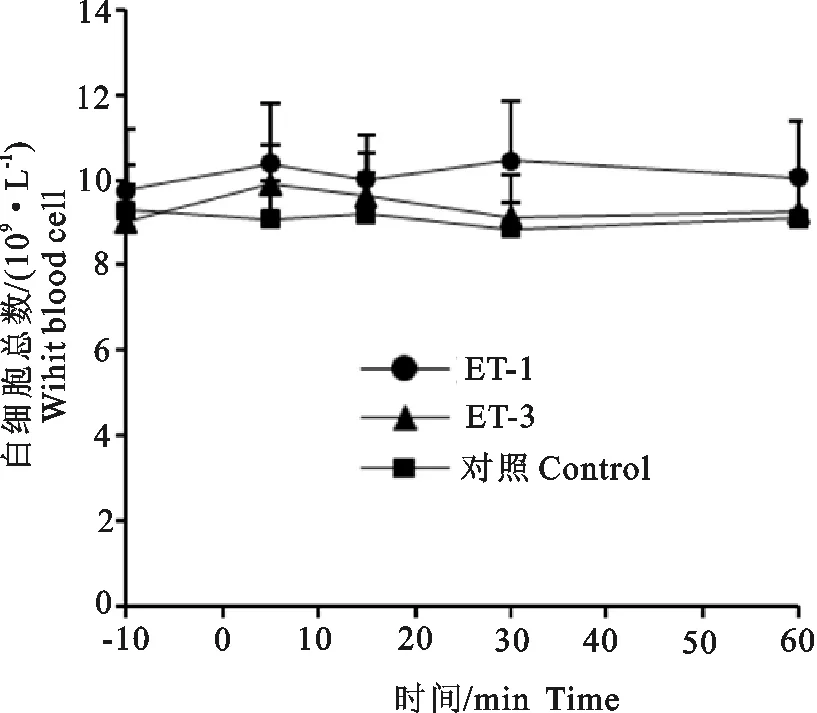
图5 内皮素对白细胞总数的影响
2.7内皮素对羊血糖、白蛋白和总蛋白的影响
图6是一次性静脉注射ET-1 和ET-3对羊血糖浓度变化的影响。注射前(-10 min)3个组羊血糖浓度无差异(P>0.05),其均值为5.9 nmol/L±0.2 nmol/L。ET-1在注射10 min~60 min后血糖浓度持续高于对照组(P<0.05),升高了约28%~
53%之间;ET-3在注射10、20、30 min后血糖浓度显著升高(P<0.05),分别升高了27%、29%和32%,在15 min时血糖浓度有升高但未达到显著水平(P=0.13)。3个组处理之间白蛋白和总蛋白差异均不显著(P>0.05)。注射前血浆白蛋白均值为56.3 g/L±5.0 g/L,总蛋白为112.7 g/L±13.7 g/L。

*、#表示ET-1对应时间点与对照之间差异显著(P<0.05),**表示ET-1对应时间点与对照之间差异显著(P<0.01),#表示ET-3对应时间点与对照之间差异显著(P < 0.05);图标空心的表示与注射前(-10min)差异显著(P<0.05)
*,#(ET-1) indicate that the value is different from the corresponding value of control group (P<0.05),** while same double symbols mean (P<0.01);Open symbols indicate that the value is different from the group value of pre-injection (-10 and 0 min,P<0.05)
图6内皮素对血糖的影响
Fig.6Effects of endothelin on blood glucose

表1 内皮素对羊淋巴细胞、单核细胞、粒细胞的影响Table 1 Effect of endothelin on blood lymphocytes,monocytes and granulocytes in sheep %
3 讨论
本研究结果显示,一次性静脉注射ET-1和ET-3均减慢羊心率,且ET-1作用强于ET-3,而对呼吸频率影响不明显。尽管在内皮素发现之初已经证明其具有强烈收缩血管的兴奋效应,但是同本研究结果一样,多个研究表明ET对心脏活动呈现抑制作用。Han S P等[17]研究表明ET静脉注射可增加大鼠动脉血压,而降低心率。Kenneth L等[18]给清醒狗静脉输注10 ng/(kg·min)和30 ng/(kg·min) ET后发现其心率和心输出量均降低。夏照帆等[19]给大鼠离体心脏灌注ET-1,发现其冠状动脉血流量进行性下降,而心肌收缩力和心输出量呈现双相变化趋势,心率同对照组比减慢10%。刘韬等[20]通过给予家兔连续14 d耳缘静脉注射10 μg/kg ET-1,之后检测离体心脏,发现高水平ET-1可引起心室复极电位顺序逆向改变,心律失常。在人的疾病研究中发现内皮素水平的高低同某些心血管疾病的发生相关。闫少锋等[8]在患肺心病的血液中发现心衰期的血浆ET-1水平的含量要显著高于正常人。同样的,采集心力衰竭患者外周静脉血并测定其血液中内皮素含量,结果发现患者血液中内皮素的含量越高心力衰竭的程度也越严重,故而内皮素的含量与心功能呈正相关[21]。ET表现出对血管强烈收缩作用,而对心脏表现负性变时作用,其机理可能是由于血管收缩,血压升高,刺激颈动脉窦压力感受器,通过兴奋延髓心迷走中枢,降低心率。
本研究中羊静脉注射ET-1和ET-3后红细胞总数、血红蛋白含量和红细胞比容值均增加,并且ET-1升高这3种生理指标的效果比ET-3更显著,但是这2种激素对白细胞总数和白细胞分类计数指标影响不明显。Kenneth L等报道静脉输注0.24 nmol/(kg·h)和0.72 nmol/(kg·h) ET均可增加清醒狗红细胞比容[18]。Martin G等[22]也证明一次性静脉注射1.0 nmol/kg ET-1给大鼠,可升高其红细胞比容,并且发现ET-1可增加血管对白蛋白的通透性。动物成年后红细胞主要在红骨髓生成,整个发育和生成过程约1周[23]。因而,在ET给药后1 h内不可能是通过促进红细胞生成而增加循环系统红细胞数量或血红蛋白含量。有研究表明,去除脾脏狗注射ET后并不改变红细胞比容,而脾脏是机体贮存红细胞的一个重要场所,提示ET可能通过促进脾脏收缩,而释放其贮存红细胞进入循环系统。另一方面,既然ET可增加血管通透性,也就是说ET可能促进血浆中水渗出血管,而使全血中红细胞比容增加。我们还初略观察到注射ET后羊排尿次数增加,这也有可能降低全血中水比例,而使红细胞比容增加。在本研究中注射ET后血液中白细胞总数或分类计数变化并不明显,其机制有待进一步研究。
本研究中发现ET-1和ET-3给药后,羊血糖水平显著升高,而且在升高幅度和持续时间方面ET-1比ET-3效果更强。该研究结果同前人在大鼠和牛研究结果一致[15,24-25],尤其大鼠肝脏门静脉输注,显示ET注射后收集的灌注液中葡萄糖含量增加,提示ET给药后升高血糖可能一方面是通过调节肝脏血糖代谢实现的。另一方面,Juan C C等[25]研究表明,ET-1可引起大鼠胰岛素抵抗,这也可能是外源性ET给药,胰岛素不能降血糖,而升高血糖的原因。
本研究中ET-1减慢羊心率,增加红细胞比容、血红蛋白含量以及血糖含量的作用均强于ET-3,基于ET-1同ET-A和ET-B两种受体亚型结合力均强,而ET-3同ET-B结合力强,但是同ET-A结合力较弱[5],推测ET减慢羊心率主要是通过ET-A受体亚型介导的,但是也不能排除ET-B是否参与该过程,有待使用特异性受体阻断或激动策略进行判断。
[1]Yanagisawa M,Kurihara H,Kimura S,et al.A novel potent vasoconstrictor peptide produced by vascular endothelial cells[J].Nature,1988,332(6163):411-415.
[2]王新,韦旭斌,索占伟,等.微血管内皮细胞功能的研究进展[J].动物医学进展,2005,26(12):44-48.
[3]Arai H,Hori S,Aramori I,et al.Cloning and expression of a cDNA encoding an endothelin receptor[J].Nature,1990,348(6303):730-732.
[4]Davenport A P.International union of pharmacology.XXIX.Update on endothelin receptor nomenclature[J].Pharmacol Rev,2002,54(2):219-226.
[5]Inoue A,Yanagisawa M,Kimura S,et al.The human endothelin family:three structurally and pharmacologically distinct isopeptides predicted by three separate genes[J].Proceed Nat Aca Sci,1989,86(8): 2863-2867.
[6]周景明,赵毅,李权武.内皮素对动物生殖的调控[J].动物医学进展,2000,21(4):123-125.
[7]张珂,陈鹊汀,王晓冬,等.内皮素受体的分布及其生物功能[J].医学研究与教育,2014,31(3):76-81.
[8]闫少锋,郭建华.肺心病心衰期血浆内皮素含量及临床意义[J].中国实用医药,2007,2(21):11-12.
[9]康建华,赵连友,张跃义.高血压病患者血浆内皮素的改变及其临床意义[J].中国心血管病杂志,2003,18(3):209-210.
[10]王自力,索占伟,穆祥,等.内毒素对微循环及血管内皮细胞功能影响的研究进展[J].动物医学进展,2003,24(06): 45-48.
[11]Yoshizawa T,Shinmi O,Giaid A,et al.Endothelin:A Novel peptide in the posterior pituitary system[J].Science,1990,247(4941):462-464.
[12]Garrido M R,Israel A.Endothelin-3 stimulates phosphoinositide hydrolysis in the subfornical organ and median eminence of the rat brain[J].Brain Res Bull,1994,33(6):683-688.
[13]蒋应明,孙庆文,袁文俊.内皮素在内分泌组织中的调节作用[J].国外医学:生理、病理科学与临床分册,2000,20(2):151-153.
[14]Than S,Mekaru C,Seki N,et al.Endogenous ghrelin released in response to endothelin stimulates growth hormone secretion in cattle [J].Domestic Animal Endocrinol,2010,38(1):1-12.
[15]Zhao H,Thanthan S,Yannaing S,et al.Involovement of endothelin B receptors in the endothelin-3-induced increase of ghrelin and growth hormone in Holstein steers[J].Peptides,2010,31(5):938-943.
[16]Snapper J R,Lu W,Lefferts P L,et al.Cyclooxygenase products contribute to endothelin-induced pulmonary hypertension and altered lung mechanics in sheep[J].Pulmonary Pharmacol Thera,1997,10(2):111-118.
[17]Han S P,Trapani A J,Fok K F,et al.Effects of endothelin on regional hemodynamics in conscious rats[J].Eur J Pharmacol,1989,159(3):303-305.
[18]Goetz K L,Wang B C,Jeffrey B,et al.Cardiovascular,renal,and endocrine responses to intravenous endothelin in conscious dogs[J].Am J Physiol,1988,255(6):R1064-R1068.
[19]夏照帆,石胜军,陈玉林,等.内皮素对心脏功能和细胞能量代谢影响的实验研究[J].第二军医大学学报,1998,19(S):34-36.
[20]刘韬,秦牧,黄从新.长期血浆内皮素-1水平升高对兔心室电生理特性及心律失常的影响[J]. 武汉大学学报:医学版,2013,34(4):477-481.
[21]钱伟莉,杨新春,张娟,等.慢性心力衰竭患者N端脑钠肽前体、内皮素与心功能的关系[J].中国循证心血管医学杂志,2014,6(3):311-313.
[22]Sirois M G,Filep J G,Rousseau A,et al.Endothelin-1 enhances vascular permeability in conscious rats:role of thromboxane A2[J].Eur J Pharmacol,1992,214(2-3):119-125.
[23]黄庆洲,黎德斌,伍莉.动物生理学[M].重庆: 西南师范大学出版社,2014:40-53.
[24]Cui T X,Masaru I,Meiko H,et al.Receptor subtype mediating the action of circulating endothelin on glucose metabolism and hemodynamics in perfused rat liver[J].Regul Pept,1999, 83(2-3): 117-122.
[25]Juan C C,Fang V S,Huang Y J,et al.Endothelin-1 induces insulin resistance in conscious rats [J].Biochem Biophys Res Commun,1996,227(3):694-699.
Effect of Endothelin on Physiological and Biochemical Indexes in Kazak Rams
WANG Li-fang1, XU Xin-ming2, WANG Qin1, ZHANG Dan1, YAN Shu-ping1,AIMULAJIANG Ka-li-bi-xia-ti1,AHEMAITI Ha-li-dan1, ZHAO Hong-qiong1
(1.CollegeofVeterinaryMedicine,XinjiangAgriculturalUniversity,Urumqi,Xinjiang,830052,China;2.AnimalScienceInstitute,XinjiangAcademyofAnimalSciences,Urumqi,Xinjiang,830000,China)
To explore the effect of endothelin (ET) on physiological and biochemical indexes in sheep,five Kazak rams were used in the present study.By incomplete Latin Square Design,each sheep was received an intravenous injection of ET-1 or ET-3 at a dose of 0.7 nmol/kg body weight,or 0.1% BSA saline as control.The results showed that administration of ET-1 or ET-3 decreased heart rate 21%-36% (P<0.01),increased red blood cell counts by 10%-14% (P<0.01),hemoglobin by 14%-17% (P<0.05),hematocrit by 14%-16% (P<0.05) and blood glucose levels by 27%-53% (P<0.05).Moreover,the effects of ET-1 were stronger than those of ET-3 in magnitude and duration.However,respiratory rate, white blood cell counts and types,and plasma protein concentration were not changed by injection of ET-1 or ET-3 (P>0.05).These results indicated that ET is involved in regulation of cardiovascular activity,hematocrit,and glucose homeostasis,and suggesting that these effects may be mainly mediated by the endothelin A receptor (ET-A) in ruminants.
endothelin; sheep; heat rate; hematocrit; glucose
2016-03-18
国家自然科学青年基金项目(31201872);中国博士后科学基金项目(2013M542413)新疆维吾尔自治区产学研联合培养研究生示范基地项目(xjaucxy-yjs-20131061)
王丽芳(1988-),女,重庆花桥人,硕士研究生,主要从事生物活性物质结构和功能研究。*通讯作者
S852.21
A
1007-5038(2016)10-0075-06

