樱花组培快繁体系的建立及组培苗移栽技术研究
郑慈真 何文杰 尹 茜 齐跃强
(广州市名卉景观科技发展有限公司,广东 广州 510420)
樱花组培快繁体系的建立及组培苗移栽技术研究
郑慈真何文杰尹茜齐跃强
(广州市名卉景观科技发展有限公司,广东广州510420)
以4个樱花品种为研究对象,主要采用腋芽(侧芽)诱导方法,建立了腋芽诱导培养系,并建立了试管苗初代培养,优化了继代培养和生根培养基,并提出了腋芽诱导规模化生产樱花试管苗的可行性程序和试管苗移栽的可行性程序。
樱花;脱毒;组培培养;试管苗生根;组培苗移栽
樱花(Prunusserrulata)是世界著名的观赏花木,隶属于蔷薇科(Rosaceae)樱属(Cerasus),分布于北半球温暖地区,为北温带植物,亚洲、欧洲至北美洲均有记录。该属包括百余种成员,主要种类分布在我国西部和西南部以及日本和朝鲜[1]。
樱花为早春观赏花木,其株型优美,花色艳丽,花期延续期长,在园林上具有极大的应用价值,可广泛应用于公园、学校、街道、庭院等绿地中。由于樱花具有极高的观赏价值,引种培育工作逐步被人们重视,尤以日本遥遥领先[2]。截至目前,培育品种在花型、花色、株形等各方面观赏价值都有了极大的提高,品种数量也日益增多。
樱属植物在我国栽培历史悠久,早在2000多年前的秦汉时期,樱花就已在宫庭中作为祭祀大典中的贡品栽培,但一直以来对于樱花品种的研究相对较少。国内樱花栽植虽多,但大都引自日本,不如乡土树种适应性好,对于樱花景观配置和园林应用价值缺乏系统研究,严重制约了樱花在园林应用中的发展。而我国拥有十分丰富的野生樱花资源,远远超过日本及相邻国家,分布范围也非常宽广,从东北到西南都有分布,其中有许多观赏价值极高的种类,其世界声誉却远逊于日本,如能对国产樱花进行进一步的研究开发利用,培育出新品种,必可摆脱依靠进口新品种的局面[3,4]。
1 国内外樱花的研究概况
1.1国内外樱花组织培养研究进展
1992年,沈惠娟先生在《木本植物组织培养技术》[5]中对部分食用樱桃类的组织培养研究作了小结,并列出了部分研究者摸索出的分化和生根培养基配方及外植体再生方式。1998年,及华[6]对山樱花进行了离体快速繁殖试验,用不同配方的培养基对不同阶段进行了处理,得到了较好的生根组合。
陆贵巧、林青、荣冬青、闫道良等做了一系列提高樱花嫩枝扦插生根成活率的试验,在提高扦插生根量方面做了一些探讨,在此基础上闫道良提出了开发利用国内野生樱资源的建议。张艳芳[7]和朱继军分别研究了樱花的切接繁殖技术和高位嫁接繁育方法。
观赏樱花从1991年开始,中国科学院武汉植物研究所做了樱花组织培养方面的研究并获得了正常的组培苗;周志坚、张忠民等[8]研究了大岛樱的组织培养与快速繁殖技术,在短时间提供大量适合于生根的壮苗。郭万里[9]采用器官培养技术探索规模化生产樱花试管苗的途径,还分析了规模化生产林木试管苗过程中出现的玻璃化和试管苗弱化(GA引起的徒长)现象以及生产中的对策。福建农林大学付影[10]对钟花樱离体繁殖技术体系进行了探索,分别对外植体的表面灭菌、启动培养、继代增殖培养、生根培养及炼苗移栽等方面进行了研究,着重探讨了组织培养过程中最佳培养基配方及培养程序。
2007年,笠原俊策、韩东生、新美芳二[11]根据Murashige在1974年提出的方法,研究建立一个利用茎尖培养生产日本晚樱小苗木的系统。在其系统研究中发现,9月为在WPM培养基上外植体最佳切除时间,6月是移栽至盆中的最佳时间,植物将于茎尖培养后4a开花。
1.2樱花栽培方面的研究
方义昌、王敏、陈先友等研究了叶用、花用樱花的栽培技术,包括产地环境与规划、樱树园生态建设、土壤管理和施肥、病虫草害防治、樱树修剪与适时采摘等内容,为樱树栽培提供了参考。王慧娟、孟月娥等[12]对樱花的组培苗从基质、肥料浓度及激素3个方面进行了移栽技术方面的研究。结果发现,草炭是樱花组培苗移栽的最佳基质;连续喷洒5次,每次间隔7d的0.2%的尿素溶液可有效促进组培苗的生长;在植株长出新叶后用赤霉素100mg/L的水溶液喷洒,可以促进植株快速生长,缩短缓苗期。
1.3研究意义
樱花是深受我国人民喜爱的早春观赏花木之一。随着城市园林建设的飞速发展和人们对居住环境要求的日益提高,樱花在美化环境和满足人们早春观赏需求等方面的作用越来越重要。樱花品种丰富、树型多样、叶色变幻、花期整齐,开花盛期持续时间长,是一种不可多得的园林绿化树种,具有重要的园林应用价值。
据统计,我国现有樱花品种53个,花色艳丽,白的、粉的、紫的、黄的色彩缤纷,十分引人注目。花瓣有单瓣、半重瓣、重瓣、菊瓣等多种形态,并且整个花期延续期长,叶片的形状多种多样,有卵形、披针形等,樱花大多数的树形都非常漂亮,树枝开展,用作庭园或风景区栽植,无论单株栽植、行植及丛植,或植为片林,观赏效果美不胜收。但是,目前应用中多数景点仅仅只有普通的几个樱花品种,园林应用处于较低水平。
樱花的原产地主要是我国和日本,我国的野生樱花资源十分丰富,若对这些野生资源加以充分的利用,不仅可以对城市的园林绿化起到推动作用,也会带来相应的不可忽略的经济利益。今后应在加强对野生资源保护的同时,加大繁殖生物学研究,尤其是引种、选育工作,加强对野生资源的利用。针对如何以市场为导向,在开发野生资源的基础上培育出色艳、抗性强的新品种,使得樱花的物种资源优势转变为商品优势和经济优势。
2 名卉公司樱花研究情况
2.1研究的方法与意义
基于目前的研究现状,名卉公司运用组织培养的繁育手段,在短时期快速繁殖获得大量的不同品种的樱花种苗,满足樱花在园林应用中的需求。该研究主要采用植物组织培养技术中的器官培养,探索规模化生产樱花试管苗的途径。
在探索规模化生产4个樱花品种试管苗的过程中,主要采用了腋芽(侧芽)诱导方法建立了腋芽诱导培养系。建立了试管苗初代培养,优化了继代培养和生根培养基,并提出了腋芽诱导规模化生产樱花试管苗的可行性程序:4个樱花品种的生长状态在继代培养基中差异不明显,因此可采用一套培养基。但在生根时,它们体现出白身的遗传差异性。经过试验,确定了这几种樱花品种的生根培养基最佳激素配比范围,为规模化生产多品种樱花试管苗提供了生根培养基的激素配比原则。
2.2樱花组培快繁研究内容
2.2.1樱花组培快繁体系建立情况。用4个樱花品种作为名卉公司研究樱花组培快繁体系的外植体,分别为樱花1号、樱花2号、樱花3号和樱花4号,以MS培养基为基本培养基进行研发。
2.2.2组培快繁体系的研究方法。2月中旬—4月中旬,采集新发的半木质化的樱花枝条和较老(木质化程度较高)的樱花枝条,去除叶片(留部分叶柄3~5mm和枝条顶端幼嫩部分)。樱花枝条截段长度为1.5~3.0cm,至少含有1个腋芽。用浓洗洁精水溶液振荡洗涤5min,然后用自来水冲净洗洁精残液。预处理后的材料在超净工作台中,在75%的酒精中浸泡10~15s,0.1%HgCl溶液中浸泡5~10min,无菌水冲洗3~5遍(3~5min/次),最后将无菌的外植体接种到初代培养基中,接种时露出腋芽。把灭菌的樱花外植体接种到表l所示的培养基中,卡拉胶0.5%,白糖3%,pH值5.8,25d继代一次。第15~20天,随机抽出10~15瓶进行观察。以外植体腋芽的发生快慢、试管苗生长状态以及茎底部愈伤大小和状态来选择较佳培养基搭配。
继代培养是把初代培养基C5和C6中新发的外植体接种到表2所示配方中,35d继代一次。第25~30天,随机抽出10~15瓶进行观察。以苗的生长状态以及茎底部愈伤的大小和状态来选择较佳培养基搭配。
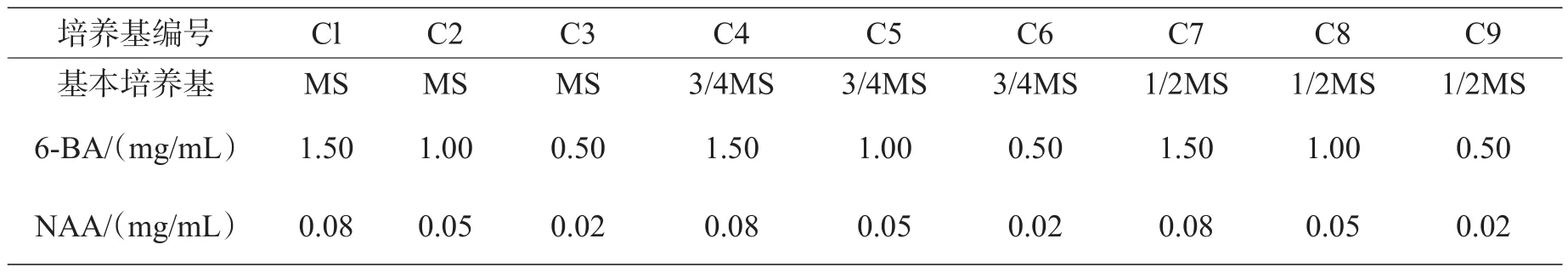
表1 樱花初代培养基配方
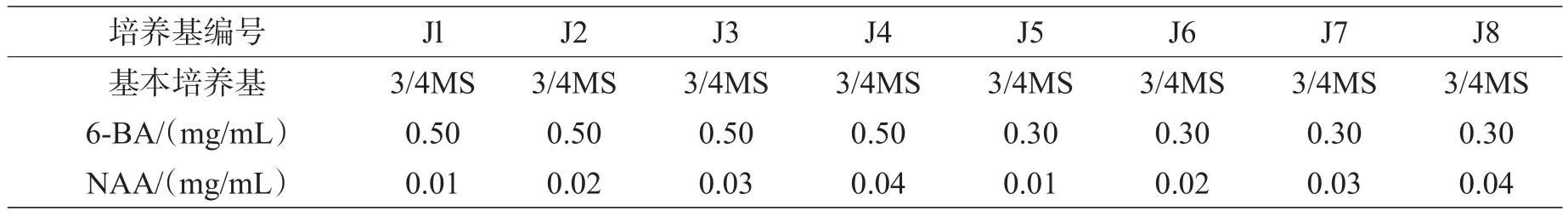
表2 樱花继代培养基配方
樱花试管苗生根的优化是把苗接种到生根培养基中(见表3),卡拉胶0.6%,蔗糖2%,pH值5.8,生根苗高度大于1.5cm,截段长度为1.5~2.0cm。培养第15天统计生根率(随机抽出10~15瓶进行统计和观察),并观察苗状态。
3 研究结果与讨论
3.1樱花组织培养探讨
3.1.1樱花外植体的采集时间。樱花外植体的采集时间以春天3—4月最佳,这期间花已经开过,新发枝条长度为5~15cm,半木质化,最易诱导掖芽的发生。但过于幼嫩的枝条在叶腋处产生愈伤,会影响腋芽发生;而完全木质化的一年生枝条过于老化,腋芽发生较慢,并且分泌化学物质,进一步影响腋芽的发生,还引起部分腋芽的黄化死亡。
3.1.2基本培养基的选择。MS、3/4MS和1/2MS基本培养基中,MS不仅延迟了樱花腋芽的发生时间,约12d腋芽才开始萌动,还抑制了樱花的生长,茎伸长较慢,叶片较小,处于半卷曲状态,且叶色黄绿。3/4MS中的樱花萌动较早,4~6d腋芽就开始膨大萌动。10d就发出一两片新叶,新叶叶片较大,色泽鲜绿,伸展。1/2MS中的外植体腋芽的萌动时间与3/4MS相似,但叶片淡黄绿色,培养时间稍长(约20d),部分叶片脱落,可能是缺乏某种无机元素或无机元素不足造成的。同时,茎底部愈伤过大,呈白色疏松状,可能是植物激素用量或配比不当造成的,也可能是有机成分含量过高。因此,樱花外植体初代培养的建立需要无机离子浓度稍高的基本培养基,但又不能过高,如MS,并且需要多种微量元素。根据结果分析可知,采用3/4MS作为樱花外植体初代培养的基本培养基是比较合适的。
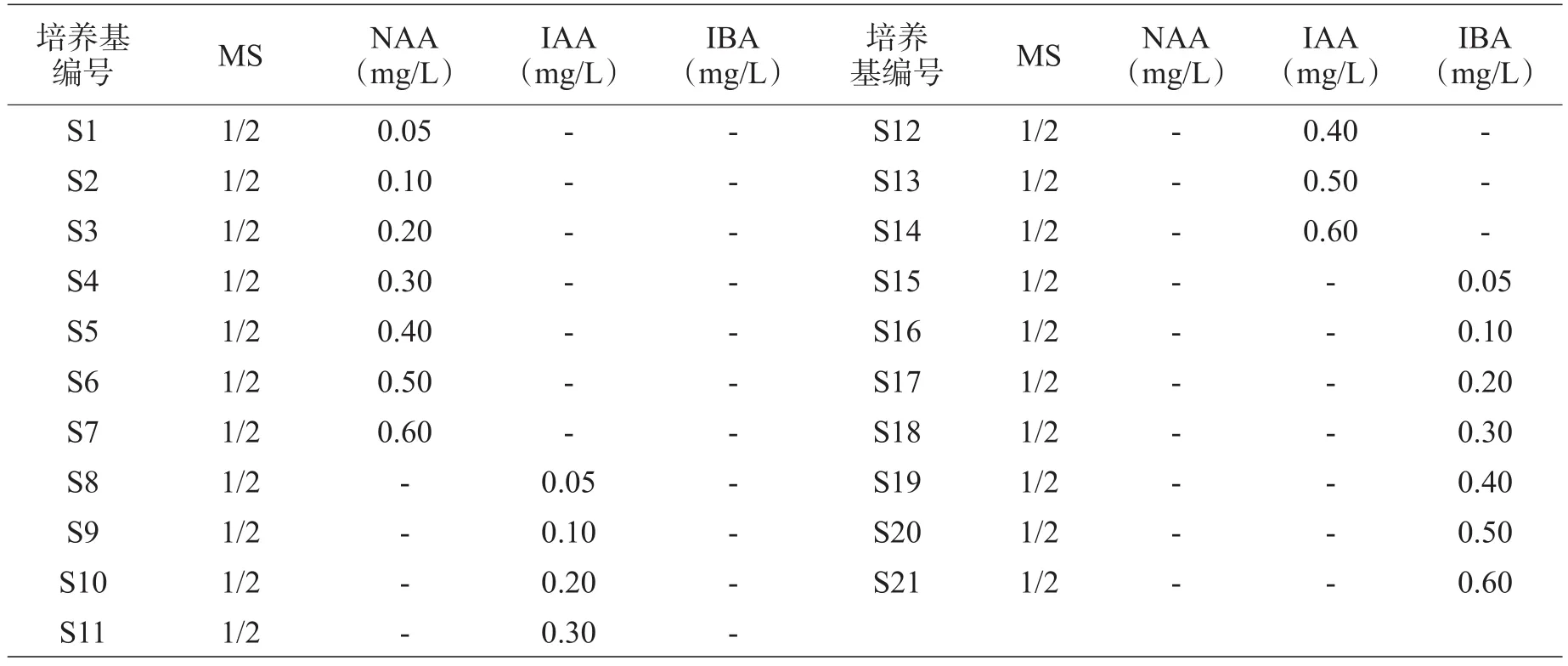
表3 樱花生根培养基配方
3.1.3樱花外植体初代培养基的选择。无论在MS还是在3/4MS培养基中,当NAA浓度不变时,外植体底部愈伤随6-BA浓度的降低而减小,颜色由浅黄疏松到黄绿坚实。而且新发的幼枝长势差异随6-BA浓度(0.5~1.5mg/L)的变化并不显著。这说明6-BA浓度过高时促进了无效愈伤的形成,而对幼苗长势并无较大的影响。因此,在樱花外植体初代培养系建立时,以不影响新芽生长为原则,选择较低的6-BA浓度。由以上试验和分析,C6较适合幼嫩樱花外植体的初代培养。
3.1.4樱花继代培养基的选择。根据樱花初代培养基初选试验的结果,选择了3/4MS做基本培养基,并对6-BA和NAA作了调整。从6-BA和NAA的配比中可看到,除愈伤有差异外,Jl~J4中的樱花继代苗状态差别不大。但从总体试管苗的整齐性来看,J2最好(很可能6-BA和NAA的配比最适合樱花试管苗的继代)。因此,为了樱花生产中继代周期的一致性并便于操作,樱花试管苗生产中的继代前期培养基选择J2较合适。但随着继代代数的增加继代苗弱化,要把NAA和6-BA浓度两者进行调配,根据试验和实际生产情况,樱花试管苗生产中的继代培养基选择J5较合适。
3.1.5樱花试管苗生根培养基的优化。从表4来看,S1~S7为单加NAA试验,其浓度范围是0.05~0.60mg/L。很明显,随着NAA浓度的升高,樱花生根率明显上升,为29.5%~95.5%;但不能太高,当浓度NAA大于0.50mg/L时生根率下降,樱花茎底部愈伤显著增大呈松散白色。这很可能是高浓度NAA促进了愈伤的发生而抑制根的发生。因此,高浓度NAA不适合樱花生根。从试验结果来看,NAA对樱花试管苗生根有较好的促进作用,但最佳使用范围应不高于0.50mg/L,且根较粗壮,有少量愈伤。
S8~S14为单加ΙAA的试验,其浓度范围是0.05~0.60mg/L。随着ΙAA浓度的升高,樱花茎底部的愈伤有增大的趋势,但明显没有NAA愈伤大,只有ΙAA (0.60mg/L)的愈伤明显过大,并且生根率也最低(31.0%)。在此范围内,生根率先缓慢升高后又降低。说明ΙAA浓度在一定范围内(0.00~0.40mg/L)可能具有促进生根的能力。大于0.40mg/L,则促进了愈伤的生长,抑制了根的发生。因此,可把ΙAA浓度控制在0.00~0.40mg/L范围内。
S15~S21为单加ΙBA的试验,其浓度范围是0.05~0.60mg/L。从表4中可以看到,同浓度的NAA、ΙAA和ΙBA对樱花试管苗生根的影响中,ΙBA中苗的愈伤块大小处于NAA和ΙAA之间,愈伤块的大小随ΙBA浓度的升高而略有升高,而愈伤块的增大并没有影响生根率上升的趋势。所以,在此范围内单独使用ΙBA对樱花试管苗生根有促进作用,但根较细长而易折断。
综合上述分析,3种生长素对樱花试管苗根发生的影响效果为NAA>ΙBA>ΙAA。单独使用NAA、ΙAA 和ΙBA时,各培养基间生根率差异较大。ΙAA的促进效果较差,愈伤大,生根率低;ΙBA的促进生根效果较好,愈伤较小,但根细长易折断,在实际生产中出瓶时移栽的损耗较大,从而降低了成活率。NAA虽有刺激愈伤发生的作用,但是只要把握好使用浓度,生根效果显著且根系较粗壮、韧性好,更有利于克服出瓶损耗。综合表4中各培养基生根率和愈伤块大小以及生产实际来看,S6更适合于樱花生根和生产。
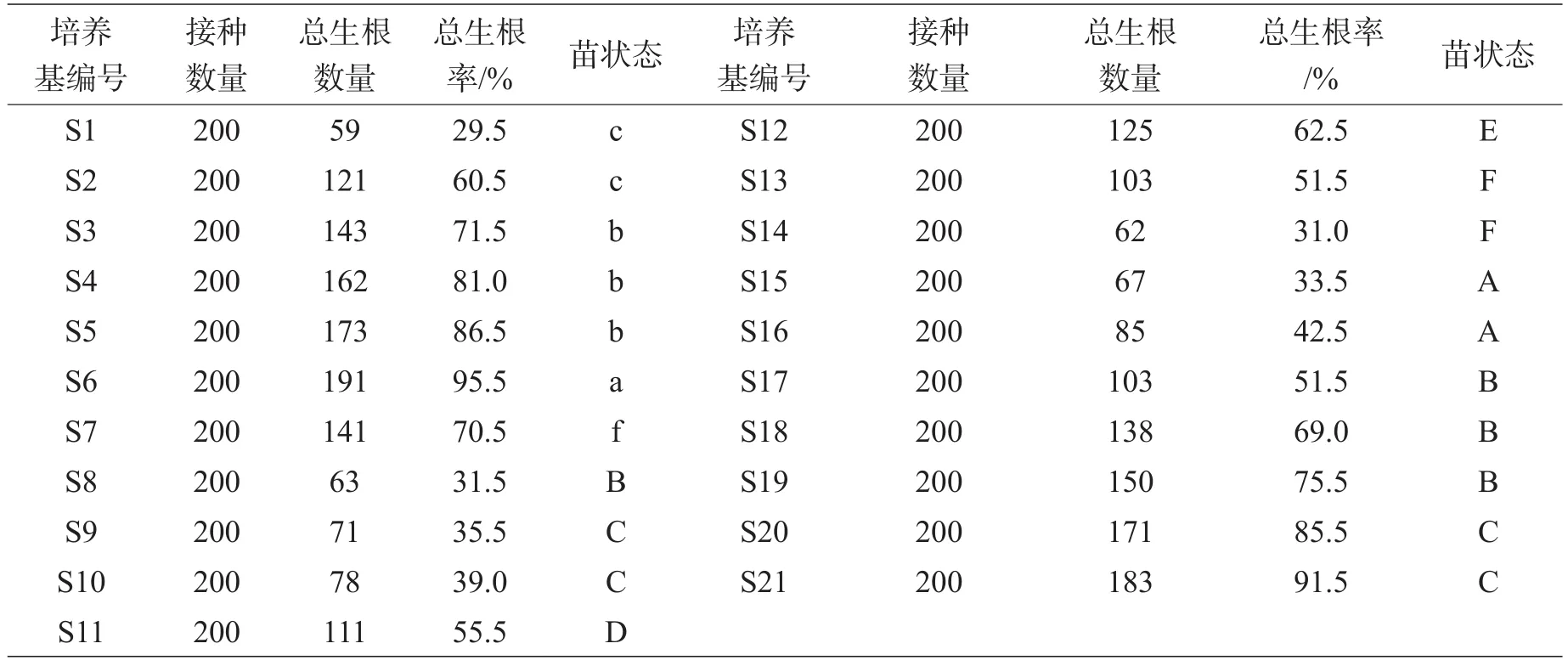
表4 樱花生根统计表

表5 樱花移栽成活率
3.2樱花组培苗移栽技术探讨
樱花试管苗移栽以德国进口KLASMAN泥炭土作为基本基质。樱花试管苗在生根培养基中培养30d,移至温室中炼苗3~5d,移栽到泥炭土基质中,并在苗上方搭遮荫网,以免阳光灼伤幼苗。栽培温度18~26℃,保持基质湿润。15d后去除遮荫网,30d统计成活率。樱花1号、樱花2号、樱花3号和樱花4号的移栽情况如表5所示。
从表5可看出,樱花在泥炭土基质中的成活率相当高,都在90%以上,说明这种基质适合樱花大规模栽培。
4 结论
从以上试验可得出,规模化生产4个品种樱花试管苗过程中所用到的培养基,C6[3/4MS+6-BA(0.50mg/L)+ NAA(0.02mg/L)]培养基可用于外植体的初代培养和前期继代,正常的继代以J5[3/4MS+6-BA(0.30mg/L)+ NAA(0.01mg/L)]培养基为佳(继代周期为30~35d)。
S6[1/2MS+NAA(0.50mg/L)+AC]可用于生根培养。在组织培养过程中,樱花的遗传差异主要表现在生根方面。根据试验,缩小了激素的选择范围,即生长素浓度应不超过0.50mg/L,尽量不用ΙAA,而用ΙBA或者NAA或者是混合使用。这样对每个品种都能较快地确定其最佳生根培养基。相对来说,樱花试管苗的栽培还是比较容易的,4个樱花品种试管苗在泥炭土的基质上成活率都能达到90%以上。以上这一系列的培养基可根据樱花试管苗在规模化生产中所处的不同状态来进行相应调整。
[1]谭文澄,戴策刚.观赏植物组织培养技术[M].北京:中国林业出版社,1991.
[2]何业华,胡芳名,谢碧霞.经济林木离体培养研究进展[J].中南林学院学报,2000(1):31-40.
[3]曹孜义,刘国民.实用植株组织培养技术教程[M].兰州:甘肃科学技术出版社,2001.
[4]林弥荣.日本的樱花[M].北京:诚文堂新光社,1974.
[5]沈惠娟.术本植物组织培养技术[M].北京:中国农业科技出版社,1992.
[6]及华.樱花的离体快速繁殖[J].植物生理学通讯,1998(4):269.
[7]张艳芳.樱花的切接繁殖[J].花木盆景:花卉园艺,2006(2):14-15.
[8]周志坚,翟应吕,周丽华,等.大岛樱的组织培养与繁殖[J].植物生理学通讯,1992(6):436.
[9]郭万里.规模化生产樱花试管苗和林木工厂化微繁中的部分问题及对策[D].长春:中国人民解放军军需大学,2003.
[10]付影.钟花樱离体繁殖技术体系研究[D].福州:福建农林大学,2008.
[11]笠原俊策,韓東生,新美芳二,等.基于茎尖培养的日本晚樱品种Juzukakezakura的苗木生产[J].新泻农业部报告,2007(1):33-38.
[12]王慧娟,孟月娥,赵秀山,等.樱花组培苗的移栽技术研究[J].河南农业科学,2006(11):99-101.
S685.99
B
1674-7909(2016)08-06-5

