靶向纳米材料作为大鼠单个核细胞基因载体的研究*
董亚贤,尧慧燕,梁 兵,钟高贤,刁芳明,石红婷
(广州医科大学 1.附属第一医院神经内科;2.附属第四医院神经内科;3.附属第二医院神经内科,广东 广州 510000)
靶向纳米材料作为大鼠单个核细胞基因载体的研究*
董亚贤1,尧慧燕2,梁兵3,钟高贤2,刁芳明2,石红婷2
(广州医科大学1.附属第一医院神经内科;2.附属第四医院神经内科;3.附属第二医院神经内科,广东广州510000)
目的:探讨纳米材料聚乙二醇-聚乙烯亚胺(PEG-PEI)作为基因载体的可行性研究,研究其负载质粒DNA(pDNA)的能力,分析所形成纳米材料/pDNA复合物的特性,以及体外对细胞的毒性大小及其转染效率。方法:以PEI为对照,合成PEG-PEI,采用MTT法检测所形成纳米材料/DNA复合物对大鼠单个核细胞(PBMC)的细胞毒性,再采用倒置荧光显微镜及流式细胞仪检测转染效果。结果:N/P<10时,PEG-PEI和PEI的存活率分别为82.7%及81.3%(P﹥0.05);N/P=10时,PEG-PEI是81%,PEI为59% (P<0.05);N/P﹥10时,PEG-PEI的细胞存活率比PEI低(P<0.05)。N/P=10时,用倒置荧光显微镜观测PEG-PEI较PEI表达的绿色荧光多,荧光强度大(P<0.05);同时利用流式细胞仪检测PEG-PEI和PEI的转染效率,分别为28.9%和12.5%(P<0.05)。结论:纳米材料PEG-PEI具有强的负载能力,转染效率高,细胞毒性低的优点,为作为多发性硬化基因载体的可行性奠定了实践基础。
纳米材料;PEG-PEI;体外基因转染
多发性硬化(Multiple Sclerosis,MS)是一种慢性、炎症性、脱髓鞘的中枢神经系统疾病[1-2]。目前免疫调节治疗是治疗MS的主要策略,但免疫治疗并没有使用针对MS病理上存在变性、坏死的神经保护治疗,因而疗效差、预后差[3]。因此,非常有必要进一步探讨能促进神经轴突和髓鞘再生的有效治疗MS的方法。近年来随着分子生物学与基因工程技术的发展,多发性硬化的转基因治疗研究取得了一定的进展。然而基因治疗中最关键的是将质粒DNA导入细胞中,而后进入细胞核,单纯质粒DNA很难直接进入细胞,从而高效、安全的基因传输载体也是关键因素[4-5]。本文旨在合成聚乙二醇(Polyethyleneglycol,PEG)-聚乙烯亚胺(Polyethylenimine,PEI),并研究其负载质粒DNA(pDNA) 的能力,同时在体外检测了其细胞毒性和转染效率,评估PEG-PEI的基因转染效率及细胞毒性作用, 为寻找崭新的、行之有效的基因治疗方法打下理论和实践基础。
1 材料与方法
1.1实验试剂大鼠单个核细胞(PBMC)购自美国ATCC公司,DMEM培养基购自Invitrogen公司,质粒小提试剂盒购自日本BioFlux公司。其余大多数化学试剂,包括PEI、PEG、MTT均从美国Sigma公司购买,PEG-PEI本实验自备而成。
1.2质粒DNA(pDNA)的制备本研究应用能表达绿色荧光蛋白的pAAV-EGFP。质粒在宿主菌大肠杆菌DH5α株中扩增,然后用BioFlux的质粒提取试剂盒提取纯化。得到的质粒通过紫外分光计在260 nm和280 nm波长处检测其纯度,然后在1.0%的琼脂糖凝胶上以100 V电压电泳40 min,检测其完整性。检测合格的质粒保存于-20 ℃备用。
1.3细胞来源及培养大鼠单个核细胞由本实验室保存。用加有10%FBS和1%抗生素(青霉素/链霉素)的DMEM培养基在5%CO2培养箱37 ℃中培养。
1.4PEG-PEI/质粒DNA复合物的制备在Eppendorf管中,将1 μg pDNA稀释在50 μ0不含FBS的DMEM中,振荡均匀,按不同N/P比把相应量的纳米材料加入到另外一管装有50 μ0不含FBS和抗生素的DMEM的Eppendorf管中混匀,静置约5 min后把两溶液混合,在室温下用漩涡振荡器低速振荡5 min得到均匀复合物,37 ℃静置30 min以保证pDNA与纳米粒的充分结合。
1.5聚合物粒径和zeta-电位的测量纳米材料和pAAV-EGFP按不同N/P(N/P是指阳离子聚合物中的NH4+与DNA中的PO3-摩尔比例)比在37 ℃下混合振荡30 min复合后,在ZetaPALS-电位分析仪上测定,条件为25 ℃,入射光波长为625 nm。
1.6琼脂糖凝胶电泳PEG-PEI和PEI分别配制成一系列不同浓度的磷酸缓冲溶液,纳米粒子溶液与pDNA按N/P比为0、0.5、1、5、10、20、30和40漩涡震荡复合后, 室温静置30 min。上样前和6倍的琼脂糖染色剂结合,上样到含有溴化乙锭EB(0.1 μg·mL-1)的1.0%琼脂糖胶板上,在PBS中以100 V的电压电泳40 min,通过紫外灯观测结果并摄片记录。
1.7细胞毒性检测(MTT法)MTT法具体实验过程如下:PBMC细胞以每孔6 000个细胞接种在96孔板中;按不同的N/P分别为5、10、20、30计算出相应的纳米材料浓度,24 h后每孔加入150 μL 含150 ng 质粒DNA的纳米材料/pDNA复合物的不含血清培养液进行转染,每个N/P浓度复设四个复孔,48 h之后加入20 μL MTT溶液(5 mg·mL-1),继续培养4 h,小心吸出孔内培养上层清液后,加入100 μL DMSO,室温振荡5 min后,通过化学发光酶标仪测定在570 nm处的吸光值(OD值)。细胞活性(%)=(实验组OD值均值-调零组OD值均值)/(对照孔OD值均值-调零组OD值均值)×100%。
1.8细胞转染效果实验将细胞以1×105细胞每孔接种在24孔板上培养24 h,待细胞汇合度为70%,在转染前4 h用200 μL不含FBS或含FBS的DMEM培养基置换培养液,把其吸走后每孔加入含有2 μg pDNA不同N/P比的PEG-PEI /质粒和200 μL不含FBS或含10%FBS的DMEM培养基,在37 ℃下培养4 h,吸去转染液,加入完全DMEM培养基在37 ℃下二氧化碳培养箱中继续培养24 h。pAAV-EGFP同纳米材料复合后对PBMC细胞转染后,弃去上层培养液,采用倒置荧光显微镜观测转染结果,并采用流式细胞术检测转染效率。
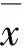
2 结 果
2.1纳米材料复合物的粒径和zeta-电位如图1所示,在ZetaPALS电位分析仪上测定PEG-PEI/ pDNA和PEI/ pDNA的粒径和zeta-电位,PEG-PEI和PEI纳米复合体粒径随着N/P从1到30的增大而减小,表面电荷随着N/P从1到30的增大而增大,同时在同一N/P下PEG-PEI/ pDNA较PEI/pDNA粒径大,而电荷相对较低,结果表明PEG-PEI/pDNA结合的比较好。

图1PEI与PEG-PEI在不同的N/P比下形成纳米复合体后的粒径和zeta-电位
2.2琼脂糖凝胶电泳如图2所示,右图为对照组PEI的pDNA结合能力,发现在N/P比值为0.5以上时,泳动才能被完全阻滞。左图为PEG-PEI/pDNA结合后的电泳结果,发现当N/P=0.5时,PEG-PEI就完全结合pDNA。上述结果提示PEG-PEI与pDNA的结合能力较对照组PEI的更强,并有利于基因的转染。
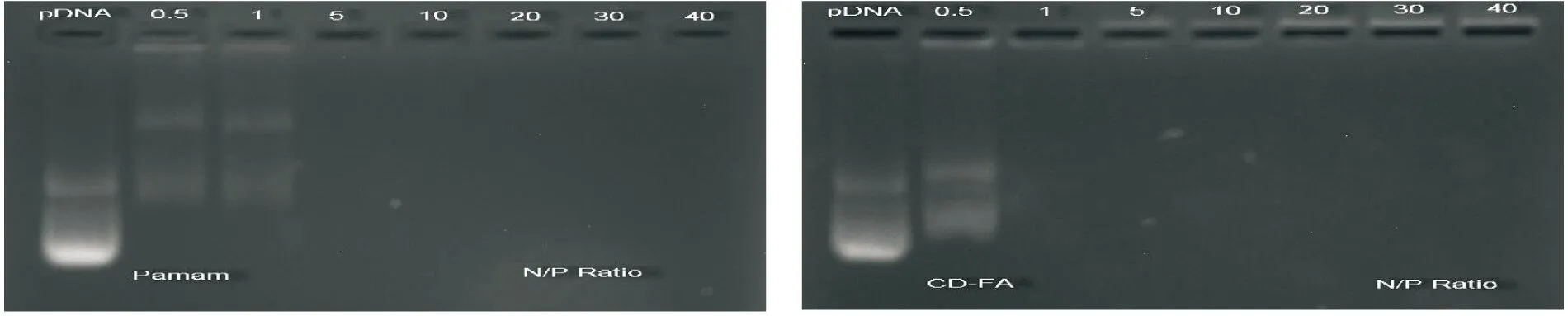
图2PEI与PEG-PEI在不同的N/P比下形成复合物后的琼脂糖凝胶电泳结果
2.3细胞毒性检测结果从图3可以得出,在PBMC细胞中,N/P<10时PEG-PEI/pAAV-EGFP和PEI /pAAV-EGFP的存活率相当;N/P=10时PEG-PEI/pAAV-EGFP是81%,比PEI/pAAV-EGFP(59%)的细胞存活率要高(P<0.05);N/P﹥10时PEG-PEI/pAAV-EGFP的细胞存活率比PEI /pAAV-EGFP低(P<0.05)。显示在N/P=10时,PEG-PEI作为基因治疗载体有很大的优势。

图3PEI与PEG-PEI形成复合物后在PBMC细胞中的细胞毒性
2.4细胞转染结果在PBMC细胞中,用倒置荧光显微镜观测N/P=10时PEG-PEI/pAAV-EGFP复合物表达的绿色荧光多,荧光强度大,因此提示PEG-PEI的转染效果较PEI好,差异有统计学意义(P<0.05,图4)。同时利用流式细胞仪检测N/P=10时PEG-PEI/pAAV-EGFP和PEI/pAAV-EGFP在PBMC细胞的转染效率,同样发现PEG-PEI/pAAV-EGFP的转染效率最好,为28.9%;PEI/pAAV-EGFP 为12.5%,结果比较差异有统计学意义(P<0.05,图5)。

N/P=10
注:采用倒置荧光显微镜观察PEI/pDNA和PEG-PEI/pDNA
在N/P比=10时转染PBMC细胞后的荧光细胞表达。
图4PEI与PEG-PEI形成复合物后在PBMC细胞中的绿色荧光蛋白表达水平

注:在N/P=10时,通过流式细胞仪检测PEI/pDNA和PEG-
PEI/pDNA的转染效率。
图5PEI与PEG-PEI形成复合物后在PBMC细胞中的转染效率
3 讨 论
在基因治疗研究领域,载体是至关重要的问题,因此安全高效的基因载体是实现基因治疗的关键因素[6-7]。国内外相关研究报道[8-9]PEI的DNA亲和性好,有利于DNA的复合及凝集,并利用PEI的“质子海绵”功能,纳米粒子在酸性溶酶体内可以迅速地发生分子链构象变化,产生较强的渗透压而破坏溶酶体并释放自由DNA。另外,PEG可以屏蔽正电荷而降低载体的阳离子毒性,同时它还能提高纳米粒子在血液中的稳定性、增强载体对DNA分子的保护作用而使DNA在传输过程中不被酶降解、延长聚合物-DNA纳米粒子的体内循环时间,这些因素有利于获得更好的基因传输效率。因此本实验合成并体外检测了PEG-PEI的理化特性、毒性和靶向传输及转染能力。
本实验考虑到由于粒径和zeta-电位是衡量复合物结合细胞能力进入细胞的重要参数,从而合适的粒径和表面电荷将有助于复合物通过有效的途径进入细胞膜。因此我们通过Zeta电位仪研究复合物的粒径和表面电荷,本研究发现同一N/P下PEG-PEI/pDNA较PEI/pDNA粒径大,而电荷相对较低,结果显示PEG-PEI/ pDNA结合的比较好。
相关研究曾证实[10]因为核酸分子带负电荷,当加入阳离子聚合物时,随着聚合物含量的增加,会出现电中和甚至反转从而使DNA向电场阳极泳动阻滞的现象,因此我们可以通过琼脂糖凝胶电泳来确定阳离子载体与DNA的相互作用。本研究所示,当N/P=0.5时,PEG-PEI就完全结合pDNA,而对照组PEI,发现在N/P比值为0.5以上时,泳动才能被完全阻滞。上述结果提示PEG-PEI较对照组PEI有更强的pDNA结合能力,从而提高基因转染能力。
基因载体的转染效率与纳米材料或者复合体的细胞毒性相关,如果复合物的毒性高,则相应的转染表达水平也可能会下降[11]。我们发现在PBMC细胞中,N/P<10时PEG-PEI/pAAV-EGFP和PEI /pAAV-EGFP的存活率相当,N/P=10时PEG-PEI/pAAV-EGFP比PEI/pAAV-EGFP的细胞存活率要高,而N/P﹥10时PEG-PEI/pAAV-EGFP的细胞存活率比PEI /pAAV-EGFP低,说明纳米材料在改造后同样用量的时候毒性大大降低了。同时本研究采用荧光显微镜及流式细胞仪衡量复合物在PBMC细胞中转染效果。我们观测到N/P=10时PEG-PEI/pAAV-EGFP复合物表达的绿色荧光较多,荧光强度更大,因此提示PEG-PEI的转染效果较PEI好,另外流式细胞仪检测结果也证实了同样的结果。
综上所述,本研究明确了PEG-PEI的基因转染效率及细胞毒性作用,同时证实PEG-PEI各方面的性能都优于PEI,从而提示我们PEG-PEI可以作为PBMC细胞基因传输的载体。
[1]孙博,李呼伦.在多发性硬化的免疫病理过程中不同免疫细胞的作用[J].中国免疫学杂志,2015,31(12):1585-1590.
[2]刘路,杜芳腾,文艺,等.RLRs 治疗多发性硬化症的研究进展[J].天津医药,2016,44(1):117-120.
[3]Raphael I,Nalawade S,Eagar TN,et al.T cell subsets and their signature cytokines in autoimmune and inflammatory diseases[J].Cytokine,2015,74(1):5-17.
[4]Deng JJ,Li N,Mai KJ,et al.Star-shaped polymers consisting of a beta-cyclodextrin core and poly(amidoamine) dendron arms:binding and release studies with methotrexate and siRNA[J].Journal of Materials Chemistry,2011,21(14):5273-5283.
[5]Bardi G,Malvindi MA,Gherardini L,et al.The biocompatibility of amino functionalized CdSe/ZnS quantum-dot-Doped SiO2 nanoparticles with primary neural cells and their gene carrying performance[J].Biomaterials,2010,31(25):6555-6566.
[6]Guo X,Huang L.Recent advances in nonviral vectors for gene delivery[J].Acc Chem Res,2011,45(7):971-979.
[7]Obata Y,Ciofani G,Raffa V,et al.Evaluation of cationic liposomes composed of an amino acid-based lipid for neuronal transfection[J].Nanomedicine:nanotechnology, biology,and medicine,2010,6(1):70-77.
[8]谢黎崖,胡权,吴永良,等.叶酸和聚乙二醇双修饰的壳聚糖纳米粒的制备及其性能表征[J].中国现代应用药学,2013,30(3):284-289.
[9]Liang C,Yang Y,Ling Y,et al.Improved therapeutic effect of folate-decorated PLGA-PEG nanoparticles for endometrial carcinoma[J].Bioorganic & medicinal chemistry,2011,19(13):4057-4066.
[10]Shuai X,Merdan T,Unger F,et al.Novel biodegradable ternary copolymers hy-PEI-g-PCL-b-PEG:synthesis, characterization, and potential as efficient nonviral gene delivery vectors[J].Macromolecules,2003,36(15):5751-5759.
[11]Martin-Montanez E,Lopez-Tellez J F,Acevedo M J,et al.Efficiency of gene transfection reagents in NG108-15,SH-SY5Y and CHO-K1 cell lines[J].Methods Find Exp Clin Pharmacol,2010,32(5):291-7.
A Study of Targeted Nano Materials as PBMCs Gene Vector
DONGYan-xian1,YAOHui-yan2,LIANGBing3,ZHONGGao-xian2,DIAOFang-ming2,SHIHong-ting2
(1.Dept.ofCerebrovascular,TheFirstAffiliatedUnionHospitalofGuangzhouMedicalUniversity,GuangdongGuangdong510150;2.Dept.ofCerebrovascular,TheForthAffiliatedUnionHospitalofGuangzhouMedicalUniversity,GuangzhouGuangdong511447;3.Dept.ofCerebrovascular,TheSecondAffiliatedUnionHospitalofGuangzhouMedicalUniversity,GuangdongGuangdong510000)
Objective: To investigate the feasibility of targeted nanoparticles as gene vector, we synthesized polyethyleneglycol polyethylenimine(PEG-PEI),and studied its capability of carrying plasmid DNA, analyzed its characterization as nanoparticle/DNA complex, assessed its cytotoxicity in vitro and measured its transfection efficiency. Methods: using PEI as control, we first developed PEG-PEI, and tested its cytotoxicity to the rat PBMCs via MTT assay. The transfection efficiency of the nanoparticle/DNA complex was also measured by EGFP immunofluorescence and flow cytometry. Results: When the N/P <10, the viability of PEG-PEI and PEI transfected cells were 82.7% and 81.3% respectively (P﹥0.05); when the N/P =10, the viability of PEG-PEI transfected cells was 81%, but that of PEI transfected cells was 59% (P<0.05); similarly, when the N/P﹥10, MTT assay results showed that the toxicity of the PEG-PEI was lower than PEI (P<0.05). The EGFP intensity of PEG-PEI (N/P =10) was much higher than PEI(N/P =10,P<0.05)assessed by inverted microscope fluorescence observation method;the flow cytometry results also showed that the transfection efficiency of PEG-PEI (N/P=10) and PEI(N/P=10) was 28.9% and 12.5%, respectively (P<0.05). Conclusion: The nanopaticle (PEG-PEI) exhibited lower toxicity and higher transfection efficiency, and therefore is the more suitable transfection carrier for gene therapy for multiple sclerosis.
Nano materials;PEG-PEI; In vitro gene transfer
广东省自然科学基金(批文号:S2013010011760)
R285.5
A
1001-5779(2016)03-0343-04
10.3969/j.issn.1001-5779.2016.03.003
2016-01-26)(责任编辑:敖慧斌)

