一株耐NaHCO3高含油绿藻的筛选鉴定
周 虹高 宏徐旭东孔任秋
(1. 中国科学院水生生物研究所, 淡水生态和生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
研究简报
一株耐NaHCO3高含油绿藻的筛选鉴定
周 虹1,2高 宏1徐旭东1孔任秋1
(1. 中国科学院水生生物研究所, 淡水生态和生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
传统化石能源储量日益减少, 化石能源燃烧后产生的二氧化碳是全球变暖的主要元凶, 因此, 能够替代传统化石燃料、可再生的新型能源受到广泛的关注, 生物柴油便是较为理想的新型能源之一[1]。虽然油料作物、废弃油脂等为生物柴油生产提供了部分原料, 但其成本、规模及可持续性受多种因素的制约[2]。目前, 利用光合自养的微藻生产生物柴油的潜在价值已经得到广泛的认可, 微藻生物柴油技术在减少CO2排放、大规模培养、产油效率等方面的优势日益突显[3]。微藻生物柴油的生产是一个系统的工程, 获得产油率高、生长性能良好的藻株是实现微藻生物柴油生产的前提[4]。优良藻种缺乏以及藻种优良性状不稳定均是产油微藻规模化生产的限制因素[5]。
微藻筛选过程中最主要的评价指标是藻株的含油量和油脂积累速率[6], 同时还响到生物柴油的质量和稳定性。近年来, 国内外的研究者们在对已有藻种产油性能的评价及培养条件的优化方面做了大量的工作[9]。然而,自然界中微藻资源丰富、生境范围广, 可用于生物柴油生产的优良藻种有待进一步的发掘。从野外分离筛选的产油微藻对温度、光照和培养基的盐度具有较广的耐受性, 能更好地适应环境条件的变化, 更适用于大规模培养。席玮芳等[10]利用沙漠地下水培养产油微藻, 分离到了一些耐高碱、高盐等极端条件的藻种, 这些藻可以利用沙漠和盐碱滩涂等非农用土地作为的规模化培养基地, 且在室外大量培养时较好地避免其他微生物的侵害。本研究对一些野外采集分离的含油藻株进行了筛选和评价, 意在获得耐受高盐碱条件且高产油的藻株。
1 材料与方法
1.1 藻种初步筛选
本研究所用藻种是从我国河北、山西的河流、湖泊、水库及污水处理厂等水体中采集水样, 经稀释涂布平板的方法分离纯化, 薄层层析初步筛选[11]出含油的藻种。
1.2 藻种显微镜观察和18S rDNA测序
取少量处于对数生长期的藻细胞液, 置于Olympus BX41型光学显微镜下观察藻细胞形态结构并拍照。采用CTAB法提取藻株的基因组DNA[12], 以通用引物18S-1 : 5′-tggttgatcctgccagtagtc-3′/18S-2 : 5′-tgatccttctgcag gttcacc-3′[11,13]进行PCR 扩增获得相应 18S rDNA 片段。通过琼脂糖凝胶电泳分离并用胶回收试剂盒(Bioflux)回收目的片段, 获得18S rDNA 基因片段。将回收的片段克隆到 pMD18-T (Takara)载体上, 测序得到对应藻株的18S rDNA序列, 提交NCBI GenBank比对分析, 使用ClustalX进行对位排列后用软件MEGA5.1构建进化树。
1.3 柱状光反应器培养
将所有藻株接种于20 mL BG11[14]或含0.1 mol/L NaHCO3的BG11(高碱BG11)液体培养基中, 于30℃、30 μE/(m2·s)条件下24h连续光照静置培养至对数期。再同时接种至NaNO3浓度分别为1.50和0.15 g/L 的150 mL BG11或高碱BG11培养基的柱状光生物反应器(直径d=3 cm, 柱高h=50 cm), 初始接种光密度OD680约为0.05.柱状光生物反应器双侧光强均为200 μE/(m2·s), 培养温度为30℃, 24h连续光照, 空气压缩泵通入含有CO2的压缩空气 (3% CO2)。培养至平台期后离心收集藻细胞, 冷冻真空干燥后提取总脂。
1.4 总脂含量及油脂积累速率分析
总脂的提取及定量参照文献[15], 略有改动。用分析天平称取100 mg冷冻干燥的藻粉, 加入一定体积的氯仿: 甲醇 (1︰1) 溶液超声破碎细胞并萃取充分, 再加入1/3体积的灭菌超纯水分层, 离心收集下层的氯仿层, 转入已称重的称量瓶中, 氮气吹干有机溶剂后, 称重, 计算总脂的含量和油脂积累速率。总脂含量 (C, lipid content,%)和油脂积累速率[PL, lipid productivity, mg/(L·d)]计算公式[9]:
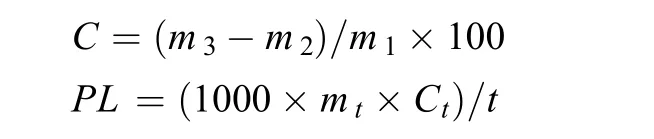
以上两式中: m1为提取总脂时称取藻粉的质量(g), m2为称量瓶的质量(g), m3为提取的总脂和称量瓶的总质量(g), mt为藻株收获时单位培养体积的干重(g/L), Ct为收获时总脂含量(%), t为培养时间(d)。
1.5 回收甘油三酯
方法参照文献[16]略改动。称取约20 mg总脂, 溶于500 mL三氯甲烷后, 上样于硅胶薄层层析板(Silica gel 60, Merk KgaA Darmstadt), 以0.02 mg甘油三酯(Triolein,Sigma)标准品为参照, 置于以正己烷︰乙醚︰乙酸(体积比为70︰30︰1)为展层剂的体系中分离。切下硅胶板上标准品所在的一小块, 利用碘蒸气显色[17]后拼回原位即可指示出样品中甘油三酯的位置。用小刀刮取该位置的全部硅胶粉, 溶于4 mL三氯甲烷, 离心后收集有机相于已称重的称量瓶中, 重复萃取3次, 氮气吹干后称重, 计算甘油三酯含量。
1.6 总脂和甘油三酯的脂肪酸组分分析
将柱状光反应器培养藻株所提取的藻细胞总脂和甘油三酯(各10 mg)进行甲酯化[11], 用正己烷反复萃取3次后氮气吹干, 溶于100 μL正己烷中, 取1 μL用气相色谱分析仪(Ultra Trace, Thermo Scientific) 进行脂肪酸组成分析, 脂肪酸分析方法参照文献[18]。
2 结果
2.1 产油藻的初步筛选和鉴定
从野外分离纯培养的藻株中经薄层层析筛得到含油的藻种, 包括淡水藻株和耐高碱(0.1 mol/L NaHCO3)藻株, 进一步测定总脂含量, 筛选到6株总脂含量超过30%的藻株, 其采样点和培养基类型如表 1所示。
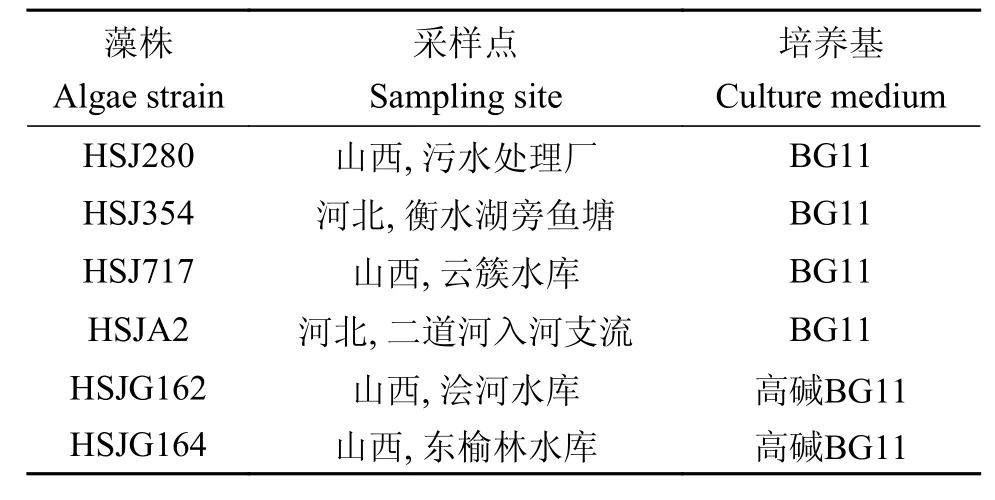
表 1 六株藻的采样点和培养基类型Tab. 1 Sampling sites and culture media of 6 algal strains
将以上6株绿藻培养至对数期, 进行显微拍照。其中HSJ280和HSJ354的细胞较大(图 1A、B), HSJ280为4个椭圆形的细胞并排生长在一起, 长度大于10 µm, 细胞具1个蛋白核, 两端各具1刺状附属物。HSJ354细胞为纤长的梭形, 长度约为20 µm, 两端尖细, 色素体片状, 无蛋白核。HSJ717也是2个或4个椭圆形的细胞并排生长在一起(图 1C), 细胞的两端各具1刺状附属物, 1个蛋白核, 长度5 µm左右。HSJA2和HSJG162(图 1D、E)细胞形态为月牙形, 细胞较为弯曲, 细胞两端略尖, HSJA2细胞的长宽比较大, 长约 5 µm左右。HSJG162细胞较小, 细胞长2—3 µm。HSJG164(图 1F)细胞为短粗的纺锤形, 细胞中部稍凸起。
以6株藻的基因组DNA为模板, 通过PCR扩增得到18S rDNA 片段并进行测序, 提交NCBI GenBank 获得序列号, 将其序列与GenBank中一些绿藻的18S rDNA序列一起构建系统树(图 2)。不同系统分析方法构建的18S rDNA系统树具有相似的拓扑结构。图2中HSJ280和链带藻 (Desmodesmus communis)聚集在一起, HSJ717虽与栅藻(Scenedesmus armatus)及链带藻(Desmodesmus ommunis)的关系都较近, 但是HSJ280和HSJ717两者细胞两端均具有刺状附属物, An等[19]将广义的栅藻属中具刺状附属物的种类定义为链带藻, 因此判断HSJ280和HSJ717为链带藻属的种类。 HSJ354与单针藻(Monoraphidium sp.)及纤维藻属(Ankistrodesmus falcatus var. tumidus)同时聚集在一起, 但其形态具有典型的纤维属的特点, 因此将其归为纤维藻属的种类。HSJA2、HSJG162和HSJ164分别与不同的单针藻株系聚成一簇, 同时根据藻株形态判断其属于单针藻属。
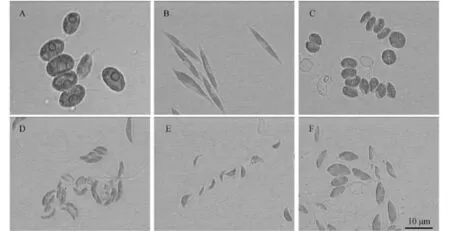
图 1 光学显微镜下6株绿藻的显微照片Fig. 1 Light micrographs of 6 strains of green alga
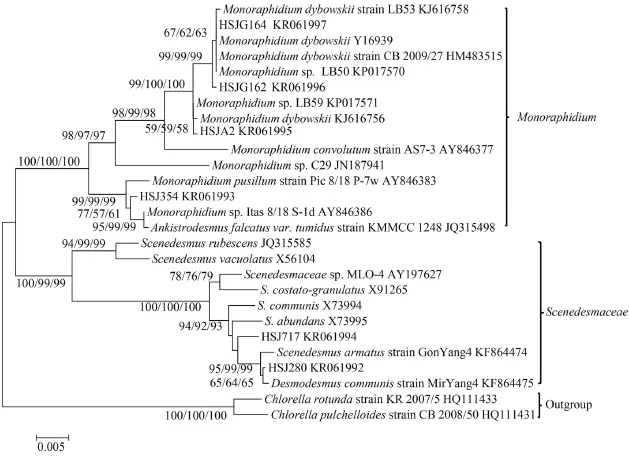
图 2 基于18S rDNA系列构建的6株绿藻的系统进化树Fig. 2 Phylogenetic tree of 18S rDNA sequences of green algae
2.2 基于总脂含量和油脂积累速率的藻种筛选
在NaNO3浓度分别为1.50和0.15 g/L的BG11培养基中, 利用柱状反应器培养这6株绿藻至第8天, 提取总脂,计算总脂含量和油脂积累速率(图 3)。藻株HSJG162在NaNO3浓度为1.50 g/L培养时的总脂达到细胞干重的45.4%, 其他藻株的总脂含量均在33%左右。其中HSJ280和HSJG164在两种条件下的总脂含量基本一致;HSJ717和HSJA2在高氮条件下的总脂含量均低于低氮条件下; 但对于HSJ354和HSJG162, 降低培养基中的NaNO3浓度, 藻株的总脂含量却有所下降。
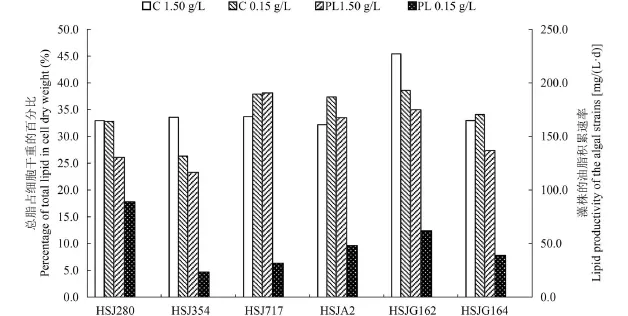
图 3 两种氮浓度条件下培养6株绿藻的总脂含量和油脂积累速率Fig. 3 Total lipid content and lipid productivity of 6 strains of green algae grown at different NaNO3concentrations
在不同的氮浓度条件下, 藻株的油脂积累速率差异很大。在培养基中NaNO3浓度为1.50 g/L时, 藻株的油脂积累均高于100 mg/(L·d)。这6株藻中油脂积累速率最高的藻株为HSJ717, 可达到190.6 mg/(L·d), 油脂积累速率最低的藻株HSJ354, 也达到了116.5 mg/(L·d)。当NaNO3浓度为0.15 g/L时, 6藻株的油脂积累速率均不足100 mg/(L·d), 最高为88.9 mg/(L·d)(HSJ280), 最低为23.4 mg/(L·d)(HSJ354), 约为氮充足条件下的1/5。
综合上述结果, 发现单针藻HSJG162既有最高的总脂含量, 又有较高的油脂积累速率, 而且能够以含0.1 mol/L NaHCO3的BG11进行培养, 是一株较为优质的藻种。
2.3 单针藻HSJG162产油性状的进一步分析
在柱状光反应器中对该单针藻HSJG162进行通气培养, 设3个平行, 至平台期收集藻细胞, 提取其总脂并分离其中的甘油三酯, 以称重法分别测定其总脂和甘油三酯的含量。结果显示HSJG162的总脂含量为细胞干重的(46.5±2.3)%; 其甘油三酯为细胞干重的(31.3±2.1)%, 可占到总脂的67%; 其油脂积累速率可达到(158.1±9.1) mg/(L·d)。
进一步将该藻株总脂和甘油三酯进行甲酯化处理,通过气相色谱分析其脂肪酸组分及相对含量。表 2显示,
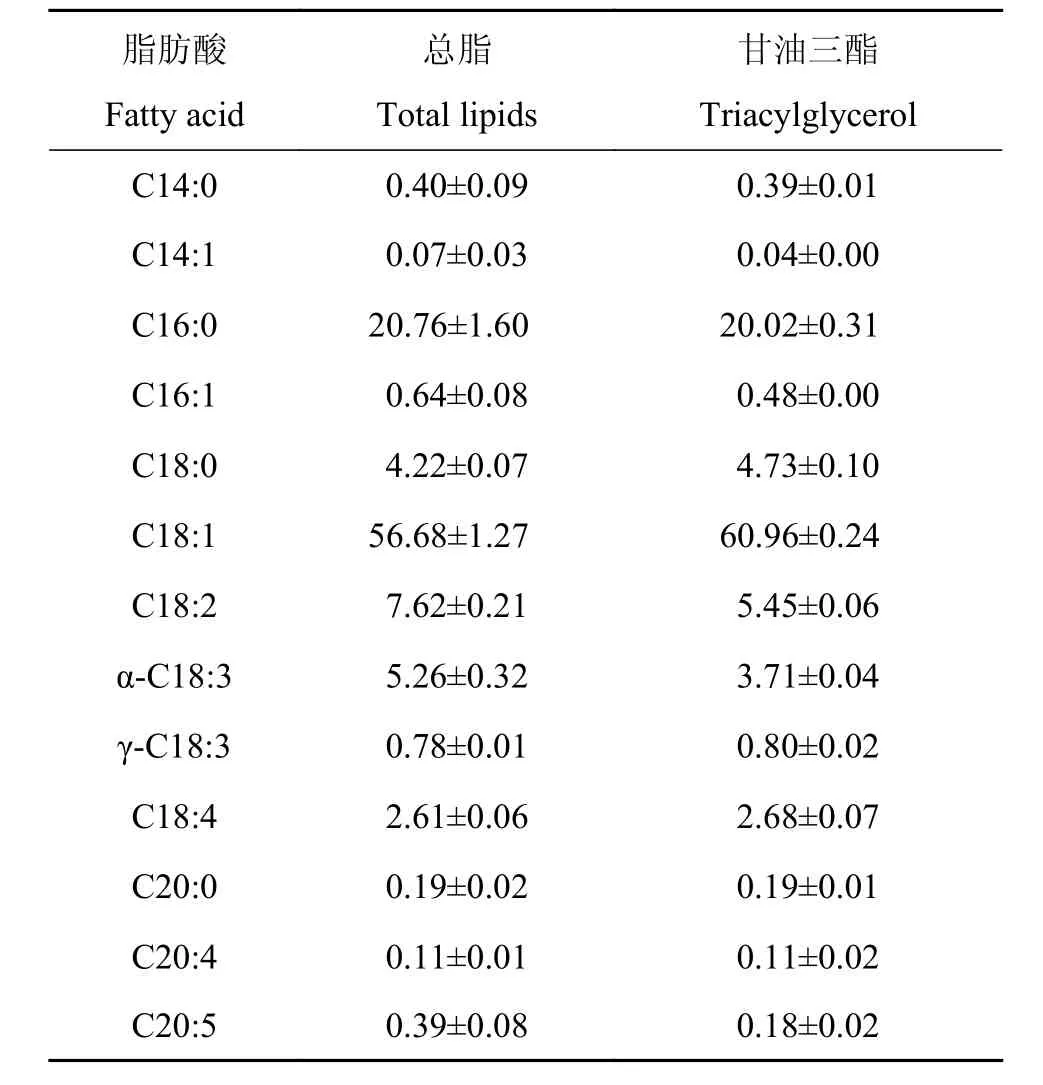
表 2 单针藻HSJG162总脂和甘油三酯的脂肪酸组成Tab. 2 Fatty acid composition (mol%) of total lipids and triacylglycerol of Monoraphidium sp. HSJG162
[1]Bozbas K. Biodiesel as an alternative motor fuel: Production and policies in the European Union [J]. Renewable and Sustainable Energy Reviews, 2008, 12(2): 542—552 HSJG162的总脂和甘油三酯中的脂肪酸组成相似, 含量最高的组分是C18:1(油酸), 其次为C16:0(软脂酸), 二者总含量均超过总脂的75%, 超过甘油三酯的80%; 饱和脂肪酸含量约为25%, 单一不饱和脂肪酸总量占总脂的57%, 占甘油三酯的61%左右; C16和C18系列的脂肪酸含量可达到99%。总脂和甘油三酯中多不饱和脂肪酸以α-亚麻酸和18碳4烯酸为主, 仅含有少量的20碳5烯酸。
3 讨论
油脂产量高、抗逆性强的藻种对生物柴油生产至关重要。本研究利用从野外采样并分离纯化的藻种, 经初步筛选得到6株含油量较高的藻株。通过对这6株藻进行形态学观察和18S rDNA序列分析, 判断其中HSJ280和HSJ717为栅藻科链带藻属(Desmodesmus)的种类, HSJ354属于纤维藻属(Ankistrodesmus), HSJA2、HSJG162和HSJ164属于单针藻属 (Monoraphidium)。栅藻科的种类是迄今为止已知的高产油绿藻之一, 在生物柴油、水产养殖和环境治理方面, 已有较多的研究[20]。纤维藻和单针藻是近年生物柴油藻种筛选过程中常见藻种, 具有较高的油脂含量和较快的生长速率[21]。在本研究中单针藻HSJG162和HSJ164为耐受NaHCO3的藻株, 由于其培养基离子浓度和pH都较高, 在培养时可以降低其他微生物的污染。
比较这6株藻在高氮和低氮条件下的产油情况, 发现HSJ354和HSJG162低氮培养时总脂含量却有所下降。这不同于以往低氮培养可以提高油脂积累量的结论[5]。在不同的氮浓度培养条件下, 藻株的油脂积累速率差异极为显著: 在培养基中NaNO3浓度为1.50 g/L时均有较高的油脂积累速率, 是其在NaNO3浓度为0.15 g/L时的2—6倍。这几株藻在以后的优化培养中, 需要进一步研究氮浓度与产油量和产油率的关系。
单针藻HSJG162在光合自养条件下其总脂含量可达细胞干重的(46.5±2.3)%, 同时具有相对较高的油脂积累速率(158.1±9.1) mg/(L·d), 高于多数已报道的自养培养条件下的产油微藻[5,21]。与多数藻种相比, 它还能够在高NaHCO3条件下生长; 而与本实验室已报道的耐NaHCO3藻株相比, 它又具有更高的油脂产率。优良的生物柴油对脂肪酸链的长度和不饱和度有一定要求, 应有较高的C16和C18含量, 尤其是C16:0(软脂酸)和C18:1(油酸), 这样有利于提高生物柴油的抗氧化性能,便于长久保存[22]。HSJG162的总脂和甘油三酯的脂肪酸组成相似, 都以C16和C18为主, 且大多为饱和与单一不饱和脂肪酸, 多不饱和脂肪酸含量较低。从产油性能、耐受NaHCO3能力和脂肪酸组成等方面考虑, HSJG162是一株较具生产潜力的藻种。
[2]Kirrolia A, Bishnoi N R, Singh R. Microalgae as a boon for sustainable energy production and its future research & development aspects [J]. Renewable and Sustainable Energy Reviews, 2013, 20: 642—656
[3]Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances [J]. The Plant Journal: for Cell and Molecular Biology, 2008, 54(4): 621—639
[4]Demirbas A, Demirbas M F. Importance of algae oil as a source of biodiesel [J]. Energy Conversion Managent,2011, 52(1): 163—170.
[5]Rodolfi L, Chini Zittelli G, Bassi N, et al. Microalgae for oil: strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J]. Biotechnology and Bioengineering, 2009, 102(1): 100—112
[6]Griffiths M J, Harrison S T. Lipid productivity as a key characteristic for choosing algal species for biodiesel production [J]. Journal of Applied Phycology, 2009, 21(5): 493—507
[7]Zeiler K G, Heacox D A, Toon S T, et al. The use of microalgae for assimilation and utilization of carbon dioxide from fossil fuel-fired power plant flue gas [J]. E-nergy Conversion Management, 1995, 36(6—9): 707—712
[8]Miao X L, Wu Q Y. Biodiesel production from heterotrophic microalgal oil [J]. Bioresource Technology, 2006,97(6): 841—846
[9]Zhou X, Ge H, Xia L, et al. Evaluation of oil-producing algae as potential biodiesel feedstock [J]. Bioresource Technolgy, 2013, 134: 24—29
[10]Xi W F, Gao H, Lan B, et al. Na2HCO3-tolerant oil-proctucing micoalgae that are suitable for cultivation with desert groundwater [J]. Acta Hydrobiologica Sinica,2015, 39(2): 414—418 [席玮芳, 高宏, 兰波, 等. 适于沙漠地下水培养的耐碳酸氢钠产油微藻. 水生生物学报,2015, 39(2): 414—418
[11]Xu J, Xu X D, Fang X T, et al. Screening and lipid analyses of high oleaginous Chlorella species [J]. Acta Hydrobiologica Sinica, 2012, 36(3): 426—432 [徐进, 徐旭东, 方仙桃, 等. 高产油小球藻的筛选及其油脂分析. 水生生物学报, 2012, 36(3): 426—432]
[12]Murray M, Thompson W F. Rapid isolation of high molecular weight plant DNA [J]. Nucleic Acids Research,1980, 8(19): 4321—4326
[13]Moon-van der Staay S Y, van der Staay G W, Guillou L,et al. Abundance and diversity of prymnesiophytes in the picoplankton comunity from the equatorial Pacific Ocean inferred from 18S rDNA sequences [J]. Limnology and Oceanography, 2000, 45(1): 98—109
[14]Stanier R, Kunisawa R, Mandel M, et al. Purification and properties of unicellular blue-green algae (order Chroococcales) [J]. Bacteriological Reviews, 1971, 35(2): 171
[15]Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification [J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911—917
[16]Xi W F. Physiology characteristics of four oleaginous green algae [D]. Thesis for Master of Science. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan. 2014 [席玮芳. 四株产油藻的生理特征. 硕士学位论文,中科院水生生物研究所, 武汉. 2014]
[17]Eizadora T Y, Zendejas F J, Lane P D, et al. Triacylglycerol accumulation and profiling in the model diatoms Thalassiosira pseudonana and Phaeodactylum tricornutum (Baccilariophyceae) during starvation [J]. Journal of Applied Phycology, 2009, 21(6): 669—681
[18]Li X B, Xu X D, Kong R Q. Studies on the production of oil and polyunsaturated fatty acids in five species of Nannochloropsis [J]. Acta Hydrobiologica Sinica, 2010,34(5): 893—897 [李秀波, 徐旭东, 孔任秋. 五种微绿球藻产油和产多不饱和脂肪酸的研究. 水生生物学报,2010, 34(5): 893—897]
[19]An S, Friedl T, Hegewald E. Phylogenetic relationships of Scenedesmus and Scenedesmus-like coccoid green algae as inferred from ITS-2r DNA sequence comparisons [J]. Plant Biology, 1999, 1(14): 418—428
[20]Mandal S, Mallick N. Microalga Scenedesmus obliquus as a potential source for biodiesel production [J]. Applied Microbiology and Biotechnology, 2009, 84(2): 281—291
[21]Bogen C, Klassen V, Wichmann J, et al. Identification of Monoraphidium contortum as a promising species for liquid biofuel production [J]. Bioresource Technology,2013, 133: 622—626
[22]Kim B H, Kang Z, Ramanan R, et al. Nutrient removal and biofuel production in high rate algal pond using real municipal wastewater [J]. Journal of Microbiology and Biotechnology, 2014, 24(8): 1123—1132
SELECTION AND IDENTIFICATION OF A NaHCO3-TOLERANT HIGH-OIL-CONTENT GREEN ALGAE
ZHOU Hong1,2, GAO Hong1, XU Xu-Dong1and KONG Ren-Qiu1
(1. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
生物柴油; 产油绿藻; 筛选; 脂肪酸组成
Biodiesel; Oleaginous green algae; Strain screening; Fatty acid composition
10.7541/2016.54
Q949.21
A
1000-3207(2016)02-0408-06
2015-04-08;
2015-08-16
科技基础性工作专项课题: 中国产油微藻调查(2012FY112900-04)资助 [Supported by Special Project of Science and Technology Foundational Work: Survey of Oleaginous Microalgae in China]
周虹(1989—), 女, 陕西咸阳人; 硕士研究生; 研究方向藻类生物技术。E-mail: zhou1989hong@163.com
孔任秋, E-mail: kongr@ihb.ac.cn

