泥沙埋深对苦草和微齿眼子菜及两物种混合分解的影响
曹丹丹 王 东 杨 雪 郭 璇 牛红玉
(华中师范大学生命科学学院, 地理过程分析与模拟湖北省重点实验室, 武汉 430079)
泥沙埋深对苦草和微齿眼子菜及两物种混合分解的影响
曹丹丹 王 东 杨 雪 郭 璇 牛红玉
(华中师范大学生命科学学院, 地理过程分析与模拟湖北省重点实验室, 武汉 430079)
为探讨泥沙淤积对水生植物分解的影响, 研究了沉水植物苦草(Vallisneria natans)、微齿眼子菜(Potamogeton maackianus)及两物种混合在底泥中不同埋深(0 和5 cm)的分解速率和养分动态, 实验周期为117d。结果显示:(1)在0和5 cm埋深处理下, 苦草、微齿眼子菜及两物种混合的分解速率均表现为苦草最快, 微齿眼子菜最慢, 物种混合介于两单种之间。与0 cm处理相比, 在5 cm埋深处理下苦草、微齿眼子菜及两物种混合的分解速率显著降低(P<0.05)。苦草在0和5 cm埋深处理下分解35天后干重剩余率分别为0和43.51%、在5 cm处理下分解82d后干重剩余率为0。微齿眼子菜和两物种混合在5 cm埋深处理下分解117d后的干重剩余率分别提高了31.09%和37.44%。(2)与0 cm处理相比, 5 cm埋深处理显著抑制苦草、微齿眼子菜及两物种混合的N、P释放。苦草在0和 5 cm埋深处理下分解35天后N剩余率分别为0和31.28%、P剩余率分别为0和24.45%。在5 cm埋深处理下分解117天后微齿眼子菜N和P剩余率分别提高了19.45%和14.73%、两物种混合N、P剩余率分别提高了41.57%和22.82%。(3)两物种混合在0和5 cm埋深处理下, 其分解速率均表现为加和效应, 但N、P元素释放在0 cm处理下分别表现为协同效应和加和效应, 在5 cm埋深处理下均表现为拮抗效应。(4)随着分解的进行, 5 cm埋深处理下的苦草和微齿眼子菜的微生物呼吸速率均显著降低, 物种混合的微生物生物量始终低于0 cm处理。这些结果表明泥沙埋深显著降低了苦草、微齿眼子菜及两物种混合的分解速率和N、P元素释放, 物种混合的N、P元素释放在分解后期均因沉积作用而产生了拮抗效应。此外, 泥沙埋深对分解的抑制作用与微生物呼吸及生物量降低有密切的关系。研究结果可为认识水生植物分解对沉积作用的响应机制提供资料, 并为了解水生植物分解对底质营养动态的影响提供参考。
水生植物; 泥沙埋深; 分解速率; N、P动态; 混合分解
植物有机质分解研究是生态系统结构和功能研究领域关注的重点, 目前关于森林、草地、沼泽以及河流和溪流的枯落物分解方面有较多研究[1—5],对高等水生植物分解的研究相对较少, 尤其在其分解规律的认识方面非常有限[6]。水文特征是影响水生生态系统分解的重要环境因素。其中, 泥沙淤积被认为对植物分解有重要影响[7—15]。前人研究表明, 泥沙淤积对河流中沿岸带植物枯落物分解、湿地及沼泽植物分解等有抑制作用[7—11], 或有促进作用或没有明显的影响[12,13]。泥沙淤积可阻隔空气的连通性造成缺氧环境影响微生物活动从而影响分解过程[14,15]。高等水生植物是水生生态系统中重要的初级生产者, 植物(或茎叶残体)死亡后经腐烂分解释放出无机营养元素, 但目前有关泥沙淤积对水生植物分解的影响研究较少[9,16]。另外, 有研究发现物种混合对植物分解的影响可表现为加和效应(即混合对分解速率和养分的释放没有显著影响), 或表现为非加和效应(即混合提高或降低分解速率和养分的释放)[17]。在自然状态下, 水生植物物种混合被泥沙包埋的现象普遍存在, 但有关泥沙淤积对水生植物混合分解的影响仍不清楚。
苦草(Vallisneria natans)和微齿眼子菜(Potamogeton maackianus)是长江中、下游湖泊常见的沉水植物[18], 在湖泊沿岸带分布广、生物量高, 在自然(如风浪、湖流等)或人类活动(捕捞鱼虾、打捞水草等)扰动下, 其植物(茎叶)残体常见以单种或物种混合形式堆积在湖泊沿岸带, 并经常受到泥沙包埋。本文运用受控实验模拟泥沙埋深, 研究了不同泥沙埋深处理下苦草、微齿眼子菜及两物种混合的分解速率、营养释放动态和微生物活动的变化, 以期为探讨水生植物分解对沉积作用的响应机制提供资料, 并为了解水生植物分解对底质营养物动态的影响提供参考。
1 材料与方法
1.1 实验材料
苦草和微齿眼子菜茎叶的新鲜材料于2013年7月中旬取自湖北省鄂州梁子湖(N 30°06′-30°18′, E 114°24′-114°36′)。材料经湖水洗净后带回实验室,自然风干后剪成5 cm大小的小段, 在60°C下烘干至恒重, 样品放入干燥器中备用。
1.2 实验方法
将烘干处理的苦草、微齿眼子菜及等量混合的苦草和微齿眼子菜三种样品各5 g分别装入分解袋(长宽为20 cm×15 cm, 网孔大小1 mm×1 mm)。实验设计为:2个埋深处理(0、5 cm)×3种材料(苦草、微齿眼子菜及两物种混合)×6次取样×3重复。采用经过筛处理(以去除杂质和根系)、洗干净的梁子湖底泥[总氮(1.95±0.05) mg/g, 总磷(0.12± 0.02) mg/g, 根据底泥干重获得]置于实验水池(200 cm×150 cm×100 cm)中, 泥厚约20 cm, 待稳定一周后, 将分解袋置于底泥表面和埋深5 cm处。每个处理每种材料12袋(每次取样2袋, 1袋用于测定材料干重、TN、TP等参数, 1袋用于测定微生物参数), 3个重复。实验共计3个实验水池, 216袋样品。部分剩余材料用于实验材料初始质量特征参数的测定。实验在华中师范大学生物园实验区(N 30°30′, E 114°21′)随机放置。水池上方做遮雨处理,实验过程中保持池中无杂物、分解袋和底泥保持湿润状态。
1.3 样品采集与参数测定
于2013年8月25日进行实验处理, 在分解袋放置后的第7、19、35、56、82和117天分别取样, 实验周期为117d。每种材料每次在每组处理中取6袋。随机取其中3份样品用于干重、TN、TP等参数的测定(分解袋用纯净水冲去沙子等杂物, 样品经60°C烘干至恒重, 称重后, 磨碎过0.25 mm筛),3份样品用于微生物呼吸速率及生物量的测定。
采用K2Cr2O7氧化-FeSO4滴定法测定TC, 经H2SO4-H2O2消化, 分别采用靛酚蓝比色法和钼锑抗比色法测定TN、TP, 采用范氏洗涤纤维分析法测定纤维素、半纤维素、木质素含量, 采用福林酚法测定总酚含量[19]。微生物呼吸采用静态碱液吸收法测定[20]。微生物生物量C采用氯仿熏蒸法测
按以往的经验,目前是低风险区。不过,我们计算一下此长期上升通道的上升速度,大约是按年11.2%。未来深圳证交所上市公司能以平均11.2%的增长速度持续下去吗?答案若是否定的,则此长期上升通道便会改变,即熊市的低点会击穿下轨。上证指数已经击穿下轨,证明市场对旧经济的增长速度预期已经明显下降。不过,即便是长期上升通道有效,目前距离下轨约1020点一带仍有19.5%的下跌空间。换言之,深圳综合指数至少再跌10%至15%买入的话,才有一定的安全边际。
定[21]。
1.4 数据分析
分解材料干重变化用Wt=W0×e-kt(t为分解时间;k为分解常数;W0为初始干重;Wt为经t天分解后的剩余干重)描述, 用非线性回归分析计算分解速率[22]。采用剩余率表示分解过程中干重和养分含量的变化, 干重剩余率和养分剩余率分别为分解后材料干重和养分剩余量占初始量的百分率。
混合材料的期望干重剩余率和养分剩余率根据Salamanca等[23]采用的方法计算:期望干重剩余率=[M1/(M1+M2)]×R1+[M2/(M1+M2)]×R2; 期望养分剩余率=[N1/(N1+N2)]×R1+[N2/(N1+N2)]×R2。式中,以1, 2表示混合物中的两种组分, M和N分别表示各组分在初始混合物中的干重和养分含量, R表示各组分单一物种的干重剩余率和养分剩余率。对混合分解的分解速率及N、P释放是否存在混合效应进行判断:若实测值与期望值之间差异显著(P<0.05), 则表示混合材料两物种之间存在非加和效应, 当实测值大于期望值, 则混合效应是负的, 即拮抗效应, 当实测值小于期望值, 则混合效应是正的, 即协同效应;若实测值与期望值之间差异不显著(P>0.05), 则表示混合材料两物种之间存在加和效应, 即无明显的相互作用。
使用统计软件SPSS 17.0进行数据分析。两种处理下材料的分解速率, 干重剩余率和N、P剩余率, 微生物呼吸速率及生物量的比较, 两单物种初始质量特征的比较以及两物种混合分解的实测值与期望值的比较均采用独立样本t检验;对苦草和微齿眼子菜的分解速率与其初始N含量、C/N的相关关系进行Pearson相关分析。
2 结果
2.1 苦草和微齿眼子菜的初始质量特征
苦草和微齿眼子菜在C、N、P、C/N、C/P、木质素、纤维素、半纤维素和总酚含量上存在显著差异(P<0.05)(表 1)。与苦草相比, 微齿眼子菜具有较高的C、C/N、C/P、木质素、纤维素、半纤维素和总酚含量和较低的N、P含量。
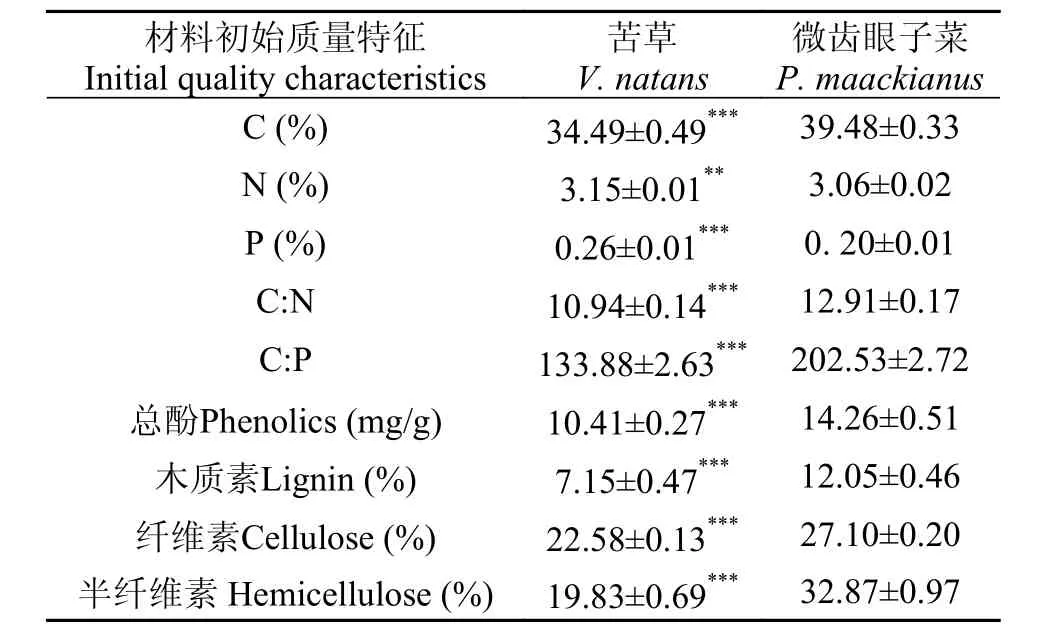
表 1 苦草和微齿眼子菜的初始质量特征Tab. 1 Initial quality characteristics of V. natans and P. maackianus materials
2.2 埋深对苦草、微齿眼子菜及两物种混合分解干重动态变化的影响
在0和5 cm埋深处理下, 两单种的分解快慢存在显著差异(P<0.05)。苦草在0和5 cm处理下分解35d后干重剩余率分别为0和43.51%, 在5 cm处理下分解82d后的干重剩余率为0, 分解速率分别为0.114/d和0.031/d;微齿眼子菜在0和5 cm处理下分解117d后其干重剩余率分别为22.18%和53.27%, 分解速率分别为0.022/d和0.007/d(表 2)。与0处理相比, 在5 cm处理下苦草和微齿眼子菜的分解速率显著降低。在两种处理下, 苦草均分解较快, 微齿眼子菜分解较慢(图 1)。Pearson相关分析表明, 在0和5 cm处理下, 苦草和微齿眼子菜的分解速率均与初始N含量呈正相关(P<0.05, r=0.896;P<0.01,r=0.932), 与C/N成负相关(P<0.05, r =-0.963;P<0.01, r =-0.925)。
两物种混合在0和5 cm处理下的干重损失均表现为先快后慢(图 1), 在分解117d后其干重剩余率分别为8.81%和46.25%, 分解速率分别为0.047/d和0.010/d, 其分解速率介于两单种之间(表 2)。与0处理相比, 在5 cm处理下的两物种混合在分解117d后的干重剩余率提高了37.44%。在分解过程中, 物种混合在0和5 cm埋深处理下干重剩余率的实测值与期望值均无显著性差异(P>0.05), 物种混合对分解速率的影响均表现为加和效应(表 3、4)。
2.3 埋深对苦草、微齿眼子菜及两物种混合分解的N、P释放动态的影响
苦草在0和5 cm处理下的N、P剩余率均呈快速下降趋势(图 2)。与0相比, 5 cm处理下苦草分解19d后N、P释放率显著降低, 其N、P剩余率分别提高了42.48%和17.06%;在分解35d后N剩余率分别为0和31.28%, P剩余率分别为0和24.45%。随着分解的进行, 在5 cm处理下苦草的N、P剩余率呈继续下降趋势, 82d后N、P剩余率为0。苦草在两种处理下的N、P元素均表现为净释放。微齿眼子菜在0和5 cm处理下的N、P剩余率在分解初期下降明显, 在分解7d后N的剩余率分别为56.93%和54.70%,P的剩余率分别为26.17%和28.88%, 随着分解的进行N元素持续释放, P元素则出现积累。与0相比,5 cm处理下微齿眼子菜分解56d后的N、P释放率显著降低, N、P剩余率分别提高了16.21%和15.37%。随着分解的进行, 微齿眼子菜的N、P剩余率保持平稳下降趋势, 5 cm处理下分解117d后的N、P剩余率分别比0处理提高了19.45%和14.73%(图 2)。微齿眼子菜在两种处理下的N、P元素均表现为净释放。两物种混合在0和5 cm处理下的N、P释放均表现为先快后慢(图 2)。与0处理相比, 5 cm埋深处理下物种混合分解117d之后的N、P剩余率分别提高了41.57% 和22.82%。总体上看, 在5 cm埋深处理下苦草、微齿眼子菜及两物种混合的N、P释放受到显著抑制(P<0.05)。
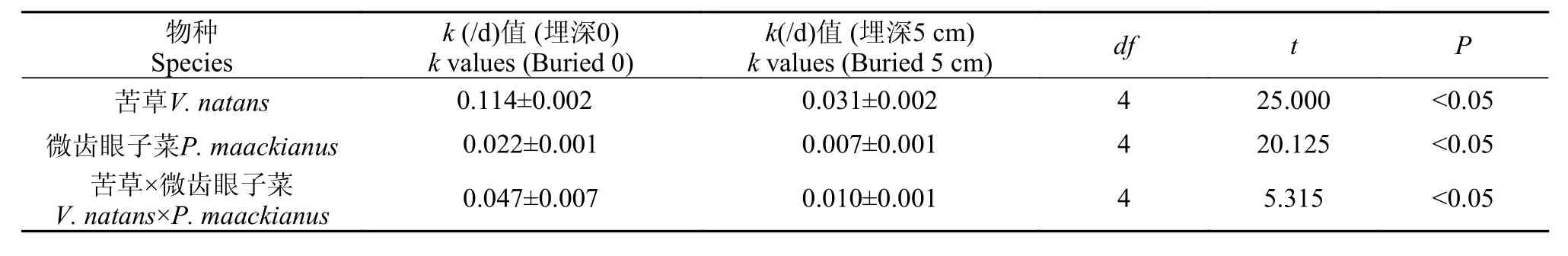
表 2 两种埋深处理下苦草、微齿眼子菜及两物种混合的分解速率比较Tab. 2 Comparison of the decomposition rates of V. natans, P. maackianus and their mixture in two burial depth treatments
在分解前期, 在0和5 cm 埋深处理下物种混合的N、P剩余率的实测值与期望值无显著性差异(P>0.05), 表现出加和效应。随着分解进行, 在0处理下的N剩余率实测值显著低于期望值(P<0.05),表现出协同效应, 即混合促进了N元素的释放, P剩余率实测值与期望值无显著差异, 即混合对P元素的释放无影响, 但在5 cm处理下的N、P剩余率实测值显著高于期望值(P<0.05), 表现出拮抗效应, 即混合抑制了N、P元素的释放(图 3)。

图 1 两种埋深处理下苦草、微齿眼子菜和两物种混合在分解过程中的干重剩余率(%)变化Fig. 1 Changes of dry mass remaining percentage (%) of V. natans, P. maackianus and their mixture during the decomposing process under two burial depth treatments
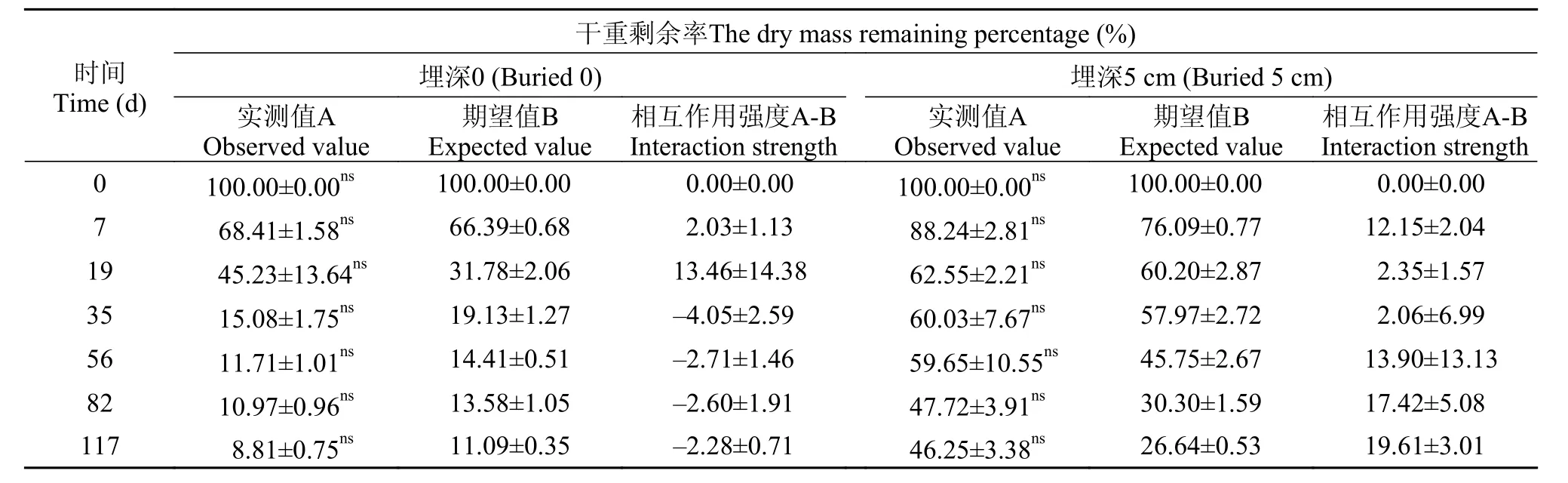
表 3 两种埋深处理下苦草和微齿眼子菜混合分解的干重剩余率(实测值和期望值)Tab. 3 Observed and expected values of the dry mass remaining percentage (%) of the mixed V. natans and P. maackianus in decomposition under two burial depth treatments
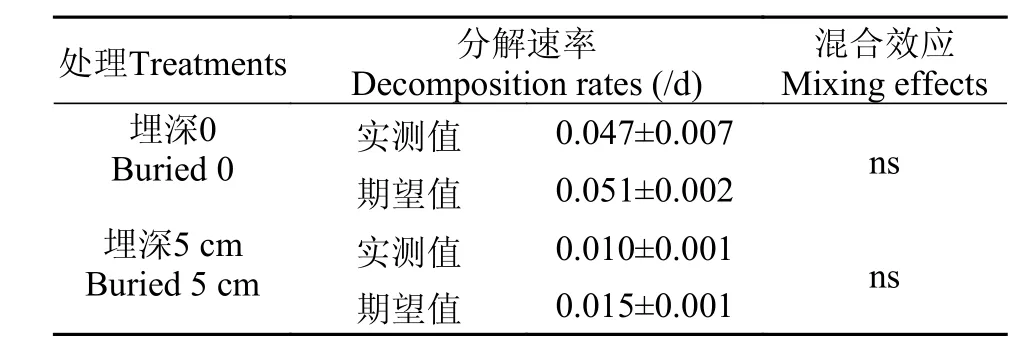
表 4 两种埋深处理下苦草和微齿眼子菜混合的分解速率(实测值和期望值)Tab. 4 Observed and expected decomposition rates of the mixture of V. natans and P. maackianus in decomposition under two burial depth treatments
2.4 苦草、微齿眼子菜及其混合分解过程中的微生物呼吸与生物量变化
与0处理相比, 苦草和微齿眼子菜在5 cm处理下的微生物呼吸速率显著降低(P<0.05)。苦草在0处理下的微生物生物量均高于5 cm处理;微齿眼子菜在两种处理下的微生物生物量在分解前期无显著性差异(P>0.05), 但5 cm处理下的微生物生物量在分解后期显著低于0处理(P<0.05)(图 4)。
两物种混合在两种处理下的微生物呼吸速率在分解前期无显著性差异(P>0.05), 5 cm处理下的微生物呼吸速率在分解后期显著低于0处理(P<0.05)(图 4)。物种混合在5 cm处理下的微生物生物量在分解过程中均低于0处理。除分解中期两种处理下的生物量差异不显著(P>0.05)外, 其余分解阶段均存在显著性差异(P<0.05)。
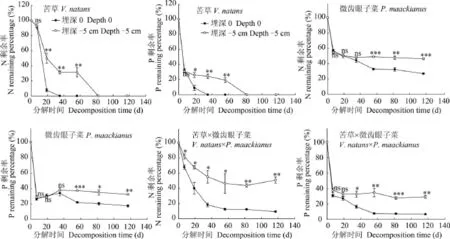
图 2 苦草、微齿眼子菜和两物种混合分解在两种埋深处理下的N、P剩余率(%)变化Fig. 2 Changes of nitrogen and phosphorus remaining percentages (%) of V. natans, P. maackianus and their mixture during the decomposing process under two burial depth treatments
3 讨论
3.1 泥沙埋深对苦草、微齿眼子菜及两物种混合分解快慢的影响
有研究发现, 泥沙淤积对河流中沿岸带植物枯落物、湿地和沼泽植物分解有明显的抑制作用[9—11,24,25]。在本研究结果中, 与0处理比较, 苦草、微齿眼子菜在5 cm埋深处理下的分解速率显著降低, 苦草在0和5 cm埋深处理下分别在分解35d、82d后干重剩余率为0, 微齿眼子菜在5 cm处理下分解117d后干重剩余率比0处理下提高了31.09%。这说明泥沙淤积也同样抑制苦草和微齿眼子菜的分解快慢。
植物的初始质量特征是影响植物分解快慢的因素之一。有研究表明, 初始N含量、C/N比对分解有较大影响, 初始N含量较高、C/N比较低其分解较快[26];具有较高P含量、较低C/P比的材料其分解也相对较快[27]。苦草较微齿眼子菜具有较高的N、P含量和较低的C/N、C/P比, 苦草在0和5 cm埋深处理下都比微齿眼子菜分解快。这说明苦草和微齿眼子菜的分解快慢也受其初始N、P含量所控制。另外, 有研究表明初始纤维素、半纤维素、木质素、总酚含量与分解快慢呈负相关[15,25,28]。苦草的初始纤维素、半纤维素、木质素、总酚含量显著低于微齿眼子菜, 苦草在两种处理下其分解速率都较微齿眼子菜高。其中, 苦草在埋深0处理下分解速率为0.114/d, 并于35d后分解完成, 在5 cm处理下分解速率为0.031/d, 并于82d后分解完成, 微齿眼子菜在0和5 cm处理下其分解速率分别为0.022/d和0.007/d, 在分解117d后其干重剩余率分别为22.18%和53.27%。这表明苦草和微齿眼子菜分解快慢不但与其初始N、P含量有关, 也受初始纤维素、木质素等含量的影响。
物种混合对分解的影响可表现为非加和效应(即混合提高或降低分解速率和养分的释放)或表现为加和效应(即混合对分解速率和养分的释放没有显著影响)[17]。有研究表明, 分解对物种混合的响应不但受混合物种各组分质量特征的控制, 而且受分解的环境条件的影响[17]。本研究结果中, 两物种混合在5 cm处理下的分解速率显著低于0处理, 分解117d后混合分解的干重剩余率提高了37.44%。这说明泥沙淤积抑制了两物种混合的分解。通常,在缺氧环境下植物枯落物分解变慢[8,15], 沉积可通过阻隔空气的连通性造成缺氧环境而抑制微生物活动, 从而降低枯落物的分解速率[10,11,14,15]。另外,沉积对分解材料所产生的挤压作用也可能通过减小微生物对分解材料的有效作用面积从而使枯落物的分解速率降低[8]。本研究结果中, 苦草、微齿眼子菜及其混合在5 cm埋深处理下的微生物生物量及呼吸速率均显著低于0处理, 微生物活动减弱,这很有可能是苦草、微齿眼子菜及其混合的分解速率在5 cm埋深下均显著降低的原因之一。
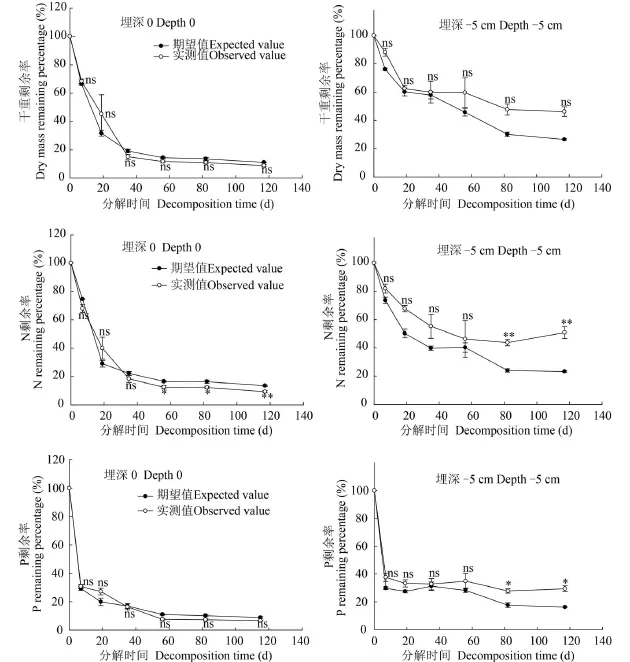
图 3 苦草和微齿眼子菜混合分解在两种埋深处理下的干重和N、P的实测剩余率(%)和期望剩余率(%)Fig. 3 The values of observed and expected dry mass and N and P remaining percentage (%) of the mixed V. natans and P. maackianus materials during the decomposing process under two burial depth treatments
3.2 苦草、微齿眼子菜及两物种混合N、P释放对泥沙埋深的响应
在本研究中, 与0处理相比, 5 cm埋深处理显著抑制苦草、微齿眼子菜及其混合的N、P释放。苦草在0和5 cm处理下分解35d后的N剩余率分别为0和31.28%、P剩余率分别为0和24.45%, 微齿眼子菜在5 cm处理下分解117d后的N、P剩余率分别提高了19.45%和14.73%, 两物种混合N、P剩余率分别提高了41.57%和22.82%。这说明泥沙埋深抑制了苦草、微齿眼子菜及其物种混合的N、P释放。这与已有研究[16,29,30]关于河流中沿岸带植物枯落物、湿地和沼泽植物等分解的N、P元素释放受到泥沙淤积抑制的研究结论是一致的。
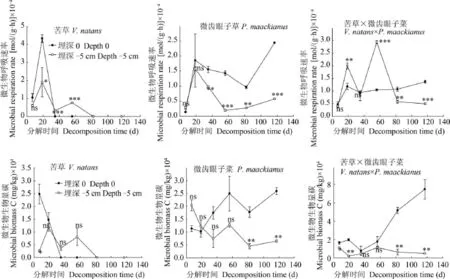
图 4 苦草、微齿眼子菜和两物种混合分解在两种埋深处理下的微生物呼吸和生物量变化Fig. 4 Changes of microbial respiration and biomass of V. natans, P. maackianus and their mixture during the decomposing process under two burial depth treatments
在0和5 cm埋深处理下, 苦草、微齿眼子菜及其物种混合在分解初期的N、P元素含量均呈现出一个快速下降过程。这可能与分解初期阶段的淋溶作用导致植物材料中的可溶性成分迅速释放有关[25,31,32]。另外, 有研究表明植物在分解过程中其N剩余率的变化与微生物固N有密切联系, 微生物对N的固定可导致分解材料N含量的升高, 分解材料中N含量越低, 微生物固N趋势越强, 反之亦然[33]。在本研究中, 苦草在两种处理下N剩余率在整个分解过程中均呈持续下降趋势, 这说明苦草N含量较高, 其自身N源能够满足微生物活动的需求, 在分解过程中微生物没有发生对外源N元素的固定。另外苦草P剩余率也呈持续下降趋势, 这很有可能与在分解过程中微生物的营养需求没有受到P供给的限制, 或者说没有发生微生物对P元素的固定有关。与苦草N、P元素的释放动态相比, 在两种处理下微齿眼子菜N、P剩余率在分解过程中均呈平缓下降趋势。微齿眼子菜初始N含量较苦草低, 初始C/N较苦草高, 在分解过程中微生物对外源N很可能产生固定。有研究发现, 当初始C/P<80时,P元素发生矿化, 当C/P>80时, P元素将被固定[34]。微齿眼子菜初始C/P比为202.53±2.72, 在分解过程中微生物对P元素发生了固定。另外, 本研究中, 与0处理相比, 5 cm埋深处理下的苦草和微齿眼子草在实验结束时的N、P剩余率均较高, 微生物生物量也明显降低, 因此N、P剩余量的积累可能与微生物活动的减弱密切相关。本研究表明苦草和微齿眼子菜在分解过程中N、P剩余率的变化不但与分解材料的初始质量特征有关, 也与微生物对N、P元素的矿化和对外源N、P固定趋势有密切关系。
本研究表明, 在0处理下混合分解的N元素释放
[1]Swift M J, Heal O W, Anderson J M. Decomposition in Terrestrial Ecosystems [M]. Blackwell Scientific Publications. 1979, 1—372
[2]Hättenschwiler S, Tiunov A V, Scheu S. Biodiversity and litter decomposition in terrestrial ecosystems [J]. Annual Review of Ecology, Evolution, and Systematics, 2005, 36: 191—218
[3]Lecerf A, Risnoveanu G, Popescu C, et al. Decomposi-呈持续下降趋势, 仅在分解后期N剩余率有所增加,这说明在混合分解的很长一段时间里微生物没有发生对N的固定。N元素释放的混合效应在分解初期表现为加和效应, 随着分解的进行表现出协同效应, 这可能与物种混合后养分(如N)在分解材料之间发生转移有关[35]。与N元素的释放动态相比, 混合分解的P元素剩余率变化也呈下降趋势(除在分解第56、117天略有上升外), 但P元素的释放在整个分解过程中均没有产生混合效应, 这可能与微生物没有对外源P元素产生固定所致。研究结果同时也说明N元素对苦草和微齿眼子菜混合的响应比P元素敏感。在5 cm埋深处理下, 混合分解的N、P元素释放在经过淋溶期快速下降后变得缓慢并达到相对稳定状态, 随着分解的进行N、P元素释放的混合效应表现为拮抗效应, N、P剩余率在实验结束时增加。有研究表明, 微生物在缺氧环境中其活动易受到抑制[8,11,15]、微生物对N、P的矿化作用减弱[36], 本研究结果也说明埋深对分解的抑制作用与微生物活动显著降低有密切的关系。
水生植物腐烂分解对水体的营养元素循环有重要影响[24,25]。江汉湖群是我国湖泊密集度最大的淡水湖泊群, 高等水生植物物种多样性高、分布广、生物量大, 特别是沉水植物在湖泊沿岸带的水生植被类型中占据明显优势。由于汛期江河来水挟带大量泥沙入湖, 风浪和湖流经常强烈地翻搅着湖底, 大量底泥被翻起等都会产生泥沙淤积, 这将影响水生植物腐烂分解过程, 也会影响底质营养物动态。本研究初步表明, 泥沙埋深可显著降低沉水植物苦草、微齿眼子菜及其混合的分解速率和N、P元素释放动态, 尤其是N、P元素释放的混合效应对泥沙埋深的响应表现为明显的拮抗作用, 混合分解的N、P元素积累与微生物活动显著降低有密切的关系。由于泥沙淤积影响包括淤积类型、淤积强度和行为等作用因素, 很有必进一步开展相关研究, 以期为进一步了解泥沙淤积对水生植物分解的影响提供资料, 并为认识水生植物分解对底质营养物动态的影响提供参考。tion of diverse litter mixtures in streams [J]. Ecology,2007, 88(1): 219—227
[4]Gessner M O, Swan C M, Dang C K, et al. Diversity meets decomposition [J]. Trends in Ecology & Evolution,2010, 25(6): 372—380
[5]Boyero L, Pearson R G, Gessner M O, et al. A global experiment suggests climate warming will not accelerate litter decomposition in streams but might reduce carbon sequestration [J]. Ecology Letters, 2011, 14(3): 289—294
[6]Gustafsson C, Boström C. Biodiversity influences ecosystem functioning in aquatic angiosperm communities [J]. Oikos, 2011, 120(7): 1037—1046
[7]Reice S R. Environmental patchiness and the breakdown of leaf litter in a woodland stream [J]. Ecology, 1974,55(6): 1271—1282
[8]Herbst G N. Effects of burial on food value and consumption of leaf detritus by aquatic invertebrates in a lowland forest stream [J]. Oikos, 1980, 35(3): 411—424
[9]Vargo S M, Neely R K, Kirkwood S M. Emergent plant decomposition and sedimentation: response to sediments varying in texture, phosphorus content and frequency of deposition [J]. Environmental and Experimental Botany,1998, 40(1): 43—58
[10]Cornut J, Elger A, Lambrigot D, et al. Early stages of leaf decomposition are mediated by aquatic fungi in the hyporheic zone of woodland streams [J]. Freshwater Biology,2010, 55(12): 2541—2556
[11]Danger M, Cornut J, Elger A, et al. Effects of burial on leaf litter quality, microbial conditioning and palatability to three shredder taxa [J]. Freshwater Biology, 2012,57(5): 1017—1030
[12]Mayack D T, Thorp J H, Cothran M. Effects of burial and floodplain retention on stream processing of allochthonous litter [J]. Oikos, 1989, 54(3): 378—388
[13]Smith J J, Lake P S. The breakdown of buried and surface-placed leaf litter in an upland stream [J]. Hydrobiologia, 1993, 271(3): 141—148
[14]Chauvet E. Influence of the environment on willow leaf litter decomposition in the alluvial corridor of the Garonne River [J]. Archiv für Hydrobiologie, 1988,112(3): 371—386
[15]Freeman C, Ostle N J, Fenner N, et al. A regulatory role for phenol oxidase during decomposition in peatlands [J]. Soil Biology and Biochemistry, 2004, 36(10): 1663—1667
[16]Nichols D S, Keeney D R. Nitrogen and phosphorus release from decaying milfoil [J]. Hydrobiologia, 1973,42(4): 509—525
[17]Gartner T B, Cardon Z G. Decomposition dynamics in mixed-species leaf litter [J]. Oikos, 2004, 104(2): 230—246
[18]Wu A P, Wu S K, Ni L Y. Study of Macrophytes nitrogen and phosphorus contents of the shallow lakes in themiddle reaches of Changjiang River [J]. Acta Hydrobiologica Sinica, 2005, 29(4): 406—412 [吴爱平, 吴世凯, 倪乐意. 长江中游浅水湖泊水生植物氮磷含量与水柱营养的关系. 水生生物学报, 2005, 29(4): 406—412]
[19]Graca M A S, Barlocher F, Gessner M O. Methods to Study Litter Decomposition: a Practical Guide [M]. Springer Science & Business Media. 2005, 53—121
[20]Anderson J P E, Page A L. Methods of Soil Analysis. Part 2. Chemical and Microbiological Properties [M]. American Society of Agronomy, Soil Science Society of America. 1982, 831—871
[21]Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C [J]. Soil Biology and Biochemistry, 1987, 19(6): 703—707
[22]Olson J S. Energy storage and the balance of producers and decomposers in ecological systems [J]. Ecology,1963, 44(2): 322—331
[23]Salamanca E F, Kaneko N, Katagiri S. Effects of leaf litter mixtures on the decomposition of Quercus serrata and Pinus densiflora using field and laboratory microcosm methods [J]. Ecological Engineering, 1998, 10(1): 53—73
[24]Brinson M M, Lugo A E, Brown S. Primary productivity,decomposition and consumer activity in freshwater wetlands [J]. Annual Review of Ecology and Systematics,1981, 12: 123—161
[25]Webster J R, Benfield E F. Vascular plant breakdown in freshwater ecosystems [J]. Annual Review of Ecology and Systematics, 1986, 17: 567—594
[26]Enriquez S, Duarte C M, Sand-Jensen K. Patterns in decomposition rates among photosynthetic organisms: the importance of detritus C: N: P content [J]. Oecologia,1993, 94(4): 457—471
[27]Berg B, Staaf H. Decomposition rate and chemical changes of Scots pine needle litter. II. Influence of chemical composition [J]. Ecological Bulletins, 1980, 32: 373—390
[28]Godshalk G L, Wetzel R G. Decomposition of aquatic Angiosperms. Ⅲ. Zostera marina L. and a conceptual model of decomposition [J]. Aquatic Botany, 1978, 5(4): 329—354
[29]Nielsen T, Andersen F Ø. Phosphorus dynamics during decomposition of mangrove (Rhizophora apiculata)leaves in sediments [J]. Journal of Experimental Marine Biology and Ecology, 2003, 293(1): 73—88
[30]Longhi D, Bartoli M, Viaroli P. Decomposition of four macrophytes in wetland sediments: organic matter and nutrient decay and associated benthic processes [J]. Aquatic Botany, 2008, 89(3): 303—310
[31]Puriveth P. Decomposition of emergent macrophytes in a Wisconsin marsh [J]. Hydrobiologia, 1980, 72(3): 231—242
[32]Gong C X, Wang D. Effect of mixed floating and submerged macrophytes on decomposition rate and nutrient dynamics [J]. Acta Hydrobiologica Sinica, 2014, 38(6): 1098—1106 [巩崇贤, 王东. 水生植物荇菜和菹草分解对物种混合的响应研究. 水生生物学报, 2014, 38(6): 1098—1106]
[33]Gessner M O. Mass loss, fungal colonization and nutrient dynamics of (Phragmites australis) leaves during senescence and early aerial decay [J]. Aquatic Botany, 2001,69(2): 325—339
[34]Canfield D E, Thamdrup B, Kristensen E. Aquatic Geimicrobiology [M]. Elsevier, Amsterdam. 2005, 424
[35]Briones M J I, Ineson P. Decomposition of eucalyptus leaves in litter mixtures [J]. Soil Biology and Biochemistry, 1996, 28(10): 1381—1388
[36]Enwezor W O. The mineralization of nitrogen and phosphorus in organic materials of varying C: N and C: P ratios [J]. Plant and Soil, 1976, 44(1): 237—240
DECOMPOSITION OF TWO SUBMERGED MACROPHYTES AND THEIR MIXTURE: EFFECT OF SEDIMENT BURIAL
CAO Dan-Dan, WANG Dong, YANG Xue, GUO Xuan and NIU Hong-Yu
(Key Laboratory for Geographical Process Analysis & Simulation, School of Life Sciences, Central China Normal University, Hubei Province, Wuhan 430079, China)
Decomposition of aquatic macrophytes makes the nutrients stocked in biomass release to the surroundings,and thereby can considerably affect nutrient cycling and energy flow in aquatic ecosystem. In most case, aquatic macrophytes may readily produce a considerable amount of stem and/or leaf fragments due to both natural and anthropogenic disturbances. The detached fragments will be deposited within the sediment. To date, the breakdown of aquatic macrophytes associated with sedimentation remains largely unexplored. Vallisneria natans and Potamogeton maackianus are two dominant submerged plants in shallow lakes of the Yangtze River basin of China. In the field, a substantial amountof the detached plant parts may be produced and deposited separately or coupled with each other at the substrate surface or buried within the sediment, contributing to the formation of an organic slime in the lakeshore areas. To investigate the effect of sediment burial on the decomposition of V. natans, P. maackianus and their mixture, three types of plant materials confined in litterbags were incubated and subjected to 0 cm and 5 cm buried treatments for 117 days. There were 5 g materials used for each species and mixture (2.52.5 of V. natans: P. maackianus, w/w basis) in the litterbags. The decomposition rates, nitrogen and phosphorus content of the remaining materials, and microbial respiration and biomass were measured at days 7, 19, 35, 56, 82 and 117 respectively. Decomposition rates of both V. natans and P. maackianus were significantly and positively correlated with initial N contents (P < 0.05, r = 0.896), and negatively correlated with C/N ratio (P < 0.05, r = -0.963). The decomposition rate was the highest for V. natans, the lowest for P. maackianus, and intermediate for their mixture. The decomposition rate and nutrient release of V. natans, P. maackianus and their mixture were greatly reduced in 5 cm burial treatments compared to 0 cm treatments. After 35 days experiment, the dry mass remaining percentage of V. natans was 0 and 43.51% under 0 cm and 5 cm burial treatments, respectively. After 82 days experiment, the dry mass remaining percentage of V. natans was close to 0 in 5 cm burial treatments. Dry mass remaining of P. maackianus and V. natans×P. maackianus was significantly higher in 5 cm burial treatments compared to 0 cm treatments, with an increase of 31.09% and 37.44%, respectively. The nutrient release of V. natans, P. maackianus and their mixture were significantly inhibited when they were buried at 5 cm depth. After 117 days experiment, the N and P remaining percentage of P. maackianus was significantly higher in 5 cm burial treatments compared to 0 treatments, with an increase of 19.45% and 14.73%, respectively. For the mixture, the N and P remaining percentage was higher in 5 cm burial treatments than 0 treatments, with an increase of 41.57% and 22.82%,respectively. After 35 days experiment, the N remaining percentage of V. natans was close to 0 and 31.28%, and P remaining percentage was close to 0 and 24.45% under 0 and 5 cm burial treatments, respectively. For the mixture, the observed mass remaining did not significantly differ from the expected under two treatments, indicating that an additive effect existed for the decomposition rate and the mixing effect was irrelevant to the incubated locations (i.e., at the surface or buried within the sediment). In addition, additive effect of N and P release of the mixed material also occurred at the early stage of decomposition. In the subsequent time, the observed N remaining of the mixed material were lower than the expected (P < 0.05) while the observed P remaining did not differ from the expected (P > 0.05) in 0 cm burial treatment, indicating a synergistic effect on N release and an additive effect on P release occurred. In contrast,the observed N and P remaining were higher than the expected in 5 cm burial treatment, indicating antagonistic effects on N and P release occurred. The microbial respiration rate of both V. natans and P. maackianus and the microbial biomass of the mixed material were much lower in 5 cm burial treatments compared to 0 treatments. This implied that limitation of microbial activities to plant materials induced from the sediment burial would greatly reduce the rate of decomposition and nutrient release of aquatic macrophytes. We concluded that sediment burial may lead to a decrease of decomposition rates and nutrient release of both single submerged plants and their mixture, which is closely linked to substantial decline of microbial activities by sedimentation. We further suggested that the observed N and/or P-stimulated increases of the mixed plant material in response to sedimentation would contribute to the changes in nutrient availability in the lakeshore area.
Aquatic macrophytes; Sediment burial; Decomposition rate; Nutrient dynamics; Mixing effects
10.7541/2016.44
Q948.8
A
1000-3207(2016)02-0327-10
2015-05-07;
2015-10-18
国家自然科学基金项目(31270378); “荆江航道整治工程对水生生物相互关系的影响及其生态效应研究”项目; 国家标本平台教学标本子平台(http://mnh.scu.edu.cn/)资助 [Supported by National Natural Science Foundation of China (31270378), the project“Impact of Jingjiang River Channel Improvement Project on the aquatic organism interactions and its ecological effects”, and the specimen platform of China, teaching specimens sub-platform, Web, http://mnh.scu.edu.cn/(2005DKA21403-JK)]
曹丹丹(1989—), 女, 河南信阳人, 硕士研究生; 研究方向为湿地生态学。E-mail: 1224789140@qq.com
王东, E-mail: dongwang.cn@gmail.com

