OPG/RANKL/RANK调节系统与大鼠慢性牙周炎发展的相关性分析
邹林洪,胡 丹,张琳林△,彭 春,戴红卫
(1.重庆医科大学附属永川医院口腔科,重庆 402160; 2.重庆医科大学附属口腔医院正畸科,重庆 400015)
论著·基础研究
OPG/RANKL/RANK调节系统与大鼠慢性牙周炎发展的相关性分析
邹林洪1,胡 丹1,张琳林1△,彭 春1,戴红卫2
(1.重庆医科大学附属永川医院口腔科,重庆 402160; 2.重庆医科大学附属口腔医院正畸科,重庆 400015)
目的 研究骨保护素(OPG)/细胞核因子κB受体活化因子配体(RANKL)/细胞核因子κB受体活化因子(RANK)调节系统与大鼠慢性牙周炎之间的关系。方法 选取48只雄性SD大鼠,采用结扎丝方法建立大鼠慢性牙周炎模型进行研究,对比观察OPG、RANKL的免疫组化检测结果以及破骨细胞计数结果。结果 在第56天时破骨细胞数量达到峰值,实验组从第7天开始RANKL蛋白平均光密度值高于对照组(P<0.05);从第14天开始实验组细胞表面OPG的平均光密度值低于对照组(P<0.05),实验组RANKL/OPG比值也发生了明显改变。结论 OPG、RANKL和RANK参与了大鼠慢性牙周炎的牙槽骨吸收活动,RANKL与OPG比例的失调在慢性牙周炎的发生发展中起着重要的作用。
牙周炎;骨保护素;细胞核因子κB受体活化因子配体;细胞核因子κB受体活化因子
牙周病是口腔中一种极为常见的疾病,该疾病在我国人群中的发病率高达70.0%[1]。慢性牙周炎也是导致患者牙齿松动和缺失的最主要原因,对患者的咀嚼功能产生不利影响,对患者的生活质量以及生命健康造成了严重的威胁。因此,慢性牙周炎是目前牙周病研究的热点。有研究指出,OPG/RANKL/RANK调节系统与牙周炎的发病有着密切的关系[2-3]。为了进一步探讨研究骨保护素(OPG)/细胞核因子κB受体活化因子配体(RANKL)/细胞核因子κB受体活化因子(RANK)调节系统与慢性牙周炎之间的关系,本研究建立了大鼠慢性牙周炎模型进行研究,现报道如下。
1 材料与方法
1.1 材料 选取48只7周龄雄性SD大鼠(购自重庆医科大学动物实验中心),体质量为(150±10)g,将大鼠平均分为8组,每组6只,进行自身对照。
1.2 方法
1.2.1 建立大鼠慢性牙周炎模型 采用结扎丝方法建立大鼠慢性牙周炎模型,具体过程如下:在大鼠左侧上颌第一磨牙的龈缘下用0.25 mm正畸丝结扎作为实验组,右侧不作处理作为对照组;分别在建立模型的第7、14、21、28、35、42、49、56天以10%水合氯醛按照3 mL/kg的比例对大鼠进行麻醉,以4%多聚甲醛灌注内固定,取双侧第一磨牙及其周围牙槽骨组织,随后常规制作组织切片。
1.2.2 HE染色 (1)10.0%乙二胺四乙酸(EDTA)将双侧标本4 ℃脱钙45~60 d,以针剌无阻力感为完成脱钙标准,随后进行脱水、石蜡包埋;(2)平行于牙体长轴将标本以5 mm厚度做颊、舌向切片,出现第一磨牙颊侧牙根时开始收集组织切片;(3)每个标本选取1张切片,进行常规脱蜡水化操作,常规染色,显微镜下观察牙周组织情况。
1.2.3 TRAP染色破骨细胞计数 每个标本选取3张切片随后按照抗酒石酸酸性磷酸酶检测试剂盒具体步骤进行操作。在显微镜下计数牙根周围牙槽骨表面的阳性染色破骨细胞个数,重复3次取平均值。
1.2.4 OPG、RANKL免疫组化检测 采用SABC免疫组织化学试剂盒进行免疫组织化学染色,将石蜡切片进行脱蜡水化,经内源性过氧化酶阻断,利用5%的牛血清清蛋白BSA进行封闭,随后分别加入稀释的一抗,进行2 h的温室孵育后加入二抗以及DAB显色液进行显色;使用苏木精进行复染,并常规脱水,封片后观察。阳性强度用平均光密度值表示。染色条件一致,拍照曝光由一个人完成,每个标本选用一张切片,在400倍高倍镜下随机选取5个不重叠视野,求平均值作为阳性细胞平均光密度值。平均光密度值=累积光密度/ 测量面积。
1.3 观察指标 对比观察破骨细胞计数结果以及OPG、RANKL、RANK的表达结果,计算RANKL/OPG比值。
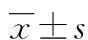
2 结 果
2.1 动物模型以及HE染色结果 肉眼见28~56d时大鼠左侧上颌第一磨牙牙龈红肿,软垢和牙结石堆积,探诊极易出血,探及牙周袋深。 组织学观察牙龈组织有大量炎症细胞浸润,牙周胶原纤维排列紊乱,暴露的牙根表面和牙槽骨上有大量吸收陷窝,随着时间延长,各种表现程度越重,表明慢性牙周炎模型建立成功。对照组未见明显的牙龈红肿,探诊不易出血,HE染色未见明显的炎症细胞,胶原纤维排列规则。
2.2 破骨细胞计数 阳性细胞标准:细胞核大于2个,胞质呈酒红色,形状不规则。对照组偶见颜色较浅的阳性细胞。实验组各时间点可见深染TRAP阳性染色破骨细胞,分布在牙槽骨中。通过对比观察,实验组破骨细胞数量和对照组比较差异有统计学意义(P<0.05)。随后随着时间延长破骨细胞数量开始升高,在第56天时破骨细胞数量达到峰值,见图1、表1。

表1 慢性牙周炎模型破骨细胞计数对比,个)
a:P<0.05,与对照组比较。
2.3 免疫组化检测 通过对比观察可以发现:对照组大鼠牙周组织具有适量的RANKL蛋白淡黄色颗粒表达,但在实验组中炎症明显的区域RANKL蛋白褐色颗粒的表达量明显增加;对照组大鼠牙槽骨中具有适量的OPG棕黄色颗粒弥漫性弱阳性表达,在实验组中慢性牙周炎明显的区域,OPG淡黄色颗粒的表达相对较少。实验组从第7天开始RANKL蛋白平均光密度值高于对照组(P<0.05);从第14天开始实验组细胞表面OPG的平均光密度值低于对照组(P<0.05),实验组RANKL/OPG比值第7天时开始升高,到第56天达到峰值,对照组RANKL/OPG比值一直比较平稳,未见明显升高或降低,见表2。

表2 OPG、RANKL免疫组化染色平均光密度值
a:P<0.05,与对照组比较。

A:实验组第7天;B:实验组第56天。
图1 破骨细胞抗酒石酸酸性磷酸酶染色(×200)
3 讨 论
OPG是一种可溶性分泌蛋白,主要由成骨细胞分泌。OPG主要的生物学行为是作用于破骨细胞的分化末期,抑制破骨细胞生成,诱导破骨细胞凋亡,并阻断破骨细胞的病理性增生、活化[4]。RANKL是破骨细胞分化因子,是一种骨保护素配体,能刺激破骨细胞分化,促进破骨细胞骨吸收,能够通过和破骨前体细胞膜上的RANK结合来促进破骨细胞分化抑制其凋亡[5]。RANK是一种缩氨酸,由成骨细胞及活性T细胞分泌产生,目前被认为是已知的RANKL惟一的受体,主要与RANKL的C 端结合产生信号,进而启动信号转导途径[6]。OPG可以与RANKL竞争结合RANK,从而阻断RANKL和RANK的结合,抑制破骨细胞的成熟和分化,导致破骨细胞数量减少,达到减少骨吸收,增加骨量的作用[7]。
OPG、RANKL、RANK调节系统能调节破骨细胞的生物学效应和骨的动态平衡,是各种通路诱导破骨细胞的分化成熟最终因子[8]。成骨细胞受到刺激之后膜表面表达的RANKL,能够识别破骨细胞前体细胞并和其膜上的RANK结合,刺激其分化成熟并产生破骨细胞,起到骨吸收的作用[9]。此外,成骨细胞也可以通过OPG的表达来抑制RANKL和RANK的作用机制[10]。OPG还可以和RANKL-RANK结合体再次结合来形成三聚体,起到直接抑制RANKL-RANK的作用[11]。有研究表明,去除小鼠的OPG 基因会引起破骨细胞数量增多导致严重的骨质疏松[12]。对去除RANK基因片段的小鼠进行研究后发现,小鼠会出现由于缺乏破骨细胞而形成骨质硬化。
近年来有专家认为RANKL/RANK/OPG 系统可能是联系骨代谢与免疫系统之间的桥梁,由免疫系统炎性反应导致的骨吸收[13]。有研究表明激活的T淋巴细胞导致了牙周炎症组织中RANKL的mRNA高表达,同时OPG的mRNA水平相应下降[14]。因而可以通过选择性的调节机体的免疫反应来对OPG/RANKL进行调控,进而对牙槽骨的局部微环境进行调控。本研究发现,与对照组比较,实验组大鼠慢性牙周炎活动明显的每个观察点,RANKL在成骨细胞及其基质细胞表达更明显,与对照组相比其水平明显增加;而OPG水平在成骨细胞及其基质细胞的表达水平有所减少,与对照组相比其水平明显减少。所以,OPG/RANKL/RANK调节系统确实在慢性牙周炎活动中发挥了极为重要的作用。
OPG以及RANKL在牙槽骨中的表达受到多种因素的调节和影响,本研究发现RANKL的水平升高,OPG的水平降低,RANKL/OPG比值在实验组比对照组大,实验组RANKL/OPG比值从第7天开始一直持续升高,到第56天达到峰值,而对照组RANKL/ OPG比值一直比较平稳,未见明显升高或降低。因此可以推断RANKL和OPG及二者比值的变化反映了牙周吸收情况,OPG和RANKL过多或过少对骨代谢均产生不利影响,需要RANKL与OPG维持一定的比例才能达到牙周骨代谢的平衡。牙周局部微环境RANKL/OPG 比例的失调导致了实验组破骨活动活跃,牙槽骨组织发生了过量吸收,因此可以得知,在对照组中,RANKL、OPG 之间比例正常,对照组牙周组织未发生明显的吸收和增长,处于平衡状态。RANKL/OPG比值的改变在慢性牙周炎的发展中起着重要的作用;RANKL/OPG比值与调节破骨细胞分化成熟密切相关,在牙周组织破坏的发生、发展过程发挥了重要的作用,最终影响牙槽骨的骨密度和骨强度。RANKL/OPG 比值可以作为衡量慢性牙周炎牙槽骨吸收严重程度的客观指标之一,牙槽骨的吸收严重程度与牙周局部RANKL、OPG比例失调呈正相关。
综上所述, OPG、RANKL和RANK调节系统参与了大鼠慢性牙周炎牙槽骨的吸收活动,RANKL和OPG是慢性牙周炎的重要调节因子,其中RANKL/OPG比例的失调在慢性牙周炎中起着重要的作用。通过改变牙周炎患者牙周组织中的OPG、RANKL含量,使OPG含量表达增加,减少RANKL含量,改善牙周局部RANKL 与OPG 之间的比例来达到抑制骨吸收、促进新骨生成的作用,使预防慢性牙周炎牙槽骨吸收的发生成为可能。
[1]石磊,林云锋,刘磊.替牙期乳牙牙根及牙槽骨吸收过程中RANKL/RANK通路及其调控的研究进展[J].现代生物医学进展,2008,13(4):769-771.
[2]Tabari ZA,Azadmehr A,Tabrizi MA,et al.Salivary soluble receptor activator of nuclear factor kappa B ligand/osteoprotegerin ratio in periodontal disease and health[J].J Periodontal Implant Sci,2013,43(5):227-232.
[3]Longhini R,Aparecida DP,Sasso-Cerri E,et al.Cimetidine reduces alveolar bone loss in induced periodontitis in rat molars[J].J Periodontol,2014,85(8):1115-1125.
[4] Tang L,Lin Z,Li YM.Effects of different magnitudes of mechanical strain on osteoblasts in vitro[J].Biochem Biphys Res Commun,2006,344(1):122-128.
[5]吴陈炫.糖尿病大鼠牙槽骨RANKL、OPG基因表达的实验研究[D].天津:天津医科大学,2007.
[6]Wright HL,Mccarthy HS,Middleton J,et al.RANK,RANKL and osteoprotegerin in bone biology and disease[J].Curr Rev Musculoskelet Med,2009,2(1):56-64.
[7]Nakamura M,Udagawa N,Matsuura S,et al.Osteoprotegerin regulates bone formation through a coupling mechanism with bone resorption[J].Endocrinology,2003,144(12):5441-5449.
[8]Evans CE,Mylchreest S,Andrew JG.Age of donor alters the effect of cyclic hydrostatic pressure on production by human macrophages and osteoblasts of sRANKL,OPG and RANK[J].BMC Musculoskelet Disord,2006,7(7):21.
[9]杨健.RANKL和OPG在大鼠正畸牙压力侧骨改建中的作用[D].重庆:第三军医大学,2003.
[10]Zhao HY,Liu JM,Ning G,et al.Relationships between insulin-like growth factor-I (IGF-I) and OPG,RANKL,bone mineral density in healthy Chinese women[J].Osteoporos Int,2008,19(2):221-226.
[11]Silva JA,Ferrucci DL,Peroni LA,et al.Periodontal disease-associated compensatory expression of osteoprotegerin is lost in type 1 diabetes mellitus and correlates with alveolar bone destruction by regulating osteoclastogenesis[J].Cells Tissues Organs,2012,196(2):137-150.
[12]Bucay N,Sarosi I,Dunstan CR,et al.Osteoprotegerin-deficient mice develop early onset osteoporosis and arterial calcification[J].Genes Dev,1998,12(9):1260-1268.
[13]Theill LE,Boyle WJ,Penninger JM.RANK-L and RANK:T cells,bone loss,and mammalian evolution[J].Annu Rev Immunol,2002(20):795-823.
[14]Menezes R,Garlet TP,Letra A,et al.Differential patterns of receptor activator of nuclear factor kappa B ligand/osteoprotegerin expression in human periapical granulomas:possible association with progressive or stable nature of the lesions[J].J Endod,2008,34(8):932-938.
Analysis on correlation between OPG/RANKL/RANK regulation system and chronic periodontitis progress*
ZouLinhong1,HuDan1,ZhangLinlin1△,PengChun1,DaiHongwei2
(1.DepartmentofStomatology,AffiliatedYongchuanHospital,ChongqingMedicalUniversity,Chongqing402160,China;2.DepartmentofOrthodontics,AffiliatedStomatologyHospital,ChongqingMedicalUniversity,Chongqing400015,China)
Objective To investigate the relationship between OPG/RANKL/RANK regulation system and periodontitis.Methods Forty-eight male SD rats were selected to establish the rat periodontitis model by adopting the ligature wire method.The detection results of OPG and RANKL by the immunohistochemical method and and the results of osteoclasts count were comparatively observed.Results The number of osteoclasts on 56 d reached the peak value.The average optical density value of RANKL protein from 7 d in the experimental group was higher than that in the control group(P<0.05);the average optical density value of cellular surface OPG from 14 d in the experimental group was lower than that in the control group(P<0.05);the RANKL/OPG ratio in the experimental group also had significant change.Conclusion OPG,RANKL and RANK are involved in the absorption activity of alveolar bone in rat chronic periodontitis.The imbalance of RANKL and OPG ratio plays an important role in the development of chronic periodontitis.
periodontitis;osteoprotegerin;RANKL;RANK
10.3969/j.issn.1671-8348.2016.31.005
重庆医科大学附属永川医院课题(YJQN20120025)。
邹林洪(1982-),硕士,主治医师,主要从事口腔医学相关研究。△
,E-mail:zhanglinlin71@163.com。
R781.4+2
A
1671-8348(2016)31-4334-03
2016-02-21
2016-06-09)

