二甲双胍对人绒毛膜癌细胞凋亡的影响
柳光芬
(重庆市消防总队医院 401120)
·论 著·
二甲双胍对人绒毛膜癌细胞凋亡的影响
柳光芬
(重庆市消防总队医院 401120)
目的 观察二甲双胍对人绒毛膜癌细胞凋亡的影响和可能的作用机制。方法 选用人绒毛膜癌细胞系JEG-3,分为对照组和二甲双胍组(终浓度为5、10、20、40 mmol/L)处理48 h后,使用流式细胞术和免疫荧光检测细胞凋亡情况,分别采用实时荧光定量聚合酶链反应(PCR)和免疫蛋白印迹检测凋亡相关基因半胱天冬酶-3(Caspase-3)、Bcl-2和凋亡调节蛋白(Bax)的mRNA及蛋白变化趋势。结果 和对照组相比,二甲双胍组的JEG-3细胞早晚期凋亡率显著上升,同时Caspase-3和Bax的mRNA及蛋白表达水平显著增加,但Bcl-2的mRNA和蛋白表达显著降低。结论 二甲双胍可以通过Caspase-3及Bcl-2/Bax通路诱导JEG-3细胞发生凋亡。
人绒毛膜癌细胞; 二甲双胍; 细胞凋亡
绒毛膜癌是一种较为罕见的妇产科肿瘤,其来源于滋养层细胞具有高度的增殖力和侵袭性。绒癌通常继发于葡萄胎、流产或分娩后的育龄期妇女,偶发于儿童或男性。目前的治疗手段主要采取5-氟尿嘧啶等化疗为主的方法,尽量保留患者的子宫和卵巢。二甲双胍是常用的糖尿病降糖药,也可以用于妊娠期糖尿病;近期有研究发现,二甲双胍可以抑制宫颈癌、食管癌、肝癌、乳腺癌等多种肿瘤细胞的生长和发展,是潜在治疗肿瘤的新型药物[1-5]。目前,二甲双胍对绒癌细胞的抑制能力和机制尚不清楚,因此本研究拟以人绒癌细胞系JEG-3为模型,初步探讨二甲双胍处理对JEG-3细胞凋亡的影响和可能的作用机制,为其临床应用奠定理论基础。
1 材料与方法
1.1 材料来源 人绒毛膜癌细胞株JEG-3购于上海细胞所;胎牛血清(杭州四季清公司);DMEM培养基(美国Gibco公司);二甲双胍(美国Sigma公司);流式细胞凋亡检测试剂盒(北京凯基公司),细胞增殖和活性检测试剂盒(CCK-8)和末端脱氧核苷酰基转移酶介导性dUTP切口末端标记试剂盒(TUNEL)(碧云天公司),半胱天冬酶-3(Caspase-3)、β-肌动蛋白(β-actin)、Bcl-2和凋亡调节蛋白(Bax)抗体(美国Abcam公司)。
1.2 细胞培养 JEG-3细胞株使用含10%胎牛血清的DMEM培养基培养,培养基中分别加入100 U/mL的青链霉素。置于37 ℃、5%的CO2浓度湿度饱和的CO2培养箱中,当细胞密度达到80%~90%时进行传代。
1.3 细胞分组及药物浓度筛选 取对数生长期的JEG-3细胞消化重悬后接种于96孔板中,接种密度为3 000细胞/孔。培养过夜后,分别用终浓度为5、10、20、40 mmol/L的二甲双胍处理(二甲双胍组),每组设6个复孔并以未处理组为对照组。处理48 h后吸去孔中培养基,加入预混有CCK-8溶液的培养基继续培养2 h,酶标仪490 nm波长下测定各孔的吸光度值(OD490),并减去空白孔的读数以消除本底,计算药物对细胞增殖的抑制率。抑制率=(对照组OD490-二甲双胍组OD490)/对照组OD490×100%。选取接近50%抑制率的药物浓度进行下面的干预实验。
1.4 TUNEL 取对数生长期的JEG-3细胞,以每孔2×104接种于预先放置有1 cm×1 cm玻璃片的24孔板中,按照二甲双胍组干预培养48 h。4%的多聚甲醛固定15 min,PBS洗涤后使用0.1%的Triton X-100冰上孵育2 min,加入50 μL的TUNEL检测液37 ℃避光孵育60 min,DAPI染色30 min,PBS洗涤后抗淬灭封片剂封片后使用激光共聚焦显微镜照相,每组随机取8个视野统计平均阳性细胞数。
1.5 流式细胞检测凋亡 收集处理完成的二甲双胍组和对照组细胞,按照膜联蛋白(Annexin V/PI)凋亡检测试剂盒说明书进行染色。离心去上清液后加入500 μL的固定液重悬细胞,随后加入Annexin V和PI染液各5 μL,混匀后避光反应10 min后上机进行流式检测。
1.6 实时定量荧光聚合酶链反应(PCR) 取处理完成的二甲双胍组和对照组细胞,胰酶消化后去上清液加入500 μL裂解液,采用离心柱法提取细胞总RNA。随后根据反转录试剂盒说明合成cDNA,采用Syber-green法检测Caspase-3、Bcl-2和Bax的mRNA表达水平,并用β-actin为内参。实时荧光定量PCR的引物见表1。

表1 实时荧光PCR各基因的引物序列
1.7 免疫印迹试验 二甲双胍处理细胞48 h后,胰酶消化离心弃上清液,加入适量的细胞裂解液裂解细胞,冰上振荡7 min再用超声破碎仪低档处理5 min,4 ℃,15 000 r/min离心10 min获取上清液中的总蛋白。BCA试剂盒对总蛋白定量,蛋白上样量为40 μg,SDS电泳后转膜,一抗4 ℃过夜二抗室温1 h后化学发光法显色,并使用Quantity One软件分析各条带的灰度值。

2 结 果
2.1 二甲双胍抑制JEG-3细胞的最佳药物浓度 CCK-8结果显示,5、10、20、40 mmol/L浓度的二甲双胍处理均对ABC细胞的增殖有抑制作用。并且在5、10、20、40 mmol/L浓度时表现为剂量依耐性,抑制率随着药物浓度的增加而依次递增,见图1。20 mmol/L二甲双胍对JEG-3的抑制率为46.10%,而40 mmol/L的抑制率为58.98%超过50%,表明20 mmol/L的二甲双胍是JEG-3细胞的最佳药物浓度。
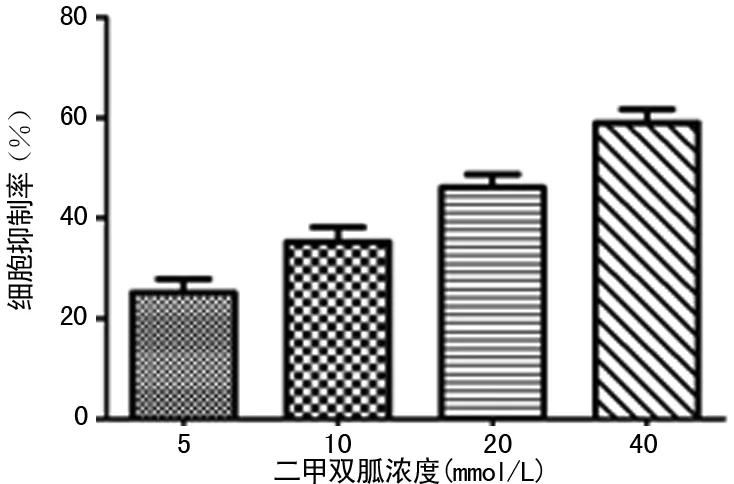
图1 不同浓度二甲双胍对JEG-3细胞的抑制率
2.2 二甲双胍促进JEG-3细胞凋亡 二甲双胍作用48 h后,流式细胞检测细胞早期凋亡的比率为25.86%,而对照组仅为4.32%,差异有统计学意义(P<0.05)。TUNEL实验显示,二甲双胍组中平均每视野阳性细胞数(19.00±4.86)高于对照组(3.83±2.82),差异有统计学意义(P<0.05)。结果表明,二甲双胍可以同时促进JEG-3细胞的早/晚期凋亡发生。
2.3 二甲双胍对细胞凋亡相关基因的影响 二甲双胍作用48 h后,使用荧光定量PCR检测细胞凋亡相关基因的mRNA变化水平发现,二甲双胍处理后促凋亡基因Caspase-3和Bax表达增加,同时下调抗凋亡基因Bcl-2,和对照组相比差异有统计学意义(P<0.05)。见图2。

注:A为正常JEG-3细胞;B为二甲双胍处理后的JEG-3细胞;C为两组细胞凋亡数统计结果。
图2 TUNEL法检测二甲双胍对JEG-3细胞凋亡的影响
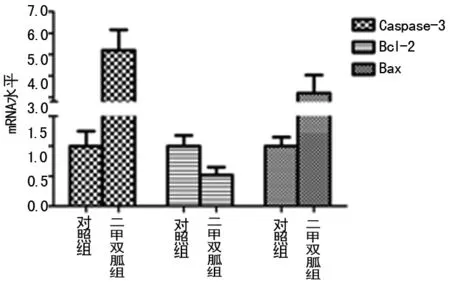
图3 二甲双胍对凋亡相关基因mRNA表达水平的影响

注:A为Western bolt图;B为Caspase-3,Bcl-2和Bax蛋白相对表达量分析;C为Bcl-2和Bax蛋白相对表达量比。
图4 二甲双胍对凋亡相关蛋白表达水平的影响
2.4 二甲双胍对细胞凋亡相关蛋白的影响 二甲双胍处理JEG-3细胞后通过检测细胞凋亡相关基因的蛋白表达水平发现其和mRNA变化程度类似,二甲双胍可以降低抗凋亡因子Bcl-2的蛋白表达同时上调Bax和Caspase-3,并且导致Bcl-2/Bax比值上调,和对照组相比差异有统计学意义(P<0.05)。见图3、4。
3 讨 论
二甲双胍疗效确切,不良反应小,是临床上常用的降糖药。有流行病学研究发现长期使用二甲双胍控制血糖的肿瘤患者的生存率要高于未服用患者,提示其对肿瘤可能有一定的治疗作用。有研究者对10 309例2型糖尿病患者随访调查发现,合并肿瘤的患者中使用二甲双胍的病死率要明显低于使用胰岛素和磺脲类药物的患者[6]。近年来,越来越多的实验证实其对肿瘤细胞的周期、代谢、增殖都有抑制作用,可能是潜在的肿瘤治疗药物[7]。
细胞凋亡受到促凋亡蛋白和抗凋亡蛋白两大类蛋白的共同调节,是一个动态平衡的过程。Bcl-2家族在线粒体介导的细胞凋亡中起关键作用,该家族包括Bcl-2、Bcl-xl和Bcl-w等抗凋亡蛋白以及Bax、Bak和Bid等促凋亡蛋白[8-10]。Bcl-2/Bax是衡量细胞凋亡程度的重要指标,通常在恶性肿瘤细胞中Bcl-2高表达而Bax低表达,两者的比值较高[11-13]。本研究发现二甲双胍处理绒癌细胞JEG-3后,具有抗凋亡功能的Bcl-2受到抑制而能够促进细胞凋亡的Bax则表达增加,Bcl-2/Bax比值下降和未处理组相比差异有统计学意义。有报道指出二甲双胍可以通过AMPK和mTOR等信号通路,动态调节Bcl-2和Bax的表达水平从而参与调控肿瘤细胞的凋亡[14],这将在本实验的后续研究中展开。
经过二甲双胍处理的JEG-3细胞早晚期凋亡率上升,并且凋亡相关蛋白Caspase-3升高。当细胞启动凋亡进程后,激活Caspase-3参与多种凋亡发生途径促使细胞凋亡发生。Caspase-3可以抑制Bcl-2的功能,而Bcl-2/Bax比率下调,结合细胞水平上早/晚期凋亡率的增加,提示二甲双胍是通过抑制抗凋亡基因Bcl-2、上调促凋亡基因Bax及Caspase-3,从而激活线粒体凋亡途径,促使JEG-3细胞发生凋亡[15-18]。
本研究采用人绒毛膜癌细胞系JEG-3为对象,探讨了二甲双胍对JEG-3细胞凋亡的影响及作用机制。通过药物抑制率实验发现二甲双胍的最佳作用浓度,并且使用流式细胞术和TUNEL实验从两方面证实,二甲双胍处理48 h可以显著提高绒癌细胞的早/晚期凋亡率,其可能是上调Caspase-3和Bax同时抑制Bcl-2以促进肿瘤细胞凋亡的发生。
但是,本实验所采用的二甲双胍浓度显著高于其作为降糖药时的血药浓度,其作为肿瘤治疗药物的应用还需要大量严谨的临床前研究来加以证明。
[1]Schmedt N,Azoulay L,Hense S.Reduced risk of lung cancer with metformin therapy in diabetic patients:a systematic review and meta- analysis[J].Am J Epidemiol,2014,180(12):1216-1217.
[2]Agrawal S,Patel P,Agrawal A,et al.Metformin use and the risk of esophageal cancer in Barrett esophagus[J].South Med J,2014,107(12):774-779.
[3]Davide S,Lorenza S,Antonella Z,et al.Cancer risk associated with use of metformin and sulfonylurea in type 2 diabetes:a meta- analysis[J].Oncologist,2012,17(6):813-822.
[4]Miyoshi H,Kato K,Iwama H,et al.Effect of the anti-diabetic drug metformin in hepatocellular carcinoma in vitro and in vivo[J].Int J Oncol,2014,45(1):322-332.
[5]Du Y,Zheng H,Wang J,et al.Metformin inhibits histone H2B monoubiquitination and downstream gene transcription in human breast cancer cells[J].Oncol Lett,2014,8(2):809-812.
[6]Bowker SL,Majumdar SR,Veugelers P,et al.Increased cancer-related mortality for patients with type 2 diabetes who use sulfonylureas or insulin[J].Diabetes Care,2006,29(2):254-258.
[7]卢清军,熊宇,严威,等.二甲双胍对肝癌细胞增殖及凋亡相关基因表达的影响[J].中华实验外科杂志,2011,28(7):1107-1110.
[8]Hennessy EJ.Selective inhibitors of Bcl-2 and Bcl-xL:balancing antitumor activity with on-target toxicity[J].Bioorg Med Chem Lett,2016,26(9):2105-2114.
[9]Delbridge AR,Grabow S,Strasser A,et al.Thirty years of BCL-2:translating cell death discoveries into novel cancer therapies[J].Nat Rev Cancer,2016,16(2):99-109.
[10]Hassan M,Watari H,AbuAlmaaty A,et al.Apoptosis and molecular targeting therapy in cancer[J].Biomed Res Int,2014,2014(2):150845.
[11]Yue W,Zheng X,Lin Y,et al.Metformin combined with aspirin significantly inhibit pancreatic cancer cell growth in vitro and in vivo by suppressing anti-apoptotic proteins Mcl-1 and Bcl-2[J].Oncotarget,2015,6(25):21208-21224.
[12]Zhang T,Saghatelian A.Emerging roles of lipids in BCL-2 family-regulated apoptosis[J].Biochim Biophys Acta,2013,1831(10):1542-1554.
[13]Besbes S,Mirshahi M,Pocard M,et al.New dimension in therapeutic targeting of BCL-2 family proteins[J].Oncotarget,2015,6(15):12862-12871.
[14]Han G,Gong H,Wang Y,et al.AMPK/mTOR-mediated inhibition of survivin partly contributes to metformin-induced apoptosis in human gastric cancer cell[J].Cancer Biol Ther,2015,16(1):77-87.
[15]Galluzzi L,Kepp O,Kroemer G.Caspase-3 and prostaglandins signal for tumor regrowth in cancer therapy[J].Oncogene,2012,31(23):2805-2808.
[16]Queiroz EA,Puukila S,Eichler R,et al.Metformin induces apoptosis and cell cycle arrest mediated by oxidative stress,AMPK and FOXO3a in MCF-7 breast cancer cells[J].PLoS One,2014,9(5):e98207.
[17]马华姝,乔宗旭,赵贵芬,等.二甲双胍对子宫内膜异位症在位内膜细胞增殖与凋亡的影响[J/CD].中华妇幼临床医学杂志(电子版),2014,10(5):652-657.
[18]黄文君,陈健,田晶.二甲双胍抑制Foxp3的表达诱导乳腺癌细胞凋亡[J].重庆医学,2014,43(28):3749-3752.
Effect of metformin on human choriocarcinoma cell apoptosis
LIUGuangfen
(ChongqingMunicipalFireCorpsHospital,Chonqing401120,China)
Objective To investigate the effects of metformin on apoptosis of human choriocarcinoma cell and its possible action mechanism.Methods The human choriocarcinoma cell line JEG-3 was selected and divided into the control group and metformin groups(final concentrations of 5,10,20,40 mmol/L).Flow cytometry and immunofluorescence assay were adopted to detect cell apoptosis at 48 h after treatment.The mRNA and protein change trend of Caspase-3,Bcl-2 and Bax were measured by Real-time PCR and Western Bolt.Results Compared with the control group,the early and late apoptosis rate of JEG-3 cells in the metefomin groups were remarkably increased,meanwhile mRNA and protein expression levels of Caspase-3 and Bax were significantly increased,but Bcl-2 mRNA and protein expression were significantly decreased.Conclusion Metformin induces the JEG-3 cells to generate apoptosis by the Caspase-3 and Bcl-2/Bax pathways.
human choriocarcinoma; metformin; cell apoptosis
柳光芬,女,主任技师,主要从事临床检验研究。
10.3969/j.issn.1673-4130.2016.23.015
A
1673-4130(2016)23-3280-03
2016-02-28
2016-05-18)

