沙田柚WRKY转录因子的克隆与序列分析
张 渝,刘玉洁,郭丹妮,覃信梅,韩 愈,李惠敏,秦新民
(1.广西师范大学生命科学学院,广西桂林541006;2.广西师范大学珍稀濒危动植物生态与环境保护教育部重点实验室,广西桂林541006)
沙田柚WRKY转录因子的克隆与序列分析
张 渝1,2,刘玉洁1,2,郭丹妮1,2,覃信梅1,2,韩 愈1,2,李惠敏1,2,秦新民1,2
(1.广西师范大学生命科学学院,广西桂林541006;2.广西师范大学珍稀濒危动植物生态与环境保护教育部重点实验室,广西桂林541006)
利用高通量测序技术对沙田柚自交和异交花柱进行转录组测序,差异分析得到沙田柚WRKY转录因子的序列。该基因的全长序列为1 178 bp (GenBank accession No. KU173833),含有993 bp的开放阅读框(ORF)可编码330个氨基酸,编码蛋白的相对分子质量为37.00 ku,理论等电点为5.79。与未授粉的花柱相比,沙田柚异花授粉1、2、3 d花柱中WRKY转录因子基因的表达量(RPKM)分别为5.67、26.04、17.08;而自花授粉1、2、3 d花柱中WRKY转录因子基因的表达量(RPKM)分别为15.67、14.96、3.89。氨基酸序列分析表明,该氨基酸序列与甜橙、金桔的同源性分别为98%、97%。系统进化分析发现沙田柚WRKY转录因子与甜橙、金桔的亲缘关系很近,属于一个分支。
沙田柚;WRKY;转录因子;自交不亲和性
沙田柚为芸香科柑橘属植物,是配子体自交不亲和性的果树之一。遗传学方面的研究发现,自交不亲和性是由单一多态性的位点即S位点的基因所控制。在不同的植物中,人们相继发现了多种S决定因子的基因:十字花科等植物中的孢子体自交不亲和决定因子基因SCR/SP11(S-locus cystine rich)、SLG(S-linked Glycoprotein)和SRK(S-locus receptor kinase)[1-3];茄科、蔷薇科、车前草科、芸香科等植物中的配子体自交不亲和S基因S-RNase和SLF/SFB(S-locus F-box/S-haplotype specific F-box)[4-7];罂粟科S糖蛋白介导的特殊的配子体自交不亲和S决定因子PrpS和PrsS[8]。近年来的研究发现植物自交不亲和性是一个复杂的、多基因、多种因子相互协同作用的结果,一些非S因子也参与了植物自交不亲和过程。如HT-B是首次在花烟草中鉴定的雌蕊表达的非S因子[9],其功能为破坏花粉管液泡的稳定状态,导致液泡破裂并将S-RNase释放到自我花粉管的细胞质中[10]。其他的非S因子如花柱120 kD糖蛋白和4936因子也参与了花粉的拒绝反应[11]。另外,一些胁迫诱导基因、转录因子、钙离子和激素信号相关的基因也可能参与自交不亲和反应[12]。
WRKY转录因子是WRKY超家族成员之一,首次从甘薯克隆,后来相继从野生的燕麦、荷兰芹和拟南芥中克隆到WRKY cDNAs[13-16]。结构剖析发现在WRKY转录因子的N端是WRKY结构域,C端含有1个锌指结构域,其WRKY结构域能特异性识别下游靶基因的W-box域(含TTGACC/T序列)[14]。大量研究表明,WRKY蛋白在植物的多种生理过程中有重要的调控作用,如生物、非生物胁迫反应和植物的发育和物质代谢过程,包括毛状体和种皮的发育、衰老、生物合成途径及激素信号的调节等[17-19]。
目前,有关WRKY转录因子与植物授粉以及自交不亲和性的研究报道不多。我们对沙田柚自交和异交花柱进行转录组测序,通过对所测的Unigenes功能注释,获得1个沙田柚WRKY转录因子基因;并对其编码的蛋白质进行理化特征,对WRKY转录因子在沙田柚自交与异交花柱中的表达进行分析,旨在为深入研究WRKY转录因子的生理功能,以及该WRKY转录因子与沙田柚自交不亲和性的关系提供依据。
1 材料与方法
1.1 材料
实验材料为沙田柚自交和异交花柱,采集与处理方法按秦新民等[7]报道进行。
1.2 方法
1.2.1 RNA的提取、建库和测序
沙田柚总RNA的提取参照改良Trizol法[20]进行,转录组的建库和测序参考文献[7]。
1.2.2 基因序列分析和系统树构建
序列和蛋白质理化性质的分析分别采用DNAman、ORF finder、NetPhos2.0、SWISS-MODEL、TMPRED等软件进行。
2 结果与分析
2.1 基因的生物信息学分析
NCBI ORF Finder等软件的分析结果表明:沙田柚WRKY转录因子基因(ID:Unigene6821_All)全长序列为1 178 bp(GenBank登录号:KU173833), 该序列含有一个可编码330个氨基酸的开放阅读框(993 bp)(图1)。

图1 沙田柚WRKY转录因子基因序列和推测的氨基酸序列Fig.1 Nucleotide sequence of WRKY transcription factor gene and the deduced amino acid sequence in Citus grandis var. Shatinyu
2.2 编码蛋白的分析及疏水性的预测
在线软件protparam分析结果证明该基因编码的蛋白质相对分子质量(Mr)为37.00 ku,分子式为C1578H2484N456O532S17,等电点pI为5.79。带负电的氨基酸残基(Asp+Glu)数目为45,带正电的氨基酸残基(Arg+Lys)数目为37。蛋白质的疏水性分析见图2。预测该蛋白的不稳定指数为58.57,属不稳定蛋白。

图2 沙田柚WRKY转录因子蛋白的疏水性分析Fig.2 Hydrophobicity analysing of WRKY transcription factor in Citus grandis var. Shatinyu
2.3 编码蛋白的功能结构域分析
采用NCBI的Conserved Domain Architecture Retrieval Tool对编码蛋白进行功能结构域分析,发现在该蛋白的N端含有一个WRKY结构域(如图3)。
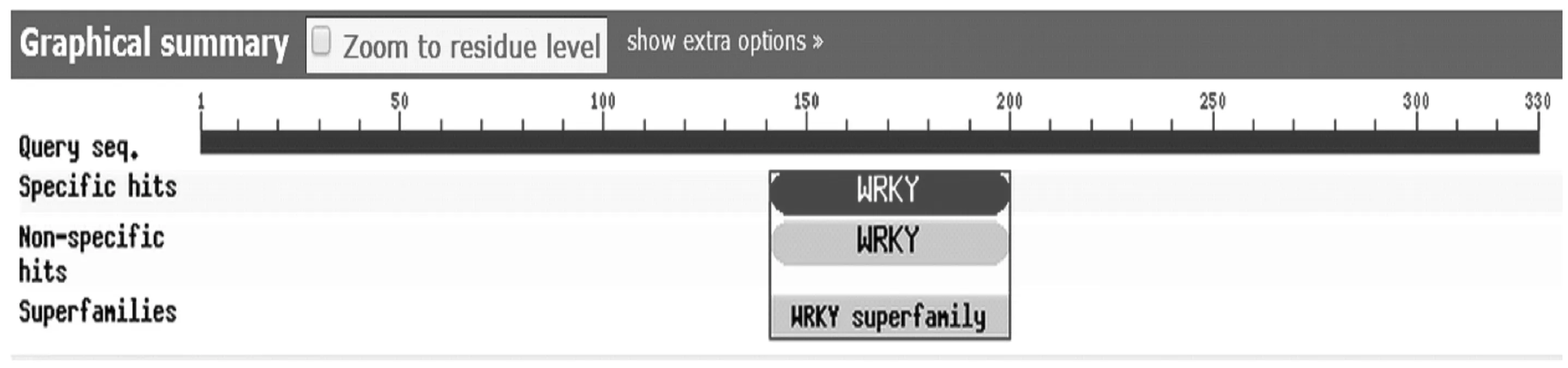
图3 沙田柚WRKY转录因子蛋白保守结构域Fig.3 Conserved domains of WRKY transcription factor in Citus grandis var. Shatinyu
2.4 跨膜结构的预测
跨膜蛋白数据库(TMHMM)预测结果表明该蛋白没有跨膜结构(图4)。
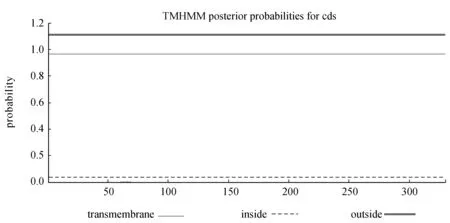
图4 沙田柚WRKY转录因子蛋白的跨膜区预测Fig.4 Result of TMpred prediction on WRKY transcription factor in Citus grandis var. Shatinyu
2.5 编码蛋白质的磷酸化位点预测
采用NetPhos 2.0 Server分析软件对WRKY transcription factor基因所编码的蛋白进行磷酸化预测,发现分值在0.5以上的可能的磷酸化位点在该多肽链中共有31个。其中,色氨酸(Ser)可能的磷酸化位点共有22个(11、13、45、81、85、107、110、111、113、114、131、136、202、243、248、264-267、290、306和309位);苏氨酸(Thr)可能的磷酸化位点有6个(46、 115、167、193、199和230位);酪氨酸(Tyr)可能的磷酸化位点为3个(101、195、270位)。
2.6 编码蛋白质二级结构和三级结构的预测
Predict protein分析的结果表明WRKY转录因子蛋白的二级结构中α-螺旋占10.00%、β-折叠为6.97%、无规则卷曲所占比例最高为83.03%。
编码蛋白的三级结构SWISS-MODEL软件预测的结果表明,该蛋白的单体结构包含了1个α-螺旋和5个β-折叠结构,其余的为无规则卷曲(图5)。

图5 沙田柚WRKY转录因子蛋白的三级结构Fig.5 The tertiary structure of protein in Citrus grandis var. Shatianyu
2.7 同源性分析
将沙田柚WRKY转录因子基因编码的氨基酸与GenBank数据库中11种植物的WRKY蛋白的氨基酸序列进行序列同源性分析,结果表明沙田柚WRKY转录蛋白的氨基酸与甜橙和金桔的同源性分别为98%和97%。运用DNAman软件基于序列的同源性构建系统树,结果表明沙田柚WRKY转录因子与甜橙(Citrussinensis, XP_006481203)和金桔(C._japonica,AKA59519)的亲缘关系很近,属于一个分支(图6)。
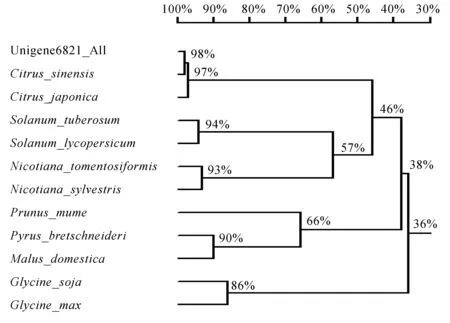
Unigene6821_All(沙田柚,KU173833), C._sinensis(甜橙,XP_006481203), C._japonica(金桔,AKA59519),Solanum tuberosum (马铃薯,NP_001275414), Solanum lycopersicum (番茄, NP_001266272), Prunus_mume (梅,XP_008244778), Pyrus_bretschneideri(梨,XP_009372032), Malus_domestica(苹果, XP_008388360), Nicotiana_sylvestris(美花烟草,XP_009793854), Nicotiana_tomentosiformis(绒毛烟草,XP_009586653),Glycine soja (野生大豆, KHN42136), Glycine max(大豆, XP_006599732)图6 基于氨基酸序列的WRKY转录因子系统发育树Fig.6 Phylogenetic tree based on amino acid sequences of transcription factor
3 讨论
植物自交不亲和是多基因相互协同作用的过程,除了雌蕊和雄蕊决定因子外,其他一些基因如NADPH氧化酶、DELLA、钙离子依赖性的蛋白激酶、钙调蛋白等基因也参与自交不亲和过程[21-22]。WRKY家族是植物特有的转录因子,通过一系列的信号转导调控参与了植物体内许多生理过程,在植物的抗逆反应、抗病性以及生长发育等方面均表现出重要的调控作用[23-24]。在植物生殖方面,Guan等发现拟南芥的WRKY34和WRKY2转录因子在花粉的发育、萌发和花粉管的生长中起着重要的作用,WRKY34和WRKY2的基因突变会造成花粉的成活力下降,影响了花粉的萌发和花粉管的生长[25]。此外,AtWRKY10在拟南芥中还具有调控胚乳增值的功能[26]。
本文克隆的WRKY转录因子在沙田柚自交花柱和异交花柱中的表达有较为明显的差异:在未授粉花柱中其表达量(RPKM)为0.257,自花授粉1、2、3 d花柱中的表达量(RPKM)分别为15.67、14.96、3.89,在自花授粉1 d迅速升高,随后逐步降低。而在异交授粉过程中该WRKY转录因子的表达模式与自花授粉花柱不同,在异花授粉1、2、3 d花柱中基因的表达量(RPKM)则分别为5.67、26.04和17.08。异花授粉过程中除了第1天花柱中该WRKY转录因子的表达量比自花授粉1 d花柱低外,异花授粉2、3 d花柱中该WRKY转录因子的表达量则明显高于自花授粉花柱。此外,沙田柚无论自花授粉或异花授粉后花柱中该WRKY转录因子的表达均显著提高。
WRKY转录因子还参与植物的衰老过程,Robatzek等[27]发现AtWRKY6与拟南芥叶片的衰老有关,李欢等[28]发现NtWRKY40a与多花水仙花瓣衰老过程相关。形态学观察沙田柚自花授粉后2~3 d花粉管停止生长,花柱随后衰老脱落[29]。沙田柚自花授粉花柱中WRKY转录因子的转录水平在授粉的第2、3天明显低于异花授粉花柱,与花柱的衰老过程相关。但该WRKY转录因子基因与沙田柚自交不亲和性的关系尚待进一步研究。
[1] PAETSCH M, MAYLAND-QUELLHORST S, NEUFFER B. Evolution of the self-incompatibility system in the Brassicaceae, identification of S-locus receptor kinase(SRK) in self-incompatible Capsella grandiflora[J]. Heredity, 2006,97:283-290.
[2] SHIBA H, PARK J I, SUZUKI G, et al. Duplicated SP11genes produce alternative transcripts in the S15 haplotype ofBrassicaoleracea[J]. Genes and Systems, 2004,79:87-93.
[3] SHIMOSATO H, YOKOTA N, SHIBA H, et al. Characterization of the SP11/SCR high-affinity binding site involved in self/nonself-recognition in brassica self-incompatibility[J]. The Plant Cell, 2007,19:107-117.
[4] ANDERSON M A, CORNISH E C, MAU S L, et al. Cloning of cDNA for a stylar glycoprotein associated with expression of self-incompatibility inNaicotianaalal[J]. Nature,1986,321:38-44.
[5] HUA Z, MENG X, KAO T H. Comparison of Petunis inflata S-locus F-box protein(Pi SLF) with Pi SLFlike proteins reveals its unique function in S-RNase based self-incompatibility[J]. The Plant Cell, 2007:19:3593-3609.
[6] VAUGHAN S P, RAMANE H, WATARI A, et al. The S haplotype-specific F-box protein gene, SFB, is defective in self-compatible haplotypes ofPrunusaviumandP.mume[J]. The Plant Journal, 2004,39:573-586.
[7] 秦新民,张渝,刘玉洁,等.沙田柚S-RNase基因的克隆及序列分析[J].广西师范大学学报(自然科学版),2015,33(1):139-145.
[8] DE GRAFF B H, VATOVEC S, JUAREZ-DIAZ J A, et al. The Papaver self-incompatibility pollen S-determinant, PrpS, function inArabidopsisthaliana[J]. Current Biology, 2012,22:154-159.
[9] MCCLURE B, MOU B, CANEVASCINI S, et al. A small asparagine-rich protein required for S-allele-specific pollen rejection in Nicotiana[J]. Proc Natl Acad Sci USA ,199,96:13548-13553.
[10] GOLDRAIJ A, KONDO K, LEE C B, et al. Compartmentalization of S-RNase and HT-B degradation in self-incompatible Nicotiana[J]. Nature, 2006,439:805-810.
[11] NATHAN HANCOCK C, KENT L, MCCLURE B A. The stylar120 kDa glycoprotein is required for S-specific pollen rejection in Nicotiana[J]. Plant J, 2005,43:716-723.
[12] DISTEFANO G, CARUSO M, LA MALFA S, et al. Histological and molecular analysis of pollen-pistil interaction in Clementine[J]. Plant Cell Rep, 2009,281:439-1451.
[13] ISHIGURO S, NAKAMURA K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5’upstream regions of genes coding for sporamin and b-amylase from sweet potato[J]. Mol Gen Genet, 1994,244:563-571.
[14] RUSHTON P J,MACDONALD H, HUTTLY A K, et al. Members of a new family of DNA-binding proteins bind to a conserved cis-element in the promoters of a-Amy2 genes[J]. Plant Mol Biol, 1995,29:691-702.
[15] RUSHTON P J, TORRES J M, WERNERT P, et al. Interaction of elicitor-induced DNA binding proteins with elicitor response elements in the promoters of parsley PR1 genes[J]. EMBO J, 1996,15:5690-5700.
[16] DE PATER S, GRECO V, PHAM K, et al. Characterization of a zinc-dependent transcriptional activator from Arabidopsis[J]. Nucleic Acids Res, 1996,24:4624-4631.
[17] BAKKHI M, OELMULLER R. WRKY transcription factors: Jack of many trades in plants[J]. Plant Signaling and Behavior, 2014, 9(2): e27700.
[18] 宋钰,荆邵娟,余迪求.水稻WRKY转录调控因子基因功能研究进展[J]. 中国水稻科学,2009,23(5):447-455.
[19] ZHOU X, JIANG Y, YU D. WRKY22 transcription factor mediates dark-induced leaf senescence in Arabidopsis[J]. Molecules and Cells, 2011, 31: 303-313.
[20] BARIOLA P A, HOWARD C J, TAYLOR C B, et al. The Arabidopsis ribonuclease gene RNS1 is tightly controlled in response to phosphate limitation[J]. The Plant Journal, 1994, 6: 673-685.
[21] ZHANG S W, HUANG G X, DING F, et al. Mechanism of seedlessness in a new lemon cultivar‘Xiangshui’ [Citruslimon(L.) Burm. F][J]. Sex Plant Reprod,2012, 25:337-345.
[22] ZHANG S, DING F, HE X, et al. Characterization of the ‘Xiangshui’lemon transcriptome by de novo assembly to discover genes associated with self-incompatibility[J]. Molecular Genetics and Genomics, 2015, 290: 365-375.
[23] AGARWAL P, REDDY M P, CHIKARA J. WRKY: its structure, evolutionary relationship, DNA-binding selectivity, role in stress tolerance and development of plants[J]. Molecular biology reports, 2011, 38: 3883-3896.
[24] RUSHTON P J, SOMSSICH I E, RINGLER P, et al. WRKY transcription factors[J]. Trends in Plant Science, 2010, 15: 247-258.
[25] GUAN Y, MENG X, KHANNA R, et al. Phosphorylation of a WRKY transcription factor by MAPKs is required for pollen development and function in Arabidopsis[J]. Plos Genetics, 2014, 10:1-12.
[26] LUO M, DENNIS E S, BERGER F, et al. MINISEED3 (MINI3), a WRKY family gene, and HAIKU2 (IKU2), a leucine-rich repeat (LRR) KINASE gene, are regulators of seed size in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102: 17531-17536.
[27] ROBATZEK S, SOMSSICH I E. A new member of the Arabidopsis WRKY transcripyion factor family, AtWRKY6, is associated with both senescence-and defence-related processes[J]. The Plant Journal, 2001, 2:123-133.
[28] 李欢,何炎森,李科,等. 多花水仙WRKY转录因子的克隆与序列分析[J]. 热带作物学报,2014,35(12):2378-2383.
(责任编辑 马殷华)
Cloning and Sequence Analysis of WRKY Transcription Factor fromCitrusgrandisvar.ShatinyuHort
ZHANG Yu1,2, LIU Yujie1,2, GUO Danni1,2, QIN Xinmei1,2,HAN Yu1,2, LI Huimin1,2, QIN Xinmin1,2
(1.College of Life Science, Guangxi Normal University, Guilin Guangxi 541006,China; 2.Key Laboratory of Ecology of Rare and Endangered Species and Environmental Protection(Ministry of Education), Guangxi Normal University, Guilin Guangxi 541006,China)
In this study, the transcriptome of the self-pollinated styles and cross-pollinated styles ofCitrusgrandisvar.ShatinyuHort were sequenced by high-throughput sequencing technology. WRKY transcription factor gene ofCitrusgrandisvar.ShatinyuHort was obtained through variance analysis method. It is 1 178 bp in length with an open reading frame (ORF) of 993 bp, encoding 330 amino acids with deduced molecular weight of 37.00 ku, and theoretical pI value of 5.79. Compared with un-pollinated styles, the expression (RPKM) of WRKY transcription factor gene is respectively 5.67, 26.04 and 17.08 in 1, 2, 3 days cross-pollinated styles, and expression (RPKM) of the gene is respectively 15.67, 14.96 and 3.89 in 1, 2, 3 days self-pollinated styles. The homology analysis of amino acid sequence indicated that the WRKY transcription factor protein shared higher homology with that ofCitrussinensis(98%) andCitrusjaponica(97%). Phylogenetic analysis revealed that WRKY transcription factor gene showed closer kinship with that ofCitrussinensisandCitrus_japonica,indicating that they belong to the same evolutionary branch.
Citrusgrandisvar.ShatinyuHort; WRKY; transcription factor; self-incompatibility
10.16088/j.issn.1001-6600.2016.03.019
2015-11-27
国家自然科学基金资助项目(31360477);广西教育厅项目基金资助(2013YB036)
秦新民(1956—),男,广西灵川人,广西师范大学教授,博士。E-mail:xmqin@mailbox.gxnu.edu.cn
Q946
A
1001-6600(2016)03-0131-07

