对钢铁吸氧腐蚀过程的实验探究
陆燕海+江旭峰
摘要:重新审视了钢铁吸氧腐蚀实验的过渡期现象。从金属表面显微尺寸的电化学不均匀性、电解质溶液中溶解氧的浓差等角度,对盐水滴实验出现过渡期现象的成因进行了文献调研分析与实证探究,认为钢铁发生盐水滴腐蚀需经历四个阶段,此结果有助于增进一线教师对金属电化学腐蚀原理与局部腐蚀原理的理解。
关键词:钢铁吸氧腐蚀;盐水滴实验;过渡期现象;实验探究
文章编号:1005–6629(2016)11–0060–04 中图分类号:G633.8 文献标识码:B
1 问题的背景
金属在潮湿空气里会形成无数微小原电池而被腐蚀。自然条件下,由于金属表面水膜的酸性一般不强且有空气中的氧气不断溶于其中,因此吸氧腐蚀通常是金属主要的腐蚀方式。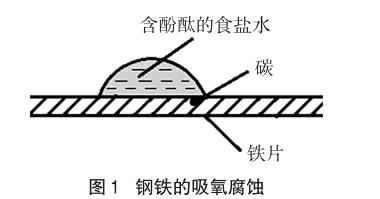
苏教版选修教材《实验化学》专题5中有关钢铁吸氧腐蚀的实验内容为:取一片铁片,用砂纸擦去铁锈,在铁片上滴1滴含酚酞的食盐水(如图1),静置1~2min,观察现象。
一般认为,液滴中心区域的O2浓度小,Fe充当阳极,发生氧化反应Fe-2e-=Fe2+,为腐蚀区;液滴边缘区域O2浓度大,钢铁中所含的杂质碳作阴极,发生还原反应O2+2H2O+4e-=4OH-,液滴外缘碱性增强,可以看到一个红圈,久置又会出现铁锈环。我们多次细致地重复进行该实验后发现,在钢铁吸氧腐蚀实验的初始阶段,盐水滴中心部位会出现点状的红色分布,后又逐渐褪去,后期才会在液滴边缘出现稳定的红圈。
文献查阅后发现,教学同行们关于盐水滴实验的研究主要着眼于实验装置改进、实验条件优化和影响因素分析等方面[1~5],关于吸氧腐蚀实验过渡期现象的观察与探讨迄今仍为空白。自然条件下,滴有盐水滴的铁片在发生吸氧腐蚀时受到金属表面显微尺寸电化学不均匀性、电解质溶液中溶解氧的浓差等多种因素的共同影响,因而实验中的变红与生锈的稳定态现象并非一蹴而就。
本文拟通过对钢铁吸氧腐蚀实验的过渡期现象的审视与实证研究,旨在增进我们对真实状态下金属电化学腐蚀原理与局部腐蚀的理解,从而提升化学同行们对盐水滴实验的操作与教学调控能力。
2 实证与讨论
实验1 取一铁片,用砂纸充分打磨去除表面铁锈,滴1滴含酚酞试液的食盐水,静置并细致地进行实验观察。10s后盐水滴中心部位出现粉红色小区,后迅速变浅、消失,1min后液滴外缘位置开始出现粉红色环。另取一铁片并表面除锈,滴1滴含K3[Fe(CN)6]溶液的食盐水,静置并细致地进行实验观察。10s后食盐水滴覆盖的金属表面出现不规则的淡蓝色线状分布,随之液滴外缘附近蓝线又迅速变浅、消失,而中心区域则渐深渐粗、相互汇聚,稳定后成一蓝斑。
实验2 取一表面处理后的铁片,滴1滴含酚酞及K3[Fe(CN)6]溶液的食盐水,静置并细致地观察实验现象。10s后,盐水滴中心部位出现淡蓝色细线与粉红色小点交错分布的现象,见示意图2-a;然后,粉红色小点又迅速变浅、消失,而淡蓝色细线渐浓渐粗并逐步在液滴中心区域集聚;1min后,液滴的边缘位置开始出现粉红色、红色,从而形成两个不规整的红蓝同心环,见示意图2-b。若继续长时间放置,在两色环交界处还能观察到棕色的铁锈生成。
可见,钢铁电化学腐蚀实验在达到稳定态前的过渡期现象也比较丰富,最终呈现的红环(或蓝斑)并不是一蹴而就的。针对过渡期间液滴中心区域小红点先有后无现象的成因,我们从食盐水溶解氧的角度进行实证探讨。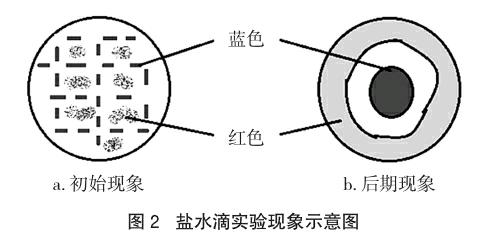
实验3 将食盐水煮沸,在密封环境下自然冷却至室温,加入适量的指示剂酚酞与K3[Fe(CN)6]溶液,混匀后备用。重复实验1步骤,约10s盐水滴中心部位只有淡蓝色细线(无小红点!),然后逐渐加深并聚于盐水滴中心区域;约1min盐水滴边缘开始出现粉红色,进而出现图2-b的稳定态现象。
实验4 按图3组装实验装置。将盛放有食盐水的具支锥形瓶在冰水浴中冷却后,向溶液中缓慢地通入氧气并持续较长时间使之饱和,再加入适量酚酞及K3[Fe(CN)6]溶液,获得0℃时高溶解氧的食盐水。当恢复至室温时,食盐水溶液中的氧气将处于过饱和状态。用于实验1操作时,在盐水滴中心部位会出现淡蓝色细线与粉红色小点交错分布的现象,但该电化学腐蚀实验的过渡期现象能持续更长的时间(一般可达到40s以上)。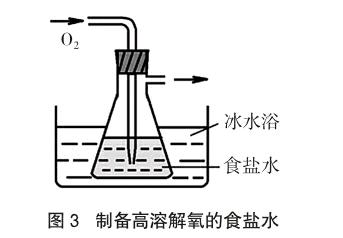
基于对实验2、实验3与实验4中电化学腐蚀的过渡期现象差异的对比,说明食盐水滴中本身存在的溶解氧含量的高低,直接影响到实验初始阶段出现粉红色小点所持续时间的长短。当食盐水中不含溶解氧(或其含量极低)时,则不会出现粉红色小点与淡蓝色细线的交错分布的现象。
至于实验过渡期出现其他现象的成因,如盐水滴覆盖的铁片表面有淡蓝色细线并逐步向液滴中心区域集聚、加深等,我们可以从金属表面显微尺寸的电化学不均匀性角度去理解。
文献[6,7]表明,金属表面电化学的不均匀性,会使金属材料表面存在微小的电位高低不等的区域,促使电化学腐蚀行为的发生。主要类型有:(1)金属表面化学成分的不均匀性而引起微观电池,如工业铸铁中的石墨、碳钢中的渗碳体Fe3C、纯锌中的铁杂质FeZn7等在腐蚀介质时表面就会形成许多微阳极和微阴极而导致腐蚀(如图4-a);(2)金属组织的不均匀性而构成微观电池,如晶粒与晶界、裂缝(或凹痕)处的腐蚀微电池,晶界及孔隙处作为阳极而优先发生腐蚀(如图4-b);(3)金属表面物理状态(应力分布、形变等)的不均匀性而构成微观电池,如钢铁弯曲处、铆钉头部区域容易优先腐蚀(如图4-c);(4)金属表面膜的不完整而形成微观电池,由于金属表面的钝化膜或镀覆的阴极性金属镀层等存在破损时,该处裸露的金属基体电位较负而作为阳极受到腐蚀(如图4-d)。

当含赤血盐的食盐水滴于铁片的初始阶段,盐水滴内的溶解氧含量基本上是相同的,但受钢铁本身化学成分不均匀、表面氧化膜不完整及砂纸打磨处理时划痕的出现等因素影响,还是会在铁片表面产生微观电化学的不均匀性而构成腐蚀电池。其中,钢铁表面划痕(或缝隙)处的电极电位较负并发生阳极反应,生成的Fe2+遇[Fe(CN)6]3-而显示蓝色;划痕周围则是阴极区,O2得电子生成OH-而使酚酞显粉红色。
但这样的过渡期现象并不能持续多久,这是由于盐水滴内的少量溶解氧因阴极反应会快速消耗,而液滴中心部位的水层最厚,O2从空气经溶解、扩散而来的补充比边缘部位要慢,导致液滴中心与边缘部位间的溶解氧存在浓度差,从而构成了浓差腐蚀电池。其中,阴极反应的碱化过程集中在富氧的食盐水滴外缘,外缘下铁表面腐蚀敏感点在初始阶段腐蚀形成的Fe2+会在高碱、富氧的环境中逐渐转变成难溶性的氢氧化物或氧化物沉淀,而这种沉淀物能保护腐蚀敏感点,避免了Fe2+的进一步生成,因此外缘的淡蓝色细线也会逐渐消失;氧浓差腐蚀的阳极过程主要集中于盐水滴内的中心部位,此时该区域中的铁则会持续、快速氧化成Fe2+,从而出现了盐水滴中心的蓝斑。
基于上述理解,只要在盐水滴实验时控制液滴中心部位经溶解、扩散而来的O2的补充速度快于边缘部位,构成的氧浓差电池的阴、阳极位置及相关实验现象就当与先前实验的区域倒置。以下实验5的结果恰能很好地佐证了这样的分析。
实验5 在广口瓶底与肩部位置分别打一孔,用玻璃胶粘接导管后配上橡胶管与止水夹,然后与长导管(管口尖细!)按图5组装好装置。打开止水夹A、B,从A处持续、均匀地通一段时间的N2,排尽瓶内空气。向处理后的铁片上滴加适量含酚酞与K3[Fe(CN)6]的食盐水(预先煮沸处理),通过细导管向液滴中心正上部吹氧气,使中心部位富氧而边缘部位缺氧,稳定后的现象恰好与实验3互为倒置。
3 研究结论
受到金属表面显微尺寸电化学不均匀性、电解质溶液中溶解氧的浓差等因素的影响,钢铁的盐水滴腐蚀实验在达到稳定状态以前,具有丰富的值得探讨的过渡期现象。结合实验结果与文献资料,我们认为钢铁的盐水滴腐蚀主要经历以下几个阶段:
(1)由于起始时食盐水滴内各处的溶解氧浓度基本上是相同的,而所谓的干净铁表面在预处理时难免会有划痕等,造成了金属表面存在不均匀性。因此,最初时的淡蓝色所显示的阳极腐蚀区位于划痕线上,在其周围出现的粉红色所显现的是阴极区。但这种状态并不稳定,也不会延续很久。
(2)随着盐水滴的溶解氧因阴极过程而快速消耗,因液滴中心部位的水层最厚,从空气经溶解、扩散而来的氧气的补充速度相对较慢,导致液滴中心与边缘部位间的溶解氧存在浓度差而构成浓差腐蚀电池。由此,中心部位碱化过程逐渐停止,粉红色逐渐消失。
(3)钢铁表面的阴极反应的碱化过程逐渐集中到富氧的盐水滴外缘,边缘下铁表面腐蚀敏感点在初始阶段腐蚀形成的Fe2+会在高碱、富氧的环境中,逐渐转变成难溶性的氢氧化物或氧化物沉淀,而这种沉淀物能保护腐蚀敏感点,避免了Fe2+的进一步生成,因而外缘的淡蓝色细线也会逐渐消失。
(4)氧浓差腐蚀的阳极过程主要集中于液滴的中心部位,此时该区域中的铁则会持续、快速氧化成Fe2+,遇[Fe(CN)6]3-而显蓝色;氧浓差腐蚀的阴极过程则集中于液滴边缘,从空气中快速补充的O2还原为OH-,使酚酞指示剂显红色。
通过以上过渡期的一系列现象变化,便会出现红蓝同心环的稳定状态。若继续放置,在两色环交界处最终出现了棕色的铁锈。
参考文献:
[1]唐宗培.金属电化学腐蚀的实验探究[J].化学教育,2004,(8):50~51.
[2]李晓萍.吸氧腐蚀实验设计[J].科学大众,2014,(8):24.
[3]徐泓,朱敏,魏明贵.铁粉吸氧腐蚀系列实验的设计及应用[J].化学教学,2015,(4):63~66.
[4]刘先昊,朱海英.钢铁吸氧腐蚀实验的条件优化[J].教学仪器与实验,2008,(108):37.
[5]董小玉,施志斌.对钢铁吸氧腐蚀现象的再讨论[J].教育界,2015,(31):148~149.
[6]陈鸿海主编.金属腐蚀学[M].北京:北京理工大学出版社,1995:15~56.
[7]刘秀晨,安成强主编.金属腐蚀学[M].北京:国防工业出版社,2002:38~64.

