1例携带HFE基因剪切突变的遗传性血色病患者家系调查
宁会彬, 何 佳, 李俊利, 刘俊平, 肖二辉, 尚 佳
(河南省人民医院 感染科, 郑州 450000)
1例携带HFE基因剪切突变的遗传性血色病患者家系调查
宁会彬, 何 佳, 李俊利, 刘俊平, 肖二辉, 尚 佳
(河南省人民医院 感染科, 郑州 450000)
目的 探讨1例新型的遗传性血色病(HH)患者家系HFE基因突变形式。方法 对确诊的1例HH患者分析其与5位相关亲属的血色病基因,提取血液基因组 DNA,采用PCR扩增相关基因 HFE、HJV、HAMP、转铁蛋白受体(TfR)2、SLC40A1的外显子、内含子剪切序列,琼脂糖凝胶电泳、纯化后,双向直接测序检测突变位点。结果 先证者肝功能异常,血清铁(SI)、总铁结合力(TIBC)、铁蛋白(SF)、转铁蛋白饱和度(TS)均升高,HFE基因外显子EXON2的区间序列2号内含子第4个碱基出现T→C纯合突变(IVs 2+4T→C, C/C 纯合,splicing,异常),HJV、HAMP、TfR2、SLC40A1未见异常,患者儿子出现与其相同纯合突变,3位亲属存在杂合突变,1位亲属无异常突变。 结论 基因检测在血色病诊断中起着重要作用,HFE基因IVs 2+4T→C突变可能是新型的中国HH的致病遗传基因突变类型。
血色素沉着症; 点突变; 基因, 调节; 系谱
原发性血色病又称遗传性血色病(hereditary hemochromatosis, HH),是由于第 6号染色体存在血色病突变基因而导致不相宜的自饮食中铁吸收增多,是与人类白细胞抗原相关的常染色体隐性遗传的铁负荷过多性疾病。随着大量铁离子逐渐沉积于肝、心、胰腺等器官的实质细胞中,导致组织纤维化和结构改变,最终可引起器官功能障碍和衰竭,如肝硬化、肝癌、糖尿病、心力衰竭、垂体及性腺功能减退、关节疾病和皮肤色素沉着等[1]。对1例发生基因突变的HH患者家系进行遗传分析,现报告如下。
1 资料与方法
1.1 研究对象 患者男性,32岁,因“反复转氨酶升高5年余”于2016年5月入院。查体:面色青黑,其他皮肤褶皱处色素沉着,脾大,肋下3 cm可触及,心肺听诊未见明显异常。实验室检查:ALT 122 U/L,AST 49 U/L,Alb 43.3 g/L,空腹血糖5.2 mmol/L,血清铁蛋白(serum ferritin,SF) 7614 ng/ml,血清铁(serum iron,SI) 201 μmol/L,总铁结合力(total iron binding capacity,TIBC) 279 μmol/L,转铁蛋白饱和度(transferrin saturation,TS)72%;嗜肝病毒和非嗜肝病毒、甲状腺功能、血常规、尿常规检测均阴性。彩超:肝实质回声致密增强,脾脏增大。患者无肝活组织检查禁忌,与患者沟通后签署知情同意书,行肝穿刺活组织检查:肝细胞内弥漫性含铁血黄素颗粒沉积,肝小叶灶状坏死,伴巨噬细胞聚集并吞噬含铁血黄素颗粒,部分小胆管上皮细胞内可见含铁血黄素颗粒,普鲁士蓝染色肝细胞内弥漫性阳性,部分胆管上皮细胞及吞噬细胞阳性,符合HH表现(图1)。


图1 肝穿刺活组织检查(×100) a:HE染色显示肝细胞内弥漫含铁血黄素颗粒沉积;b:普鲁士蓝染色显示弥漫性阳性改变
诊断标准参考2011年版《美国血色病诊疗指南》[2](图2),结合患者临床表现、实验室检测和病理结果明确诊断为HH。为进一步明确其遗传背景,在告知并签署知情同意书后,采集患者及其他5位家属外周静脉血,离心后分离血清、血浆,并将样本置于-80 ℃冰箱保存,用于基因检测。

图2 HH诊断流程
1.2 研究方法
1.2.1 材料与设备 OLYMPUS AU600全自动生化分析仪(日本 Olympus 公司);罗氏 Cobas e601电化学发光免疫分析仪,基因组 DNA 提取试剂盒(TIANGEN 公司);HH相关5种基因引物合成(生工生物工程上海股份有限公司); DNA gel extraction 试剂盒(德国QIAGEN 公司); PCR 仪(美国Applied Biosystems公司);ABI XL-3730DNA测序仪(美国PE公司)。
1.2.2 铁代谢及生化指标检测 检测SF、SI、TIBC水平,TS=SI/TIBC×100%。正常值参考区间如下。SF:男30~350 ng/ml,女20~300 ng/ml;SI:男 8.1~28.3 μmol/L,女6.6~26.0 μmol/L; TIBC:46.4 ~ 69.5 μmol/L; TS: 20%~55%。同时检测血清转氨酶、胆红素、血糖等生化指标。
1.2.3 基因检测 抽提患者外周血基因组DNA。PCR扩增 HFE、HJV、HAMP、转铁蛋白受体(transferring receptor,TfR)2、SLC40A1基因外显子、内含子剪切序列及5′、3′端的非翻译区(untranslated region,UTR)。扩增引物通过Primer3.0软件设计(表1)。PCR程序: 95 ℃预变性5 min,95 ℃变性 45 s,退火温度55 ℃ 45 s,72 ℃延伸90 s,35个循环。PCR产物经10 g/L琼脂糖电泳、切胶、回收。同样方法对患者家属行HFE基因检测处理,纯化产物送北京宏微特斯生物科技有限公司双向直接测序,测序结果与基因文库中的基因序列进行对照, 应用 Sequencher 4.2 软件分析测序结果。然后通过最新的系统Polphen、Mutationtaster、SIFT、I-mutant和PROVEAN软件预测该基因突变是否可能与疾病相关。
1.2.4 家系调查和家系遗传图谱分析 家系调查问卷内容包括性别、年龄、是否近亲婚配、健康状况、有无慢性肝病、既往肝功能检查结果、胆红素水平等。获取部分家系成员HFE基因 DNA测序分析结果后, 根据HFE基因突变按遗传作图方法标记出HFE基因突变家系成员的位置, 分析突变基因的来源和遗传方式。
2 结果
2.1 一般资料 先证者及家系成员一般资料及铁代谢相关检测结果见表2。
2.2 基因检测 先证者血色病相关HFE、HJV、HAMP、 TfR2、SLC40A1基因检测中,仅在HFE基因外显子EXON2 相应区间序列2号内含子第4个碱基出现T→C纯合突变(IVs 2+4T→C, C/C纯合,splicing,异常)。患者儿子与先证者同为HFE IVs 2+4T→C纯合突变,患者父母和妻子均为IVs 2+4T→C, C/T杂合突变,患者妹妹为正常TT纯合表型(图3)。
2.3 家系成员遗传图谱 根据测序结果, 明确每位家系成员的HFE基因型, 以IVs 2+4T→C等位基因为基础,绘制家系图谱(图4)。
3 讨论
随着基因检测技术的不断发展,血色病的诊治有了飞速的进展[3]。目前认为HH的发病机制可能与HFE、HJV、HAMP、TfR2和 SLC40A1等基因突变有关,导致转铁蛋白-转铁蛋白受体机制紊乱[4]。在国外,HFE基因异常尤其是C282Y位点的基因突变与80%的HH患者有明确的相关性,被认为是诊断HH的有力依据。在我国HH基因突变主要为个案报道[5-6],仅发现HJV C321X、HFE H63D和HFE IVS 3+5T>C等少数非典型HFE突变,然而其遗传机制尚不明确。HFE 是第一个被确定的血色病相关基因,其中C282Y(酪氨酸取代282位半胱氨酸)和H63D(天冬氨酸取代63位组氨酸)是最主要的2个致病性突变位点。在欧美国家,尤其是在高加索人群中,约85%~90%的HH患者带有C282Y纯合突变或C282Y/H63D复合突变,然而HFE C282Y基因突变在亚洲人群中较低。这也提示亚洲人群中HH的遗传基因或以非HFE 相关性血色病为主[7]。因此应更关注非HFE的突变类型,以期发现中国HH的基因遗传背景。
表1 HFE /HJV/HAMP/TfR2/SLC40A1基因引物序列

表2 先证者及家系成员一般资料及铁代谢相关检测结果
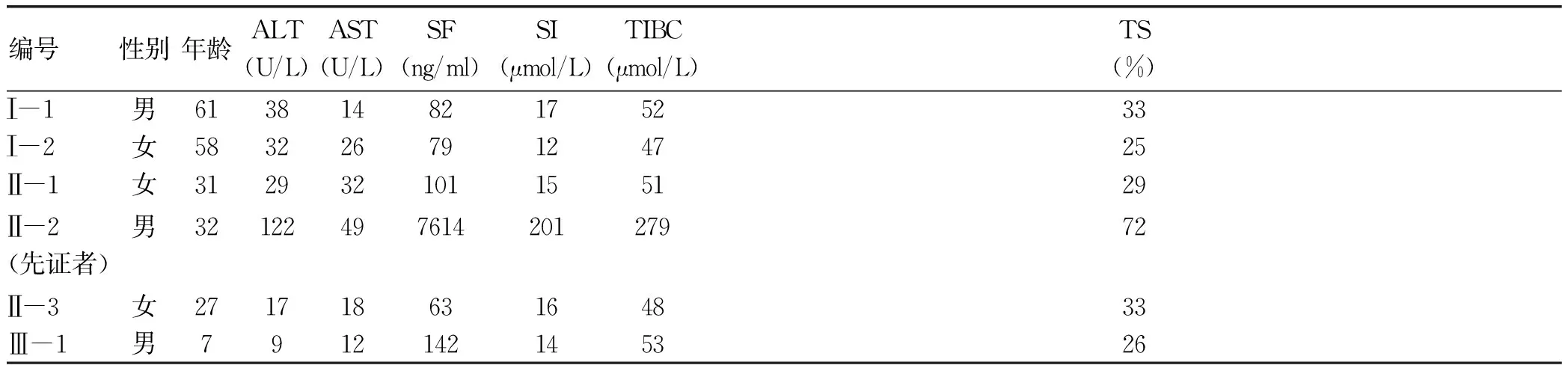
编号性别年龄ALT(U/L)AST(U/L)SF(ng/ml)SI(μmol/L)TIBC(μmol/L)TS(%)Ⅰ-1男61381482175233Ⅰ-2女58322679124725Ⅱ-1女312932101155129Ⅱ-2(先证者)男 32 122 49 7614 201 279 72 Ⅱ-3女27171863164833Ⅲ-1男7912142145326
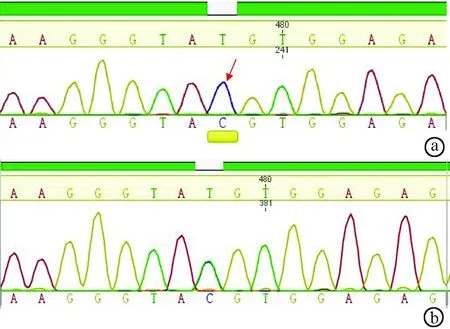
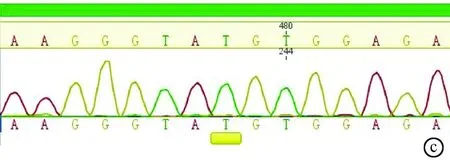
图3 基因检测结果 a. HFE IVs 2+4T→C,C/C纯合突变;b. HFE IVs 2+4T→C, C/T杂合突变;c. HFE正常
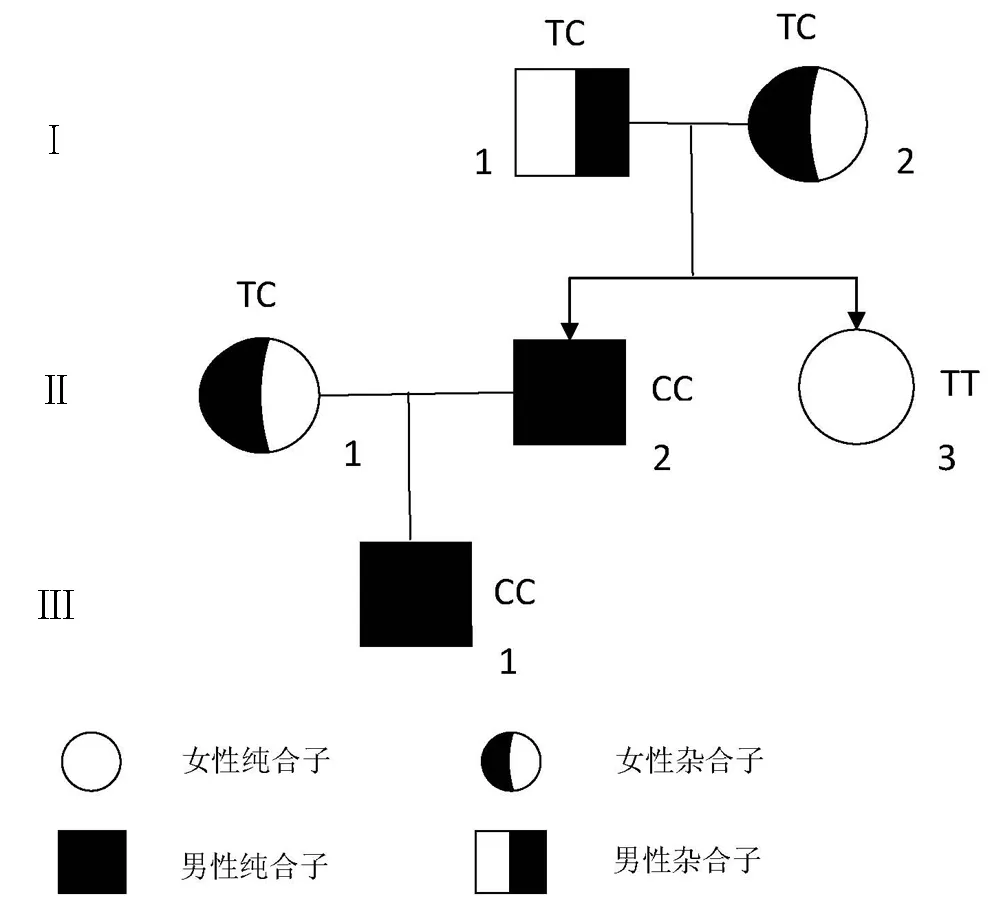
图4 家系成员遗传图谱 Ⅱ-2为本研究HH患者(先证者);Ⅰ-1、Ⅰ-2、Ⅱ-1为杂合子异常,Ⅱ-3为正常,Ⅲ-1为纯合突变异常。除先证者外,其他亲属TS均正常
在线人类孟德尔遗传数据库根据不同基因突变情况将 HH 分为 4个类型:1 型为 HFE 突变所致,故又称为 HFE 相关血色病;2 型为 HJV 基因(2A)和 HAMP 基因(2B)突变所致;3 型为 TfR2 基因突变所致;4型为 FPN 基因突变所致[1]。HJV mRNA 主要在肝脏、心脏和骨骼肌中表达[8],其中肝实质细胞内 HJV的表达对铁调素的分泌具有重要的调节功能,进而维持机体内铁代谢的平衡,其异常突变导致铁调素表达降低而致病,其中p.C321X突变类型在我国多次报道[9-10],此外p.I281T 纯合突变、p.R326X突变也被证实可引起 HJV 蛋白缺失尾部的糖基磷脂肌醇锚定结构域,进而形成可溶性HJV,最终引发铁代谢异常,被认为是我国最常见的基因突变类型。HAMP 编码的是肝脏分泌的小分子肽类激素,是负性铁调节激素。HAMP 基因本身缺失的表型与HJV功能缺失导致的表型一致,其铁蓄积严重且速度更快[11]。TfR2 基因突变是在2000年发现的常染色体隐性遗传形式。它位于染色体7q22,由18个外显子组成,编码TfR2蛋白,参与肝细胞摄取转铁蛋白结合铁,并与 HFE 结合后,调节铁调素的表达从而致病[12-13]。FPN基因突变引起的铁超负荷与前几种基因不同。FPN 基因包括2种突变类型:一种是突变导致其编码的铁泵蛋白不能定位在细胞表面的“功能缺失性突变”,铁离子主要沉积在网状内皮系统 (肝和脾),此种情况被称为膜转铁蛋白疾病[14];另一种是表达于细胞表面的FPN产生铁调素抵抗“功能获得性突破”,与HFE 相关血色病类似[15]。
本研究的HH家系中,先证者及其儿子属于HFE基因突变,其表型为2号内含子第4个碱基出现T→C纯合突变(IVs 2+4T→C, C/C 纯合突变),患者妻子和父母表现为该表型的T/C杂合突变,其妹妹为正常纯合表型,该遗传形式符合遗传定律,属于常染色体的隐性遗传。该家系先证者发病,SF、TS、SI、TIBC均明显升高,肝活组织检查可见明显大量铁沉积,诊断明确。此外,指南[2]中提出HH按病程可分为3期: 1期为患者具有“遗传易感性”, 但尚未发生铁过度沉积;2期为患者具有铁过度沉积的显型证据, 尚无组织或器官损伤; 3期为患者铁过度沉积, 导致组织和器官损伤。患者儿子存在同样基因突变但尚未发病,处于疾病的1期阶段,支持除遗传因素外,多种因素所致患者体内铁过载进而引起相应器官损伤而致病。本研究发现的基因突变在我国尚未见报道,这或许是我国HH患者发病相关的基因表型,但其影响基因突变相关氨基酸或蛋白质功能的变化及具体发病机制仍需要大量研究进一步证实和探讨。鼓励HH相关基因突变的新类型个例及家系的报道,积极开展有关血色病的大规模人群流行病学调查,确立与中国人群相关的 HH 基因突变类型库,通过快速、有效的临床基因诊断方法对疾病做出早期诊断及防治是HH研究的重点,这也是本病未来诊治的基础。
[1] European Association for the Study of the Liver. EASL clinical practice guidelines for HFE hemochromatosis[J]. J Hepatol, 2010, 53(1): 3-22.
[2] BACON BR, ADAMS PC, KOWDLEY KV, et al. Diagnosis and management of hemochromatosis: 2011 practice guideline by the American Association for the Study of Liver Diseases[J]. Hepatology, 2011, 54(1): 328 -343.
[3] BLACHIER M, LELEU H, PECK-RADOSAVLJEVIC M, et al. The burden of liver disease in Europe: a review of available epidemiological data[J]. J Hepatol, 2013, 58(3): 593-608.
[4] ZOLLER H, HENNINGER B. Pathogenesis, diagnosis and treatment of hemochromatosis[J]. Dig Dis, 2016, 34(4): 364-373.
[5] KATSAROU MS, LATSI R, PAPASAVVA M, et al. Population-based analysis of the frequency of HFE gene polymorphisms: correlation with the susceptibility to develop hereditary hemochromatosis[J]. Mol Med Rep, 2016, 14(1): 630-636.
[6] JIANG J, HUANG JM, QIAN W, et al. Clinical research and preliminarily exploration of genetic basis on a hereditary hemachromatosis pedigree[J]. Chin J Hepatol, 2010, 18(11): 842-844.(in Chinese) 江军, 黄金明, 钱伟, 等. 一个遗传性血色病家系的临床特点及其遗传基础初探[J]. 中华肝脏病杂志, 2010, 18(11): 842-844.
[7] McDONALD CJ,WALLACE DF,CRAWFORD DH, et al. Iron storage disease in Asia-Pacific populations: the importance of non-HFE mutations[J]. Gastroenterol Hepatol, 2013, 28(7): 1087-1094.
[8] WALLACE DF, SUMMERVILLE L, CRAMPTON EM, et al. Combined deletion of Hfe and transferrin receptor 2 in mice leads to marked dysregulation of hepcidin and iron overload[J]. Hepatology, 2009, 50(6): 1992-2000.
[9] PAPANIKOLAOU G, SAMUELS ME, GOLDBERG YP, et al. Mutations in HFE2 cause iron overload in chromosome 1q-linked juvenile hemochromatosis[J]. Nat Genet, 2004, 36(1): 77-82.
[10] HUANG FW, RUBIO-ALIAGA I, KUSHNER JP, et al. Identification of a novel mutation (C321X) in HJV[J]. Blood, 2004, 104(7): 2176-2177.
[11] LI SF, XUE J, ZHANG L, et al. Two middle-age-onset hemochromatosis patients with heterozygous mutations in the hemojuvelin gene in a Chinese family[J]. Int J Hematol, 2014, 99(4): 487-492.
[12] CAMASCHELLA C, ROETTO A, CALA, et al. The gene TFR2 is mutated in a new type of haemochromatosis mapping to 7q22 [J].Nat Genet, 2000, 25(1): 14-15.
[13] CHEN J, ENNS CA. Hereditary hemochromatosis and transferrin receptor 2[J]. Biochim Biophys Acta, 2012, 1820(3): 256-263.
[14] OLYNYK JK, TRINDER D, RAMM GA, et al. Hereditary hemochromatosis in the post-HFE era[J]. Hepatology, 2008, 48(3): 991-1001.[15] ACTONRT, BARTON JC, SNIVELY BM, et al. Geographic and racial/ethnic differences in HFE mutation frequencies in the Hemochromatosis and Iron Overload Screening (HEIRS) Study[J]. Ethn Dis, 2006, 16(4): 815-821.
引证本文:NING HB, HE J, LI JL, et al. A family with hereditary hemochromatosis carrying HFE gene splice site mutation: a case report[J]. J Clin Hepatol, 2017, 33(1): 155-159. (in Chinese) 宁会彬, 何佳, 李俊利, 等. 1例携带HFE基因剪切突变的遗传性血色病患者家系调查[J]. 临床肝胆病杂志, 2017, 33(1): 155-159.
(本文编辑:朱 晶)
读者·作者·编者
A family with hereditary hemochromatosis carrying HFE gene splice site mutation: a case report
NINGHuibin,HEJia,LIJunli,etal.
(DepartmentofInfectiousDiseases,HenanProvincialPeople′sHospital,Zhengzhou450000,China)
Objective To investigate a new type of HFE gene mutation in a family with hereditary hemochromatosis (HH). Methods The analysis of HFE gene was performed for one patient with a confirmed diagnosis of HH and five relatives. Blood genomic DNA was extracted and PCR multiplication was performed for the exon and intron splice sequences of related HFE, HJV, HAMP, transferrin receptor 2 (TfR2), and SLC40A1 genes. After agarose gel electrophoresis and purification, bi-directional direct sequencing was performed to detect mutation sites. Results The proband had abnormal liver function and increases in serum iron, total iron binding capacity, serum ferritin, and transferrin saturation, as well as T→C homozygous mutation in the fourth base of intron 2 in the intervening sequence of the exon EXON2 of HFE gene (IVs 2+4T→C, C/C homozygous, splicing, abnormal). There were no abnormalities in HJV, HAMP, TfR2, and SLC40A1 genes. The proband′s son had the same homozygous mutation, three relatives had heterozygous mutations, and one relative had no abnormal mutations. Conclusion Gene detection plays an important role in the diagnosis of hemochromatosis, and IVs 2+4T→C mutation may be a new pathogenic mutation for HH in China.
hemochromatosis; point mutation; genes, regulator; pedigree
10.3969/j.issn.1001-5256.2017.01.034
2016-08-02;
2016-09-22。
国家临床重点专科建设项目(2013年度);河南省卫生厅科技攻关计划项目基金资助项目(201503171)
宁会彬(1989-),男,主要从事慢性肝病基础和临床研究。
R364.23; R596.3
A
1001-5256(2017)01-0155-05

