拉莫三嗪纳米脂质体的制备及脑靶向作用的研究
· 技术方法 ·
拉莫三嗪纳米脂质体的制备及脑靶向作用的研究
宋 宁1李颖寰2*
(1.首都医科大学药学院药剂学系,北京 100069;2.首都医科大学药学院新药药理学系,北京 100069)
癫痫是一组以大脑神经元异常放电所引起的短暂中枢神经系统功能失常为特征的慢性脑部疾病,具有突发性、反复发作的特点。全球大约1%的人口受癫痫困扰[1],给病人个人、家庭和社会都造成了很大的危害和影响。抗癫痫药物主要用于减轻癫痫发作的频率和程度。拉莫三嗪(1amotrigine,LTG)是苯三嗪类的新一代广谱抗癫痫药物,其抗癫痫谱较广,是治疗特发性全面性发作和部分性发作的一线药物,1991年上市,为口服片剂。拉莫三嗪口服时大部分被肝脏代谢,食物可以影响其吸收[2],治疗时需要逐渐增加药物剂量,引起的皮疹可能发展成为Stevens-Johnson综合征[3],并已发现耐药现象[4]。因此,有必要研究新型药物递送系统,将药物有效递送到病灶部位“脑”,提高抗癫痫药物的疗效,减少不良反应。
由于血脑脊液屏障(blood brain barrier,BBB)和一些生物因素的限制,阻挡了抗癫痫药物进入大脑并维持有效的治疗浓度[5]。另外有部分药物被BBB上的分子外排泵重新泵回到血管内,使抗癫痫药物在脑内的聚积能力下降。脂质体(liposome)是一种类生物膜的磷脂分散在水相中形成的双分子层结构,粒径大小可以从20纳米到几十微米,可作为疏水、亲水以及两亲性药物的载体。脂质体表面可进一步适当修饰,使其作用于特定的靶器官。脂质体具有很高的亲脂性,可通过如被动转运、与脑血管内皮细胞膜发生膜融合或通过内吞途径转运至脑实质。由于脂质体具有在人体内无毒、无免疫原性、可生物降解及缓释等优点而被广泛用作药物的载体[6]。因此本研究拟制备纳米级别的拉莫三嗪纳米脂质体(lamotrigine nano-liposome,LTG-NL),旨在促进药物跨过血脑脊液屏障,增强其抗癫痫的疗效,减少不良反应。
1 材料与方法
1.1 试剂、仪器和实验动物
拉莫三嗪(KS-1074,英国Key Organics公司);卵磷脂(A0346624,美国Acros Organics公司);Sephadex G-50(S8150,中国Solarbio公司);胆固醇(中国Bjkebio公司);吐温80(103170,美国MP Biomedicals公司);氯仿(中国北京现代东方精细化学品有限公司);甲醇(美国Fisher Scientific公司);其他试剂均为分析纯。
超声清洗机(KQ-500E型超声波清洗器,中国昆山市超声仪器有限公司);探头超声仪(Vibra Cell CV18,美国SONICS公司);旋转蒸发仪(Laborota 4000,德国Heidolph Instruments公司);激光纳米粒度仪(ZetaPLUS Analyzer,美国Brookhaven Instruments Corp公司);扫描电子显微镜(JSM-6360LV,日本Jeol公司);透射电子显微镜(JSM-1230LV,日本Jeol公司);高效液相色谱(high performance liquid chromatography, HPLC)仪(Waters e2695,美国Waters公司);C18色谱柱(250 mm×4.6 mm,粒径5 μm,Symmetry公司,美国),组织匀浆器(PR-250,美国Pro公司);离心浓缩仪(CentrlVap,美国Labconco公司)。
ICR小鼠84只,体质量18~22 g,购自北京维通利华实验动物中心[许可证号:SCXK(京)2002-2003]。
1.2 实验方法
1.2.1 拉莫三嗪纳米脂质体的制备
采用薄膜分散法制备,将卵磷脂和胆固醇(摩尔比为5∶1)溶于含5%(体积分数)甲醇的氯仿液,按照质量比为1∶10的药脂比加入LTG,在旋转蒸发仪上旋膜后,真空干燥器内过夜,然后用含吐温80的磷酸盐缓冲液(PBS,pH7.4)水合30 min,探头超声5 min,最后得到带乳光的混悬液,4 ℃保存备用。以粒径和外观(有无沉淀)为指标,考察膜材中卵磷脂与胆固醇的比例、药脂比及吐温的量对脂质体放置15 d稳定性的影响,筛选LTG-NL的最优处方。
1.2.2 拉莫三嗪纳米脂质体的物理学表征
LTG-NL用PBS稀释10倍后,采用激光纳米粒度仪测定其粒径;LTG-NL样品用蒸馏水稀释,将稀释的样品滴20 μL于盖玻片上,37 ℃烘干后,喷金,进行扫描电镜观察。取10 μL稀释的样品置于铜网表面,下衬滤纸,37 ℃烘干后,固定电镜电子束电压为80 kV,移动坐标,调节放大倍数,进行透射电镜观察。
1.2.3 拉莫三嗪纳米脂质体中药物测定方法的确立
1)色谱条件:采用HPLC法,分析柱为C18色谱柱,流动相为甲醇∶5 mmol·L-1磷酸二氢钠溶液(体积比为40∶60;pH6.25),柱温30 ℃,流速1.0 mL·min-1,检测波长230 nm,进样量10 μL,测定LTG-NL中的药物。
2)标准曲线的建立和精密度、回收率的考察:精密称取LTG 10 mg,用甲醇定容至10 mL,配制成储备液。稀释储备液得到终质量浓度分别为0.5、1、2、4、8、10、16、20、24、32、40 μg·mL-1的标准溶液,HPLC检测,以峰面积(A)为纵坐标,样品质量浓度(C)为横坐标,线性回归,绘制标准曲线。将储备液配成低、中、高3个质量浓度(2、10、20 μg·mL-1)的标准溶液,HPLC检测,早、中、晚各测1次,连续检测3 d,计算日内精密度、日间精密度和回收率。
1.2.4 拉莫三嗪纳米脂质体包封率的测定
1)葡聚糖凝胶柱回收率的测定:将Sephadex G-50葡聚糖凝胶浸泡在蒸馏水中,溶胀过夜,湿法填柱,柱高17 cm,内径1 cm,用蒸馏水洗脱平衡,分别取0.5、0.8、1.0 mL 3个剂量的LTG-NL各2份,其中第一份过凝胶柱接取90 mL洗脱液,用甲醇破乳并定容至100 mL,HPLC检测药物质量浓度得C1;第二份直接加甲醇破乳并定容至100 mL,检测药物质量浓度得C2,C1/ C2即为回收率。
2)包封率的测定:于葡聚糖凝胶柱加样LTG-NL 0.5 mL,用蒸馏水洗脱,流速为1.5 mL·min-1,用EP管接收洗脱液,每管2 mL,分别用甲醇稀释10倍破乳,0.45 μm微孔滤膜过滤后,检测药物质量浓度。另取LTG-NL 0.5 mL,直接加甲醇破乳后测定其中LTG为脂质体中的药物总量,按下式计算药物包封率:包封率=(脂质体中包封的药物量/药物总量)×100%。
1.2.5 拉莫三嗪纳米脂质体小鼠体内药物动力学及组织分布实验
1)组织萃取方法:将84只ICR小鼠采用随机数字表法分成2组(LTG组和LTG-NL组,n=6),编号称体质量,实验前禁食不禁水,然后分别腹腔注射给予等量的LTG混悬液和LTG-NL液,剂量为8 mg·kg-1,分别于注射后15、30、60、90、120、180、240 min各时间点摘除小鼠眼球取血,置于抗凝管中,离心3 000 r/min,10 min,取上清液200 μL,加入400 μL甲醇,涡旋混匀,离心10 000 r/min,10 min后,取上清500 μL,浓缩干燥,加入200 μL甲醇复溶,0.45 μm微孔滤膜过滤,进样,HPLC检测。取血后立即处死动物,取出脑组织,精密称质量,加入pH7.4的PBS液匀浆(组织质量∶PBS体积=1∶4),离心6 000 r/min,10 min,取上层离心液200 μL,加入400 μL甲醇,涡旋混匀,离心10 000 r/min,10 min后,取上清500 μL,浓缩干燥,加入200 μL甲醇复溶,0.45 μm微孔滤膜过滤,进样,HPLC检测,色谱条件同含量测定。
2)方法学验证:精密移取2.3.2项下的LTG储备液,加入空白血浆或脑组织匀浆液,稀释后得到LTG终质量浓度为0.25、0.5、1、2、4、8、10、16、20、24、32、40 μg·mL-1的溶液,同实验方法项下操作,HPLC进样,以峰面积(A)为纵坐标,样品质量浓度(C)为横坐标,绘制标准曲线。取低、中、高3个浓度(LTG质量浓度分别为2、10、20 μg·mL-1)的血浆及各组织标准品溶液,同实验方法项下操作,HPLC进样,早、中、晚各测1次,连续检测3 d,计算日内精密度、日间精密度及方法回收率。
用甲醇稀释LTG储备液,分别得到2、10、20 μg·mL-13个质量浓度的LTG标准品溶液,HPLC检测,得到LTG纯标峰面积;然后将这3个质量浓度的标准品溶液加入到空白血浆或各组织匀浆液中,混匀后同实验方法项下操作,得到LTG血浆或组织峰面积,以(血浆或组织峰面积/纯标峰面积)计算萃取回收率。
1.2.6 脑靶向作用评价
依据文献[7]创建的一级消长型公式和广义零级消长型公式,采用基于非线性最小二乘法的高斯-牛顿迭代法拟合出小鼠脑中拉莫三嗪的最适质量浓度方程,并绘制拟合曲线。
其中T为零级释药时间,k1代表曲线上升段速率常数,k2代表T时间后曲线下降段速率常数。
依据对数梯形法则计算质量浓度-时间曲线下面积(area under curve,AUC),计算靶向效率(targe efficiency,TE)和靶向指数(target index,TI),公式如下,评价脑靶向作用。
1.3 统计学方法
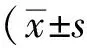
2 结果
2.1 拉莫三嗪纳米脂质体处方筛选
采用单因素考察法,考察了固定药脂比条件下,不同摩尔比的卵磷脂与胆固醇对脂质体的粒径和稳定性(外观有无沉淀)的影响(表1)。可以看出,当药脂比为1∶25时,制备的脂质体粒径和稳定性均较好;药脂比为1∶20时,卵磷脂与胆固醇摩尔比为5∶1的LTG-NL稳定性较好。固定卵磷脂与胆固醇的摩尔比为5∶1,比较了不同药脂比对脂质体的粒径和稳定性的影响,结果显示增大药脂比为1∶15和1∶10后LTG-NL的稳定性仅为1 d,随即发生沉淀(表2)。继续在处方中加入吐温80,改善制剂稳定性,分别比较了处方中不同吐温80对LTG-NL粒径和稳定性(外观有无沉淀)的影响(表3),结果发现吐温80的加入显著降低了脂质体的粒径,当药脂比为1∶15时,加入0.5%~2%的吐温80制备的脂质体粒径和稳定性均较好;当药脂比提高到1∶10时,加入2%的吐温80得到的脂质体稳定性较好,可达到14 d。考虑到提高药脂比有利于降低成本,确定LTG-NL的处方为药脂比为1∶10,卵磷脂与胆固醇的摩尔比为5∶1,吐温80为2%,得到LTG质量浓度为1 mg·mL-1、脂质质量浓度为10 mg·mL-1的LTG-NL。

表1 磷脂与胆固醇比例对脂质体粒径和稳定性的影响

表2 药脂比对脂质体粒径和稳定性的影响

表3 磷脂与胆固醇比例为5∶1时药脂比和吐温80的比例对脂质体粒径和稳定性的影响
2.2 拉莫三嗪纳米脂质体的物理表征
LTG-NL的平均粒径为(51.56±1.21)nm,粒径小且分布窄(图1);扫描电镜和透射电镜下LTG-NL呈球形,粒径大小均匀,与粒径测定结果一致(图2)。
2.3 拉莫三嗪纳米脂质体测定结果
HPLC检测结果显示拉莫三嗪的出峰时间为9.7 min,在0~40 μg·mL-1质量浓度范围内线性关系良好,回归方程A=34547C-2819,R2=0.999 9。日内精

图1 拉莫三嗪纳米脂质体粒径分布
LTG-NL:lamotrigine nano-liposome.

图2 拉莫三嗪纳米脂质体在扫描电镜和透射电镜下的形态图
SEM:scanning electron microscope; TEM:transmission electron microscope;LTG-NL:lamotrigine nano-liposome.
密度RSD值为0.73%~1.72%,日间精密度相对标准偏差(relative stand deviation,RSD)值为1.59%~2.22%;回收率测定的平均值为98.42%,RSD值为0.53%~1.03%,均符合方法学要求。
2.4 拉莫三嗪纳米脂质体的包封率测定结果
葡聚糖凝胶柱回收率为93.34%~99.22%,符合方法学要求。用该法测定LTG-NL的包封率时,接收液在约第26~38 mL处为脂质体部分,在第52~54 mL处为游离药,洗脱曲线详见图3,按公式计算LTG-NL的包封率为(91.33±0.8)% (n=3)。
2.5 拉莫三嗪纳米脂质体小鼠体内药物动力学及组织分布
方法学研究结果显示脑组织中杂质峰不干扰LTG的测定,血浆及脑组织HPLC检测结果显示拉莫三嗪在0~40μg·mL-1质量浓度范围内线性关系良好,萃取回收率平均值为80.3%,日内精密度、日间精密度和方法回收率,均符合方法学要求。
图4为给药后小鼠血浆和脑组织的药物分布动力学散点图,显示LTG-NL组的血药浓度-时间曲线明显高于LTG组,在脑中的分布量显著高于LTG组;LTG-NL组在1~3 h脑组织中的药物浓度基本持平,远远高于LTG组,析因方差分析统计结果显示血浆药物浓度和脑组织药物浓度的主效应均为P<0.01,说明应用LTG和LTG-NL后两者的血浆药物浓度和脑组织药物质量浓度差异有统计学意义。由此可见,相较于LTG组,LTG-NL组可以显著延长LTG在脑组织的作用时间。

图3 拉莫三嗪纳米脂质体包封率测定的洗脱曲线
2.6 小鼠脑靶向作用评价
图5显示了脑组织中游离LTG组和LTG-NL组的药物质量浓度经时变化拟合曲线,2组的最适质量浓度方程均为广义零级消长型公式,可以看出拟合曲线基本通过实测点,拟合结果良好。LTG组和LTG-NL组的拟合参数A(6.6vs8.0),k1(8.6vs7.0)和k2(0.2vs0.3)均在同一个数量级,体现为2组制剂在脑组织中的经时曲线的上升段和下降段斜率基本相同,平台期的零级释药时间T值在LTG-NL组为3.1 h,远大于游离LTG组的0.9 h,显示LTG-NL显著延长了药物在脑组织的驻留时间,具有较好的脑靶向治疗作用。表4中列出了相应的AUC值,据此分别计算得到靶向参数TE和TI,LTG组的TE仅为0.9,而LTG-NL组的TE为1.1(大于1),说明LTG-NL输送到脑组织中的药物量超过了血浆药物量,显著提高了LTG 在脑组织的质量浓度,具有脑靶向性;靶向指数TI值显示LTG-NL组在脑的AUC值是LTG组的1.5倍,表明LTG-NL具有明显的脑靶向性。
3 讨论
拉莫三嗪是治疗部分性发作癫痫的主要药物,但是近年来临床上出现了对拉莫三嗪耐药的难治性癫痫病人,如果仅靠加大药物剂量,则不可避免地会出现药物的毒性作用。研究[5]显示,耐药的原因为血脑脊液屏障上的多药转运蛋白通过其外排泵的功能,将多种抗癫痫药物泵出血脑脊液屏障外,使药物难以到达脑内作用靶区,癫痫发作不能被有效控制。因此,科学家们开始从药剂学方面寻求解决办法。已有文献报道卡马西平固体脂质纳米粒[8]和乙琥胺壳聚糖纳米粒[9]的制备。本实验结果显示,LTG-NL能够很好地将LTG转运入脑,表明纳米脂质体可作为LTG良好的药物传递系统。采用薄膜分散法制备LTG-NL的方法简单,得到的LTG-NL粒径小、分布均匀。在脂质体的处方中加入表面活性剂吐温80,一方面可以改善难溶性药物与脂质成分的相容性,减少脂质体的沉淀,提高脂质体的包封率和稳定性,同时吐温80促进脂质体透过血脑脊液屏障进入脑内[10];另一方面,文献[10]显示吐温80兼有聚乙二醇柔性的特点,制备得到的柔性纳米脂质体由于吐温80在脂质体表面形成立体位阻屏障,在血液中不易被血浆蛋白识别、摄取,从而有效提高了到达靶组织的药物量。另有文献[11]报道吐温80可抑制血脑脊液屏障的P糖蛋白,从而抑制药物的外排,增加脑内药物的质量浓度。本实验结果显示,LTG-NL组小鼠脑内药物质量浓度呈现拟零级的释放动力学过程,零级释药时间T值为3.1 h(LTG组仅为0.9 h),AUC值也为LTG组的1.5倍,靶向效率TE值为1.1,显著延长了脑中药物的质量浓度和作用时间。因此,LTG-NL是一种具有发展前景的脑靶向递药系统。

图4 小鼠腹腔注射拉莫三嗪混悬液和拉莫三嗪纳米脂质体8 mg·kg-1后血浆及脑组织中拉莫三嗪的药时曲线图
LTG:lamotrigine; LTG-NL:lamotrigine nano-liposome.

图5 拉莫三嗪混悬液和拉莫三嗪纳米脂质体给药后>小鼠脑内拉莫三嗪浓度拟合曲线
Dots represent experimental data (n=6) and lines represent best-fit curves.LTG:lamotrigine; LTG-NL:lamotrigine nano-liposome.

表4 拉莫三嗪混悬液和拉莫三嗪纳米脂质体用药后小鼠血浆及脑药时曲线下面积
AUC:area under ROC curve;LTG:lamotrigine; LTG-NL:lamotrigine nano-liposome.
[1] Baum L, Kwan P. Antiepileptic drug delivery [J]. Adv Drug Deliv Rev, 2012, 64(10):885-886.
[2] Bennewitz M F, Saltaman W M. Nanotechnology for delivery of drugs to the brain for epilepsy [J].Neurotherapeutics, 2009, 6(2):323-336.
[3] Potschka H. Role of CNS efflux drug transporters in antiepileptic drug delivery: overcoming CNS efflux drug transport [J].Adv Drug Deliv Rev, 2012, 64(10):943-952.
[4] Srivastava A K, White H S. Carbamazepine, but not valproate, displayspharmacoresistance in lamotrigine-resistantamygdala kindled rats [J].Epilepsy Res, 2013,104(1-2): 26-34.
[5] Mishra B,Arya N, Tiwari S. Investigation of formulation variables affecting the properties of lamotriginenanosuspension using fractional factorial design [J]. DARU, 2010, 18 (1):1-8.
[6] Soni V, Chourasia M K, Gupta Y, et al. Novel approaches for drug delivery to the brain [J]. Indian J Pharm Sci, 2004, 66(6):711-720.
[7] 李颖寰, 朱家壁,陈盛君,等. 组合小片胶囊释放行为的研究及其数学模型嵌合[J]. 药学学报,2004, 39(6):472-476.
[8] Nair R, Kumar A C, Priya V K, et al. Formulation and evaluation of chitosan solid lipidnanoparticles of carbamazepine [J].Lipids Health Dis, 2012, 11:72-79.
[9] Hsiao M H,Larsson M,Larsspon A, et al.Design and characterization of a novel amphiphilic chitosan nanocapsule-basedthermo-gelling biogel with sustained in vivo release of the hydrophilic anti-epilepsy drug ethosuximide [J].J Control Release, 2012, 161(3):942-948.
[10]管晨峰, 路伟,张开礼,等. 载神经生长因子纳米柔性脂质体透血-脑屏障的研究[J]. 中国医药导报, 2014, 11(17): 131-133.
[11]Pinzon-Daza M L,Campia I,Kopecka J, et al. Nanoparticle- and liposome-carried drugs: new strategies for active targeting and drug delivery across blood-brain barrier [J]. Curr Drug Metab, 2013, 14(6):625-640.
编辑 孙超渊
癫痫病临床医学研究北京市重点实验室开放课题资助项目(2014DXBL01)。This study was supported by Opening Foundation of Beijing Key Laboratory of Epilepsy(2014DXBL01).
时间:2017-01-17 23∶21
http://www.cnki.net/kcms/detail/11.3662.R.20170117.2321.006.html
10.3969/j.issn.1006-7795.2017.01.024]
2016-06-15)
*Corresponding author, E-mail:huan694@163.com

