卡巴他赛脂质体制备、质量控制及稳定性研究
张海军,王英杰,刘留成
卡巴他赛脂质体制备、质量控制及稳定性研究
张海军,王英杰,刘留成
目的 通过不同方法制备卡巴他赛脂质体,建立其质量控制方法并考察其稳定性。 方法 将氢化大豆磷脂酰胆碱(HSPC)、PEG2000-DSPE及卡巴他赛以质量比为100∶5∶8,通过不同制备工艺制备脂质体。采用低速离心法测定包封率,动态光散射法测定粒度分布,气相色谱法测定有机溶剂残留。 结果 脂质体平均粒径为(155±5)nm,多项分散系数(PdI)均小于0.20;脂质体包封率均大于95.0%;所制得样品于25 ℃±2 ℃条件下放置6个月,各项考察指标均未发生明显变化。结论 采用制备工艺3所制得的样品具有较高的药脂比,该制剂处方工艺可行,质量可控,稳定性良好;体外释放曲线表明脂质体有缓释、靶向及长效作用。
卡巴他赛;脂质体;制备;质量控制;稳定性
前列腺癌是男性常见恶性肿瘤,常发病于老年男性(美国NCI定义),它在美国是除皮肤癌之外第二大常见男性癌症。据疾病防控中心最新统计,2013年美国约有238 590例男性患前列腺癌,其中29 720例因此而死亡。卡巴他赛注射液经美国FDA优先审评后获得批准用于转移性激素难治性前列腺的二线治疗药物,该药物在二线治疗中是首个也是唯一一个提供显著生存获益的治疗药物。卡巴他赛注射液用于与泼尼松联合治疗既往接受过含卡巴他赛方案治疗的转移性激素难治性前列腺癌病人[1-2]。
目前,卡巴他赛只有普通注射液上市,为了改善卡巴他赛的水溶性,在处方中加入吐温-80,在临床配伍中加入13%乙醇专用溶剂,在临床使用过程中出现严重的过敏反应,如中性粒细胞减少、贫血、白细胞减少、腹泻等[3-4]。因此该药不能用于治疗对卡巴他赛或吐温-80有严重超敏史的病人,另外,大于65岁的人群用药风险会大于收益。为了避免组合溶剂和吐温-80的使用,降低药物的毒副作用,本研究把卡巴他赛包裹于磷脂双分子层内,将其制成脂质体,所使用的辅料为人体细胞膜组成成分磷脂,大大降低了卡巴他赛普通注射液的毒副作用,提高病人的顺应性[5]。
1 材料与方法
1.1 仪器 岛津高效液相色谱仪系统包括LC-20ATvp泵,SPD-20Avp紫外检测器,LCsolution色谱工作站;EF-C3型高压挤出仪(奥维斯汀公司); S-3400NⅡ扫描电子显微镜(日本Hitachi);CAD4/PC单晶X射线衍射仪(荷兰Enraf Noius公司);Nano-ZS型激光粒度测定仪(英国马尔文公司);PHS-3C型精密数显pH计(上海精科);303-1电热培养箱(江苏东台仪器厂)。
1.2 试药 注射用卡巴他赛脂质体(规格:每瓶20 mg,批号:121101、121102、121103)由江苏奥赛康药业股份有限公司提供,α-生育酚(批号:BY6JC,东京化成工业株式会社),FA-PEG2000-DSPE(批号:100801,公司自制)、氢化磷脂酰胆碱(HSPC,批号:256277,德国Lipoid公司),葡萄糖(批号:201210031,山东祥瑞药业有限公司),磷酸氢二钠(批号:100901,湖南华纳药业有限公司),磷酸二氢钠(批号:100906,湖南华纳药业有限公司),甲醇、乙醇(色谱级,美国天地试剂公司);三氯甲烷(色谱级,美国ACROS公司);注射用水(自制)。
1.3 方法
1.3.1 注射用卡巴他赛脂质体的制备工艺1 精密称取质量比为100∶5∶8的HSPC、PEG2000-DSPE及卡巴他赛溶解于适量叔丁醇中,冷冻干燥24 h后,得脂质混合物,用PBGS缓冲液充分水化脂质混合物,高压均质(1 500bar)5次,过0.4 μm聚碳酸酯膜去除未包裹的游离卡巴他赛,55 ℃过0.1 μm聚碳酸酯膜2次整粒,将卡巴他赛脂质体分装于西林瓶中,冷冻干燥得注射用卡巴他赛脂质体(批号:121101)。
洗脱液即PBGS缓冲液组成:精密称取葡萄糖(Mw=180.16)486.1 g,加入已冷却的注射用水7.2 L使溶解,并定容至9 L;取出上述葡萄糖溶液6 L,加入磷酸氢二钠十二水合物(Mw=358.14)10.744 g,搅拌使溶解;剩余葡萄糖溶液3 L,加入磷酸二氢钠二水合物(Mw=156.01)4.680 g,搅拌使溶解;两相逐步混合,调节最终溶液的pH值为7.0,即得PBGS缓冲液。
1.3.2 注射用卡巴他赛脂质体的制备工艺2 精密称取质量比为100∶5∶8的HSPC、PEG2000-DSPE及卡巴他赛溶解于适量乙醇-氯仿(体积比为1∶2)中,此为油相溶液。将适量PBGS缓冲液加温至45 ℃,乳化剂搅拌(3500 r/min),将油相溶液缓慢滴入其中,控制油水相比为2%(V/V),继续乳化15 min,该乳状液继续搅拌(500 r/min)12 h去除大部分有机溶剂,高压均质(1 500bar)5次,过0.4 μm聚碳酸酯膜去除未包裹的游离卡巴他赛,55 ℃过0.1 μm聚碳酸脂膜2次整粒,将卡巴他赛脂质体分装于西林瓶中,冷冻干燥得注射用卡巴他赛脂质体(批号:121102)。
1.3.3 注射用卡巴他赛脂质体的制备工艺3 精密称取质量比为100∶8的HSPC、卡巴他赛溶解于适量乙醇-氯仿(体积比为1∶2)中,此为油相溶液。将适量PBGS缓冲液加温至45 ℃,乳化剂搅拌(3500 r/min),将油相溶液缓慢滴入其中,控制油水相比为2%(V/V),继续乳化15min,该乳状液继续搅拌(500 r/min)12 h去除大部分有机溶剂,高压均质(1 000bar)5次,过0.4 μm聚碳酸酯膜去除未包裹的游离卡巴他赛,加入5份PEG2000-DSPE于此乳状液中,60 ℃孵化(搅拌速度300 r/min)20 min,孵化好的药业于55 ℃过0.1 μm聚碳酸酯膜2次整粒,将卡巴他赛脂质体分装于西林瓶中,冷冻干燥得注射用卡巴他赛脂质体(批号:121103)。
2 结 果
2.1 分散时间 将上述各制备工艺所得的卡巴他赛脂质体各1瓶,加纯化水10 mL,轻轻振摇,在15 min内完全分散均匀,无未分散的固体物。
2.2 粒度及粒度分布、Zeta电位的测定 将上述各制备工艺所得的卡巴他赛脂质体各1瓶,加纯化水10 mL使内容物分散均匀,作为供试品溶液。取供试品溶液20 μL至洁净的聚苯丙乙烯比色杯中,加纯化水980 μL,轻摇混匀,排除气泡,放入仪器检测室内,按照中国药典2010年版二部附录Ⅸ E中的有关规定,用动态光散射法,用Nano-ZS Malvern纳米粒度仪测定样品粒度和粒度分布。
卡巴他赛脂质体粒径测定结果显示:制备工艺1未冷冻干燥前样品[平均粒径为133.5 nm,D(10)91.0 nm,D(50)143 nm,D(90)228 nm,PdI为0.109];制备工艺1[平均粒径为152.3 nm,D(10)92.9 nm,D(50)160 nm,D(90)280 nm,PdI为0.164];制备工艺2[平均粒径为158.9 nm,D(10)100 nm,D(50)170 nm,D(90)294 nm,PdI为0.175];制备工艺3[平均粒径为160.0 nm,D(10)102 nm,D(50)169 nm,D(90)287 nm,PdI为0.177]。详见图1~图4。
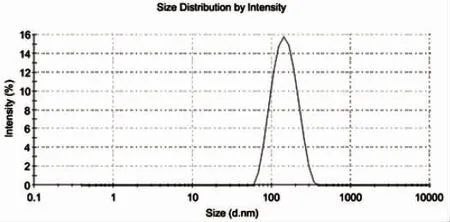
图1 卡巴他赛脂质体粒度及粒度分布图(未冻干)
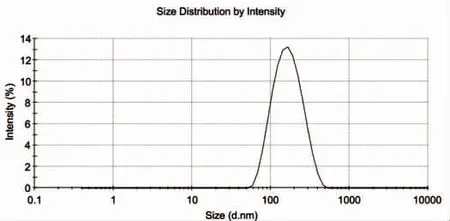
图2 卡巴他赛脂质体粒度及粒度分布图(制备工艺1)
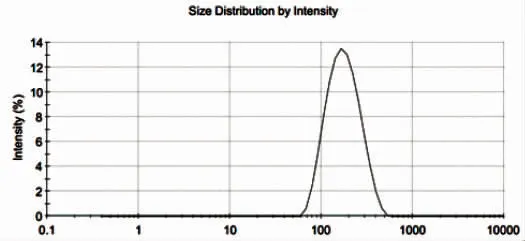
图3 卡巴他赛脂质体粒度及粒度分布图(制备工艺2)
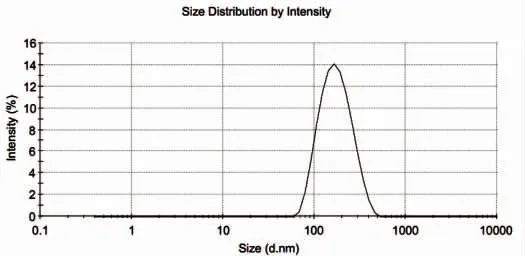
图4 卡巴他赛脂质体粒度及粒度分布图(制备工艺3)
精密移取980 μL供试品溶液至洁净的聚苯丙乙烯U形管中,在加注样品过程中避免有气泡进入U形管内,放入仪器检测室内,按照中国药典2010年版二部附录Ⅸ E中的有关规定,用Nano-ZS Malvern纳米粒度仪测定样品Zeta电位。制备工艺1 Zeta电位为-8.47 mV;制备工艺2 Zeta电位为-9.13 mV;制备工艺3 Zeta电位为-5.42 mV。
2.3 残留溶剂测定
2.3.1 色谱条件 色谱柱:100%聚二甲基硅氧烷为固定相的毛细管柱(60 m×0.32 mm,5 μm);程序升温:70 ℃保持10 min,以每分钟20 ℃的速度升温至200 ℃,保持15 min;以氮气为载气,流速1.7 mL/min;进样口温度:150 ℃;检测器(FID)温度:250 ℃;采用顶空进样法,顶空瓶加热温度:85 ℃,传输管温度:115 ℃,平衡时间20 min。制备6份对照品溶液,分别进样,无水乙醇和三氯甲烷峰面积的标准偏差均小于15%。
2.3.2 测定法 取水1 995 mL,置2 000 mL量瓶中,加入无水乙醇(20 ℃,相对密度为0.789)1.26 mL与三氯甲烷(20 ℃,相对密度为1.484)40 μL,加水稀释至刻度,磁力搅拌30 min,精密量取10 mL,置100 mL量瓶中,加水稀释至刻度,摇匀,精密量取5 mL,置顶空进样瓶中,作为对照品溶液;另精密称取本品0.25 g,置顶空进样瓶中,精密加入水5 mL,作为供试品溶液;分别取供试品溶液和对照品溶液,顶空进样1 min,注入气相色谱仪,记录色谱图,按外标法以峰面积计算,供试品中含无水乙醇不得过0.1%,含三氯甲烷不得过0.006%。制备工艺1未检出乙醇及三氯甲烷残留;制备工艺2:乙醇残留为0.08%,三氯甲烷残留为0.005%;制备工艺3:乙醇残留为0.09%,三氯甲烷残留为0.005%。均符合标准规定。
2.4 包封率测定
2.4.1 色谱条件 色谱柱:用十八烷基键合硅胶为填充剂(Waters Symmetary C18 5 μm 250×4.6 mm);流动相:乙腈-甲醇-水(47∶30∶23);检测波长230 nm;自动进样器温度(5±3)℃,针头洗液为流动相;进样体积20 μL;流速1.0 mL/min;卡巴他赛对照品溶液连续进样6针,相对标准偏差不大于2.0%。
2.4.2 包封率测定 对于卡巴他赛脂质体包封率测定常用方法为葡聚糖凝胶法和低速离心法,经过验证后发现,上述两者方法测定结果相似,但低速离心法操作简单,鉴于此,选择低速离心法进行样品包封率测定。取卡巴他赛脂质体各1瓶,用10 mL纯化水溶解,得供试品溶液,该溶液于锥形离心管中,3 500 r/min离心10 min,取上清液0.4 mL,置于10 mL量瓶中,加入甲醇充分破乳,定容后用HPLC法进行检测,确定脂质体中卡巴他赛含量(见图5)。脂质体溶液中卡巴他赛总量的测定:取卡巴他赛脂质体溶液0.4 mL,置于10 mL量瓶中用甲醇破坏后定容,然后进行HPLC检测。
包封率采用下列计算公式进行计算。根据本品含量及未包封的卡巴他赛浓度计算包封率(中国药典2010年版二部附录XIX E),三种制备工艺所得样品包封率均高于95.0%。计算公式为:
包封率 = (系统中包封与未包封的总药量-液体介质中未包封的药量)/系统中包封与未包封的总药量×100%
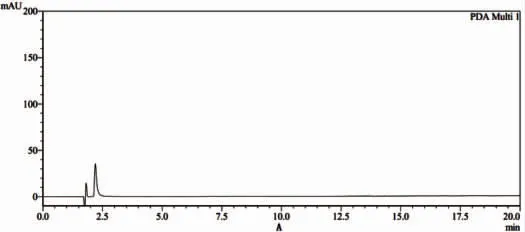
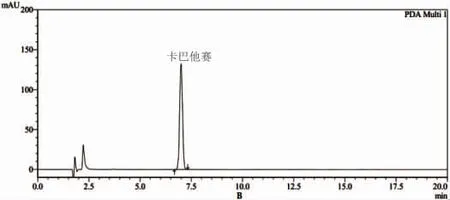
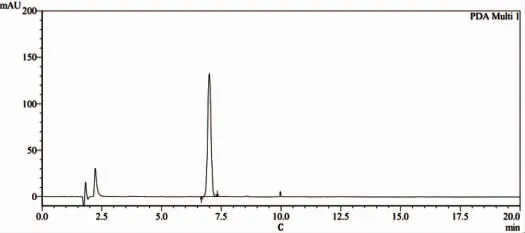
注:A为空白溶剂(甲醇);B为对照品溶液;C为样品溶液。
图5 卡巴他赛脂质体含量测定图
2.5 稳定性考察 取制备工艺3制备的卡巴他赛脂质体在25 ℃±2 ℃条件下放置1个月、2个月、3个月、6个月,考察脂质体粒度及粒度分布、含量、包封率的变化情况,结果显示,6个月内,脂质体外观性状良好,上述各项考察指标没有明显变化,各项检测结果见表1。
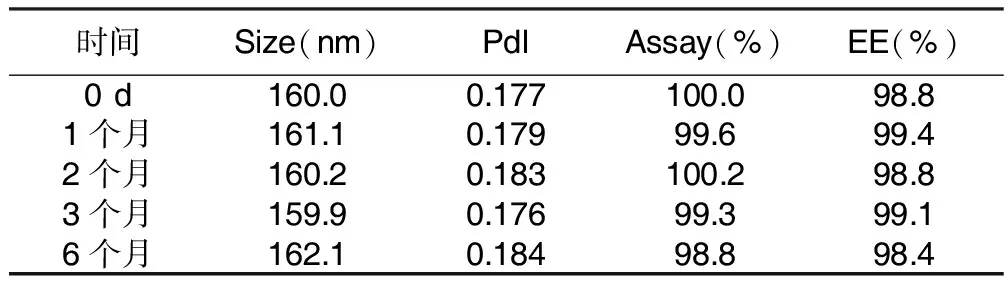
表1 卡巴他赛脂质体长期稳定性考察实验结果
3 讨 论
3.1 制备工艺3所得卡巴他赛脂质体药脂比最高 制备工艺1药脂比为0.05,制备工艺2药脂比为0.07,制备工艺3药脂比为0.08,原因是因为制备工艺3通过水包油技术充分让卡巴他赛进入磷脂双分子层内及磷脂双分子层之间,通过搅拌过夜可以除去绝大部分脂质体内外的乙醇-氯仿溶剂,卡巴他赛在磷脂双分子内部以无定型(高度凝聚状态)存在,在贮藏过程中不易泄露,可以提高产品的放置稳定性。本研究采用后
插入技术,通过孵化的方式接入PEG2000-DSPE,充分释放了磷脂双分子层之间的空间,让其装载更多的卡巴他赛于磷脂双分子层内。尝试了在处方中加入胆固醇[6],因为胆固醇能够起到双相调节磷脂双分子的目的,当加入10%(W/W)胆固醇时,卡巴他赛脂质体的药脂比明显降低,可能是因为胆固醇占据了磷脂双分子层的空间,从而竞争性地抑制了卡巴他赛进入磷脂双分子层内。本研究也尝试了在处方中直接加入PEG2000-DSPE,当加入5%(W/W)PEG2000-DSPE时,卡巴他赛脂质体的药脂比明显降低,可能是因为PEG2000-DSPE占据了磷脂双分子层的空间,从而竞争性地抑制了卡巴他赛进入磷脂双分子层内。
3.2 卡巴他赛脂质体冻干粉水分的控制 卡巴他赛脂质体制备成冻干制剂的目的是为了更好地保障制剂的稳定性,研究者经过大量的冻干曲线摸索,卡巴他赛脂质体冷冻干燥步骤的冻干曲线为预冻温度-40 ℃,预冻时间为3 h;-15 ℃保温 5 h; 5 ℃保温6 h;20 ℃保温8 h;25 ℃保温4 h。
冻干过程中最主要的关键质量属性是必须保证最终样品的含水量。样品中含有2%~5%水分,因为水分太低,会导致磷脂双子层结构的破坏,在复溶过程中样品粒径变大,游离药物增加明显,水分太高,样品在贮藏过程中稳定性差,样品杂质个数及杂质量增加明显,故为了保证产品的安全有效性,我们控制样品中含有2%~5%水分。
3.3 通过X射线粉末衍射、扫描电镜检查进一步确认卡巴他赛完全包裹于磷脂双分子层内 对制备工艺3所得产品进行X射线粉末衍射、扫描电镜检查,X射线粉末衍射的参数起始角3、终止角50、靶型:Cu、气流管压:40 kV40 mA、狭缝:2/4/0.5/0.2;扫描电镜参数为20.0 kV 9.7 mm×1.00 k SE。从图6~图8中可以看出,三种制备工艺所得产品的XRD图中都没有明显卡巴他赛的特征衍射峰,说明在脂质体纳米粒中,卡巴他赛均包裹于磷脂双分子层之间或磷脂双分子层内部;从扫描电镜图可以看出,卡巴他赛均以非晶形的无定形薄片状存在,而这一状态有利于其在复溶过程中,由于其自身张力作用,自发形成纳米脂质微球,也更利于生物利用。3.4 脂质体制剂具有缓释、靶向、长循环效果的意义 卡巴他赛脂质体与普通制剂、普通脂质体相比,在体外呈现一定的缓释作用,具有长循环功效。为临床使用提供了可靠的质量评定方法,对临床降低卡巴他赛毒副作用,可以显著提高治疗指数,提高肿瘤病人的耐受性方面等方面均具有重要意义,是非常具有开发前景的药物[8]。
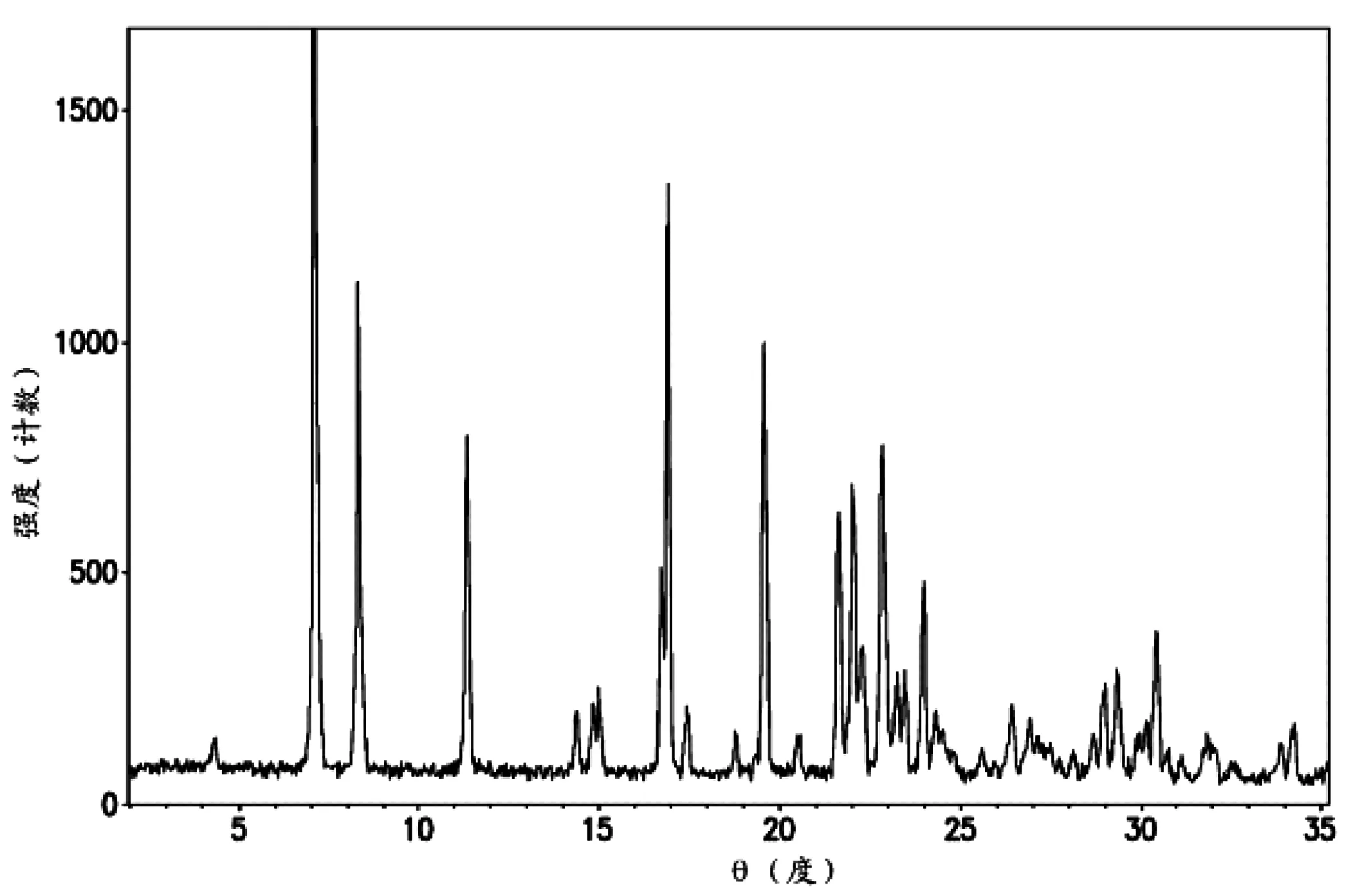
图6 卡巴他赛X射线粉末衍射图[7]
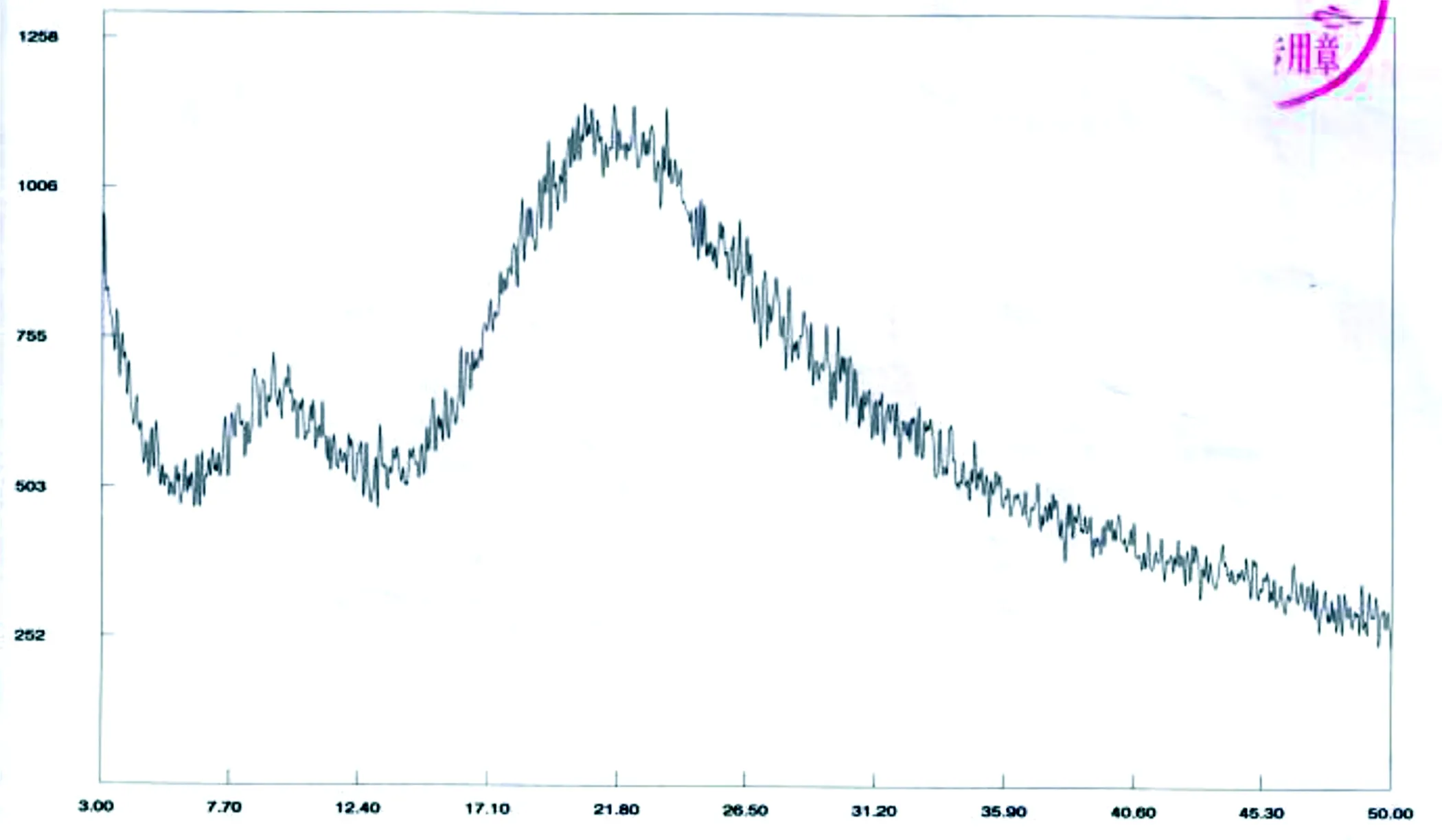
图7 卡巴他赛脂质体X射线粉末衍射图(制备工艺3)

图8 卡巴他赛脂质体扫描电镜图(制备工艺3)
[1] de Bono JS,Oudard S,Ozguroglu M,et al.Prednisone plus cabazitaxel or mitoxantron for metastatic castration-resistant prostate cancer progressing after docetaxel treatment:a randomized open-label trial [J].The Lancet,2010,376(9747):1147-1154.
[2] Paller CJ,Antonarakis ES.Cabazitaxel:a novel second-line treatment for metastatic castration-resistant prostate cancer [J].Drug Des Devel Ther,2011,5:117-124.
[3] Bouchet BP,Galmarini CM.Cabazitaxel,a new taxane with favorable properties [J].Drug Today (Barc),2010,46 (10):735-742.
[4] Anna Lydon.Cabazitaxel side effects:prevention and management [J].British Journal of Medical and Surgical Urology,2011,4(1):S21-S27.
[5] Allen TM,Martin FJ.Advantages of liposomal delivery systems for anthracyclines [J].Seminars in Oncology,2004,31(13):5-15.
[6] Ohvo-Rekila H,Ramstedt B.Cholesterol interactions with phospholipids in membrances [J].Progress in Lipid Research,2002,41(1):66-97.
[7] Svenson S.Clinical translation of namomedicines[J].Current Opinion in Solid State and Materials Science,2012,12(6):287-294.
[8] Delplace V,Couvreur P,Nicolas J.Recnet trends in the design of anticancer polymer prodrug namocarriers [J].Polymer Chemistry,2013, 5(5):1529-1544.
(本文编辑郭怀印)
江苏省盐城市第三人民医院(江苏盐城224000)
戴月华,E-mail:tqpaeb5738784@126.com
R737.25
A
10.3969/j.issn.1672-1349.2017.07.011
1672-1349(2017)07-0805-04
2016-10-23)
引用信息:张海军,王英杰,刘留成,等.卡巴他赛脂质体制备、质量控制及稳定性研究[J].中西医结合心脑血管病杂志,2017,15(7):805-808.

