“常见的酸”中考试题归类评析
陆桂斌
摘 要:有关“常见的酸”中考试题设计多围绕酸的特性和用途、化学通性、溶液中特征微粒性质、与金属反应时的质量关系和反应速度、中和反应实质等重要考点予以展开,结合典型试题,剖析其命题思想、结构特点,归纳其知识体系、解题策略,提高学生学习效率和解题能力.
关键词:常见的酸;中考试题;评析
常见的酸是初中化学重要的一类化合物,历年各地中考有关“常见的酸”的试题呈现形式不断翻新,但考查重点几乎没有变化,本文拟结合典型中考(竞赛)试题予以示例分析.
一、考查常见酸的物理性质、特性、用途等
例1 (2016年广西贺州)盐酸、硫酸是常见的两种酸.
①打开装浓盐酸的试剂瓶时,瓶口出现白雾,说明浓盐酸具有性.
②用水稀释浓硫酸时,并用玻璃棒不断搅拌即可.
评析 这类试题侧重对“常见的酸”基础知识的考查,考查内容比较典型,如:浓盐酸、浓硝酸的挥发性,浓硫酸的吸水性(所以常用作干燥剂)、脱水性及其溶于水时放出热量,稀释浓硫酸的正确操作,使用酸液发生意外时的正确处置等.答案:(1)挥发,(2)将浓硫酸加入水中(硫酸入水)
例2 (2014年北京)下列物质必须密封保存的是( )
A.木炭 B.浓盐酸 C.石灰石 D.氯化钠
评析 化学试剂如何保存决定于其特性.如:浓盐酸易挥发,浓硫酸易吸水,它们在储存或运输时都必须密封;浓硝酸有较强挥发性且见光或受热时易分解,所以浓硝酸应放在棕色试剂瓶中密封,置于阴凉处保存;碳酸极易分解,实验室通常不保存碳酸,需要时现制现用.答案:B
二、考查常见酸的化学通性
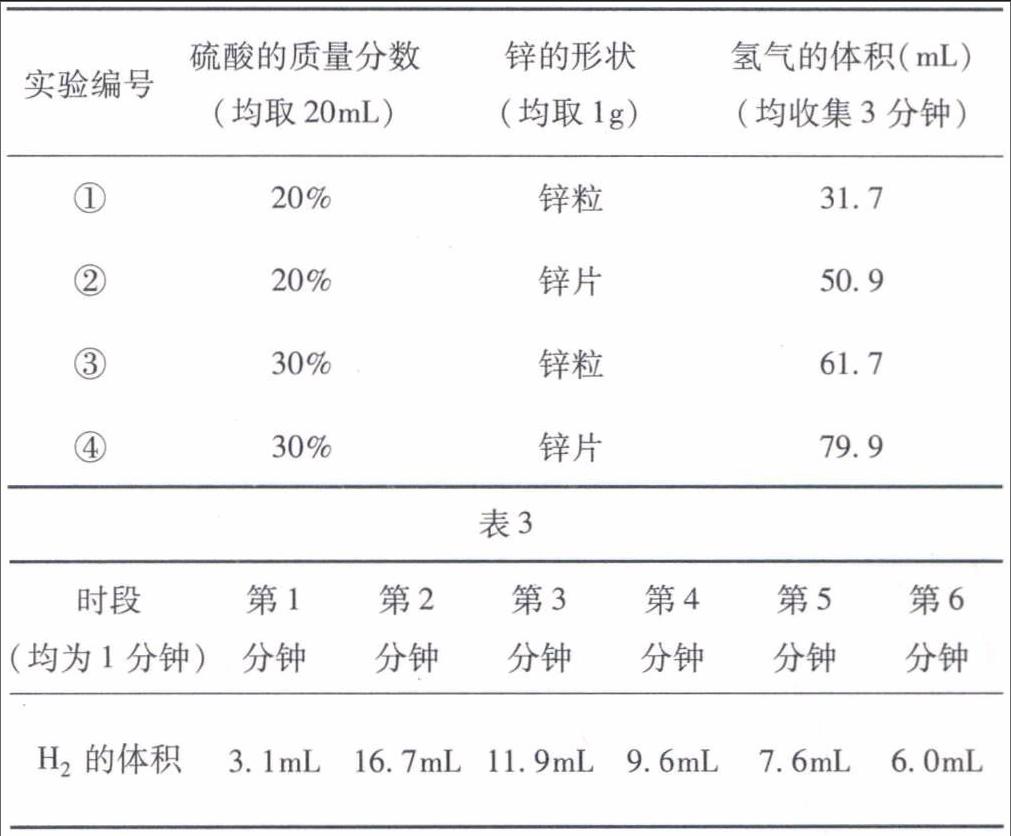
例3 (2015年湖北黄冈)构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图1所示,请结合图示回答下列问题:
(1)如用湿润的pH试纸测定盐酸的pH,则结果会(填“偏大”、“偏小”、“无影响”).
(2)图中①的现象是:.
(3)写出一个符合图中③的化学方程式.
(4)图中性质④属于反应(填基本反应类型).
(5)图中⑤的性质在工业上可用于(填用途).
评析 这类试题命制多围绕酸与指示剂、活泼金属、金属氧化物、盐以及碱的反应等五个方面予以展开,试题侧重考查酸溶液具有通性的原因、化学反应现象、反应所属基本反应类型、化学方程式的书写、反应在生产生活中的应用、实验误差分析等;要求学生能熟练掌握酸的通性、了解化学反应实质、正确书写相关化学方程式;试题难度中等,有较强的开放性,部分试题的答案不唯一.本题中构建的知识网络中部分反应物(如②、⑤)、生成物(如④)没有标出,增大了审题、答题难度.答案:(1)偏大(相当于稀释了待测液),(2)石蕊变红,(3)HCl+AgNO3AgCl↓+HNO3(合理即可),(4)复分解,(5)稀盐酸、稀硫酸除铁锈(合理即可)
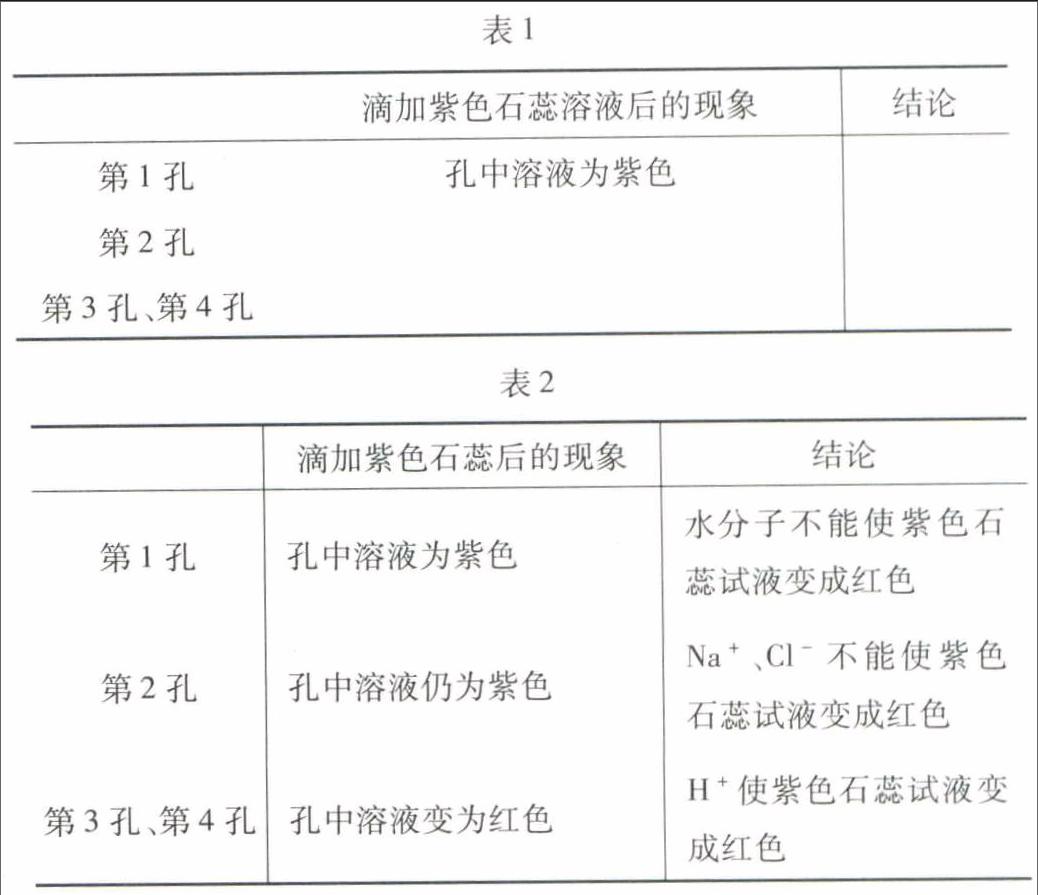
变式训练 1.(2014年黑龙江大庆)如图2以稀盐酸为例的反应关系体现了酸的化学性质,其中X与图中所给物质的类别不同.结合此图回答下列问题:
(1)稀硫酸中阳离子的符号是;
(2)反应①中石蕊溶液变为色;
(3)反应⑤的化学方程式为;
(4)图中只生成盐和水的反应有(填序号);
(5)若X溶液既能跟Ca(OH)2反应,又能跟稀盐酸反应,则X可能是(BaCl2、CuSO4、Na2CO3)中的.
三、常见酸溶液中特征微粒(H+)的性质探究
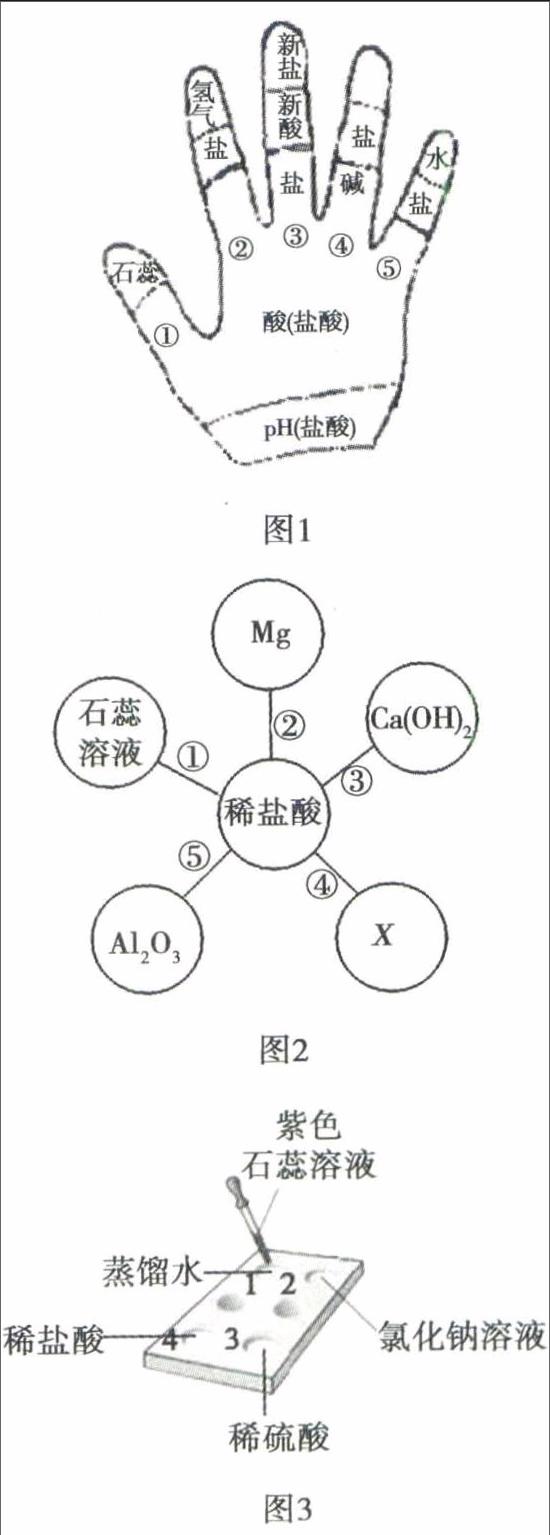
例4 (2010年云南昆明)盐酸溶液中含有H2O分子、H+和Cl-离子,要探究是哪一种粒子能使紫色石蕊溶液变成红色,请观察在白色点滴板(图3)上进行的下列实验,将实验现象和结论填入表1.
评析 化学物质宏观上表现出的性质,实际是无数肉眼看见的特征微粒集体行为的体现,试题命制意在引导教师在平时教学中能结合初中学生的认知特点,重视“微观-宏观-符号”三重表征思维方式的训练和培养,以便学生能突破化学式、离子符号等化学用语学习的困难,提高学生学习知识的灵活性.这类试题侧重考查酸溶液具有酸的通性的原因探究,实验方案的设计多从正、反两个方面展开:(1)正面肯定,实验验证溶液能表现出酸的通性是因为其中含H+,可选择与题干给出的酸(本题为盐酸)性质相似的其他酸(稀硫酸、稀硝酸等)予以佐证;(2)反面否定,实验验证溶液中其它微粒(水分子、酸根离子等)的存在不能体现出酸的通性,可选择特定盐溶液予以说明,特定盐溶液应满足两个要求:①溶液中含有与题干给出的酸相同的酸根离子,②溶液呈中性,如NaCl、KCl等.试题同时还考查学生实验设计、比较分析、概括归纳等能力.答案:
四、考查常见的酸与金属等反应时各物质间的质量关系
例5 (2014年黑龙江齐齐哈尔)现有锌和另一种金属组成的合金65g,洋洋同学向此合金中加入100g一定溶质质量分数的稀盐酸,充分反应后发现金属完全消失,若产生氢气的质量为m.则下列判断正确的是( )
A.如果合金为锌和铁,m不可能是02g
B.反应后溶液中的溶质只有两种
C.如果合金为锌和镁,m可能是01g,则该合金中锌的质量分数为50%
D.如果合金为锌和铁,所加稀盐酸溶质质量分数一定大于7.3%.
评析 试题以酸与不同金属的反应为载体,侧重考查反应中金属、酸及氢气等物质间的质量关系.试题的难点是合金中两种不同金属的质量不确定,多数学生无从下手,解题的基本技巧是巧用“极值法”.以本题为例,先将合金中锌当作65g,根据化学方程式求出消耗的HCl和生成H2的质量(分别是:73g、02g);再將合金中另一金属当作65g,同理求出HCl、H2质量(分析题意可知:另一金属若是镁,只需求出H2的质量m为054g;另一金属若是铁,分别是847g、023g);则65g的合金消耗HCl、生成H2的质量应该介于两组数值(即极值)之间.具体而言:A中锌铁合金,则02g
本题有较大的难度,不仅考查学生根据化学方程式的计算能力,同时要求学生掌握一些特殊的解题方法(如“极值法”),具备较强的分析、推理和判断等能力.答案:A、D
变式训练 2.(2013年四川眉山)某合金由两种金属元素组成,取该合金60g投入足量稀硫酸中,反应完全后,测得生成H23g,则合金的组成不可能是 ( )
A.Fe与Zn B.Mg与Cu
C.Na与Al D.Al与Fe
五、考查有酸参加的化学反应中其反应速率的影响因素
例6 (2013年安徽省)“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究.
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a可能与硫酸的质量分数有关;b可能与锌的形状有关.
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验.
(1)写出稀硫酸与锌反应的化学方程式.(2)略
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是.
【得出结论】(4)结论是.
【评价与反思】(5)表3是小兵第①组实验的详细数据.
请描述锌与硫酸反应的快慢的变化并解释原因.
(6)鋅与硫酸反应的快慢可能还受哪些因素影响?设计实验验证..
评析 试题同样以酸与金属反应为载体,但侧重考查化学反应速度影响因素的实验探究,同时还考查学生化学方程式书写、实验方案的设计与评价、实验数据的比较与分析等能力.解答这类试题,学生首先要了解影响化学反应速度的因素有:(1)反应物本身性质(内因),(2)反应物浓度(外因,下同),(3)反应物接触面积,(4)温度等;其次,要结合具体实验,根据“单一变量法”规则予以分析.对照给出的四个实验发现:比较①②(或③④),说明反应物接触面积越大反应越快;比较①③(或②④),说明反应物浓度越大反应越快;自己设计实验方案时应避免与题干中已有方案重复,杜绝无谓的失分现象.答案:(1)Zn+H2SO4ZnSO4+H2↑.(3)①③(或②④).(4)硫酸的溶质质量分数越大则反应越快[比较(3)中(①②或③④)(4)也可填硫酸和锌接触面越大反应越快)].(5)反应先逐渐加快然后逐渐减慢;随着反应的进行,硫酸不断被消耗,硫酸浓度逐渐变小.(6)温度;取等质量的锌粒分别放入两支试管中,后分别加入温度不同、体积和溶质质量分数都相同的稀硫酸,比较生成氢气的快慢.
变式训练 3.(2015第25届天原杯复赛)为了探究影响金属与酸反应反应快慢的因素,进行以下实验:
由此得出影响金属与酸反应剧烈程度的因素有:
(1);(2);(3).
六、考查常见的酸与碱发生中和反应的微观实质
例7 (2016年广西南宁)“宏观——微观——符号”三重表征是化学独特的表示物质及其变化的方法.请结合图4所示的氢氧化钠溶液和稀硫酸反应的微观示意图4,回答下列问题.
(1)写出氢氧化钠溶液和稀硫酸反应的化学方程式.
(2)写出图中C方框内甲、乙两种粒子的符号:甲 、乙.
(3)从微观的角度分析,上述反应的实质是 (填粒子符号,下同)和结合成H2O.
评析 复分解反应是初中化学教学的重点,也是学生学习的难点,引导学生从离子角度认识酸、碱、盐等物质的性质和相互间反应的实质,对学习该内容能起事半功倍的作用.试题以学生最熟悉的中和反应为情景,考查学生识图辩图、分析推理、对新信息处理加工以及灵活运用知识等能力,基于初中学生认知能力和思维习惯,对学生提出了较高的能力要求.分析图示可知:H2SO4在水中会解离出H+、SO2-4,NaOH在水中解离出Na+、OH-;两种物质混合后,H2SO4和NaOH反应实质是溶液中H+和OH-结合成了难解离的水分子(俗称反应中的“参与者”)、而原溶液中SO2-4、Na+的数目(个数比为1∶2)、性质不发生改变(俗称反应中的“旁观者”).
答案:
(1)H2SO4+2NaOHNa2SO4+2H2O;
(2)甲:Na+,乙:SO2-4;
(3)H+、OH-(可互换)
变式训练 4.(2012年甘肃张掖)在宏观、微观、符号之间建立联系,是化学学科特有的思维方式.可溶性酸、碱、盐在水中可解离出阴阳离子,我们现阶段所学的复分解反应的实质就是酸、碱、盐解离出的一些阴、阳离子相互结合生成难解离的水、气体或沉淀,根据下列溶解性表(略)及氢氧化钠溶液和盐酸反应的微观示意图(图5)回答问题.
①图5所示,HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推H2SO4在水中会解离出的离子是(填离子符号).
②根据上述微观示意图写出化学方程式 ,判断反应前后溶液中数目发生变化的粒子是(填粒子符号).③略
变式训练参考答案:1.(1)H+,(2)红,(3)Al2O3+6HCl2AlCl3+3H2O,(4)③⑤,(5)Na2CO3;
2. A;
3.(1)因素一:金属的活动性,金属活动性越强反应越快;(2)因素二:金属与酸的接触面积,接触面越大反应越快;(3)因素三:酸的浓度,酸越浓反应越快(答案合理即可);
4.①H+、SO2-4,②HCl+NaOHNaCl+H2O H+、OH-、H2O.

