阿魏蘑与胶红酵母共培养中促进产漆酶物质的初步研究
郭超林,丁重阳,陆健,顾正华,张梁,石贵阳(1.江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡214122; 2.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122)
阿魏蘑与胶红酵母共培养中促进产漆酶物质的初步研究
郭超林1,2,丁重阳1,2,陆健1,2,顾正华1,2,张梁1,2,石贵阳1,2
(1.江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡214122; 2.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122)
阿魏蘑在液态发酵过程中经胶红酵母共培养后,漆酶的产量得到提高,但对其起促进作用的物质尚不清楚。本文中,笔者首先考察阿魏蘑和胶红酵母发酵上清液混合对漆酶酶活测定的影响,发现胶红酵母并没有表达漆酶的能力,同时,发酵上清液的混合会导致漆酶酶活的下降。因此,排除了两种微生物发酵液之间发生的协同或促进作用对漆酶酶活的影响。在分别添加高温灭活和70℃灭活的胶红酵母后发现,添加30 g/L的70℃灭活的胶红酵母,阿魏蘑漆酶酶活增加至6 605 U/L,而高温灭活未有相应的促进效果。因此,在共培养中促进漆酶合成的活性物质存在于酵母中并对温度敏感。通过比较70℃灭活胶红酵母的添加时间和添加量后,在阿魏蘑培养第2天添加50 g/L胶红酵母获得最高漆酶产量7 579 U/L。通过研究发现了胶红酵母中某种对热敏感的物质促进了阿魏蘑漆酶表达量的提高,此结果对研究漆酶及其他发酵产物在共培养中表达量的提高有重要意义。
漆酶;共培养;促进物质;热处理酵母细胞;Pleurotus ferulae;Rhodotorula mucilaginosa
漆酶(EC 1.10.3.2)是一种含铜的多酚氧化酶,属于铜蓝氧化酶蛋白家族[1],被广泛应用于污废水处理[2]、生物制浆[3]和染料脱色[4]等领域。在自然界中,白腐真菌是漆酶主要合成菌,但是白腐真菌漆酶产量一般较低,尚不能满足工业需求。化学诱导[5-6]以及重组表达[7]等方式可以提高漆酶产量,但是当下已发现的有效诱导剂一般价格昂贵或其本身具有毒性[8-9],后续要进行脱毒处理;重组表达则存在前期投入大、稳定性稍差等问题。近年来,有越来越多的研究者报道了通过微生物共培养来提高漆酶产量[10-13]。相较于前两种方法,共培养作为一种促进产漆酶的温和技术,具有广阔的开发和应用前景。
课题组之前的研究中[14],发现阿魏蘑与胶红酵母通过共培养,漆酶酶活达到约8 000 U/L,较单培养提高了1.2倍左右,但促进酶活提高的物质尚不清楚。在本研究中,笔者尝试从发酵上清液的协同作用、生物量、促进因子等方面的变化,初步探究阿魏蘑与胶红酵母共培养促进产漆酶的物质与机制,为进一步通过共培养促进产漆酶的研究提供一定的依据。
1 材料和方法
1.1 材料
1.1.1 菌种
阿魏蘑(Pleurotus ferulae)JM30X与胶红酵母(Rhodotorula mucilaginosa)JB401,保存于江南大学粮食发酵工艺与技术国家工程实验室。
1.1.2 培养基
PDA斜面培养基(g/L):马铃薯200,葡萄糖20,琼脂20,pH自然。用于阿魏蘑菌种保藏。
YPD液体培养基(g/L):蛋白胨20,酵母膏10,葡萄糖20,pH自然。用于胶红酵母种子培养。
麸皮基本培养基(g/L):葡萄糖20,玉米粉10,麸皮粉10,K2SO40.174 2,初始pH 9.0。用于阿魏蘑的种子培养和液体发酵培养。
1.1.3 主要试剂
酵母膏、蛋白胨,英国Oxoid公司;葡萄糖、K2SO4等,国药集团上海化学试剂有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),BBI生命科学有限公司;麸皮粉、玉米粉、马铃薯,购自当地市场。
1.2 方法
1.2.1 培养方法
阿魏蘑种子培养:取2块0.5 cm2大小的菌块,接种于80 mL种子培养基中,150 r/min、25℃培养7 d。
胶红酵母种子培养:用接种环划取适量胶红酵母,接种于80 mL YPD液体培养基中,200 r/min、30℃培养48 h。
阿魏蘑单培养:向150 mL基本培养基中加入体积分数3%的种子培养基,150 r/min、25℃培养7 d。
阿魏蘑与胶红酵母共培养:在阿魏蘑单培养48 h后,接种体积分数3%的胶红酵母种子,继续培养5 d。
1.2.2 发酵上清液的制备
阿魏蘑单培养、胶红酵母单培养、阿魏蘑与胶红酵母共培养结束后,得到的发酵液在8 000 r/min条件下离心5 min,即可获得实验所用的阿魏蘑上清液、胶红酵母上清液和共培养上清液;需要无菌处理的,再经过0.22μm微孔滤膜过滤除菌。
1.2.3 生物量的测定
在发酵至第7天分别收获单培养和共培养菌体,先用粗纱布过滤以除去培养基残渣和共培养发酵液中的胶红酵母细胞,然后用滤纸蘸吸水分。获得的菌丝体置于提前干燥至恒质量的滤纸上,在80℃烘干24 h后再次称质量。
1.2.4 灭活及热处理胶红酵母的获得
培养并收集大量胶红酵母菌体,将胶红酵母在121℃高温灭菌20 min,即获得灭活胶红酵母。通过温度梯度实验,研究不同温度下热处理1 h胶红酵母的致死率,以确定能杀死所有酵母的最低温度。培养并在无菌条件下收集胶红酵母菌体,然后将胶红酵母细胞在该温度下热处理1 h,即获得热处理胶红酵母。
1.2.5 漆酶酶活测定方法
以ABTS为底物[15],在1 mL反应体系中,含有880μL 0.1 mol/L乙酸-乙酸钠缓冲液(pH 4.5),100μL终浓度1 mmol/L的ABTS底物和20μL稀释一定倍数的粗酶液(须使最终的吸光值在0.2~0.8之间),在30℃下反应5 min后,在420 nm下测定其吸光值(以热灭活的酶液为空白对照)。定义每分钟氧化1μmol ABTS底物所需要的酶量为1个酶活单位(U)。酶活按式(1)计算。
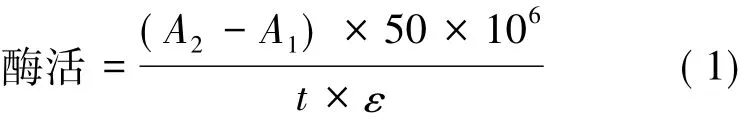
式中:A1代表空白对照的吸光值;A2代表反应后的吸光值;t代表反应的时间;ε代表ABTS的摩尔吸光系数,3.6×104L/(mol·cm)。
2 结果与讨论
2.1 阿魏蘑上清液与胶红酵母上清液混合后的酶活水平变化
漆酶的酶活水平除了跟表达量有关外,还受到反应体系中温度、pH、促进剂和抑制剂等的影响,其中已确定Cu2+、Mn2+、Zn2+等金属离子对漆酶的活性有明显的促进作用[16-17]。之前研究发现阿魏蘑的漆酶活力经与胶红酵母共培养后提高了约1.2倍,而促进其提高的物质和机制尚不清楚,因此,本文中,笔者首先探究在共培养过程中,两种发酵上清液之间是否存在协同或促进作用,从而致使漆酶酶活水平的提高。
将阿魏蘑和胶红酵母发酵上清液按一定的比例混合后,30℃振荡温育10 min,测定漆酶酶活变化,结果如表1所示。
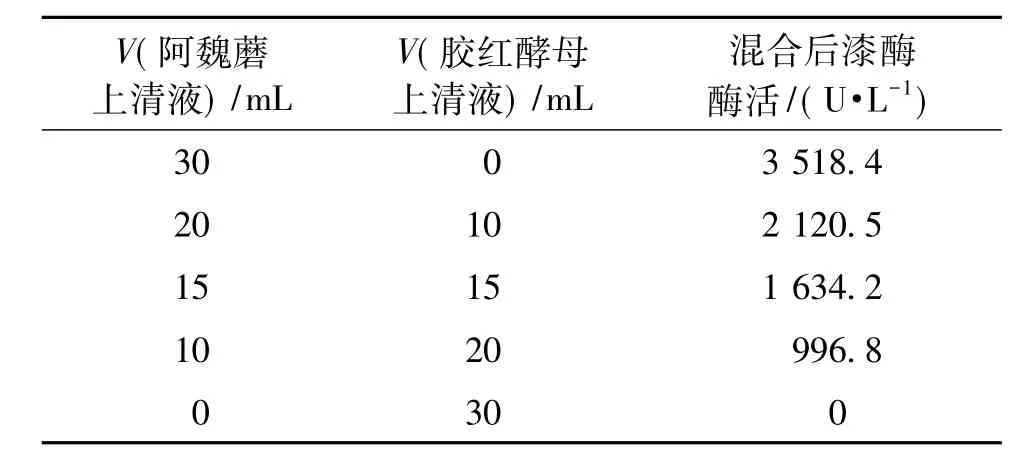
表1 阿魏蘑上清液与胶红酵母上清液混合后的漆酶酶活Table 1 Enzyme activity of supernatant mixture of Pleurotus ferulae and Rhodotorula mucilaginosa
由表1可知:胶红酵母并不能分泌漆酶,当阿魏蘑上清液与胶红酵母上清液以不同比例混合后,漆酶酶活随着加入胶红酵母上清液体积的增多,混合液的漆酶酶活呈线性降低的趋势。以上结果说明阿魏蘑与胶红酵母共培养过程中,并不是两种微生物发酵液之间发生的协同或促进作用导致漆酶酶活的提高,而应该是胶红酵母细胞与阿魏蘑菌丝体之间或者是某些物质与阿魏蘑菌丝体之间的相互作用,最终促进阿魏蘑漆酶表达量的提高。
2.2 单/共培养过程中阿魏蘑生物量的变化
对于组成型的微生物漆酶,其表达量一般跟漆酶生产菌的生物量呈正相关的关系。将阿魏蘑菌体干燥后称质量,得到单培养时阿魏蘑菌体干质量为15.1 g/L,共培养时阿魏蘑菌体干质量为14.3 g/L。即共培养时阿魏蘑菌体质量并没有增加,且较单培养略少,但相差不大。结果说明共培养时漆酶产量的提高不是阿魏蘑生物量增加所致,推断有可能是培养体系中的某些活性物质作用于阿魏蘑细胞,促进了其单个细胞表达和分泌漆酶的能力,最终表现为漆酶酶活的提高。
2.3 不同发酵上清液对阿魏蘑产漆酶的影响
将制备的胶红酵母和共培养发酵上清液用0.22 μm滤膜过滤除菌,然后在第2天时添加到阿魏蘑发酵培养基中继续培养5天,发酵完成后进行酶活测定,结果见图1。由图1可知,单纯添加胶红酵母上清液会抑制阿魏蘑漆酶的合成,酶活降至2 559 U/L,而添加共培养上清液后,漆酶酶活与阿魏蘑单培养时酶活相近,但也稍有降低,说明在发酵液中不存在促进阿魏蘑产漆酶的物质。因此,胶红酵母促进阿魏蘑产漆酶的物质可能存在于酵母细胞中。
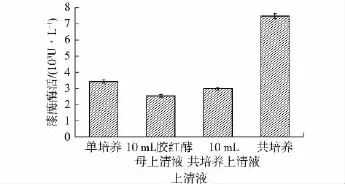
图1 添加胶红酵母与共培养上清液对漆酶酶活的影响Fig.1 Effects of adding the supernatant of coculture and Rhodotorula mucilaginosa on laccase production
2.4 不同温度灭活的胶红酵母菌体对阿魏蘑产漆酶的影响
为排除胶红酵母生长和代谢对阿魏蘑产漆酶的影响,酵母经高温灭活后添加于单培养48 h的阿魏蘑中,结果如图2所示。由图2可知:经高温灭活的胶红酵母不同添加量下,漆酶酶活与阿魏蘑单培养酶活相近,并未显示相应的漆酶产量促进作用。这可能是由于酵母中的共培养促进物质对高温较敏感,因此应当尝试在较温和的温度下热处理胶红酵母一定时间后,再添加至阿魏蘑培养基中,既保证能杀死酵母细胞,又能在一定程度上减少对胶红酵母菌体中活性物质的破坏。
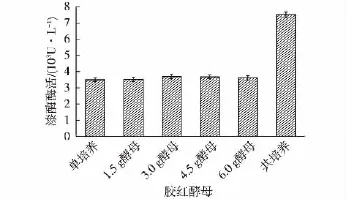
图2 添加不同湿质量高温灭菌胶红酵母菌体对漆酶酶活的影响Fig.2 Effects of adding different wet weight Rhodotorula mucilaginosa after high temperature sterilization on laccase production
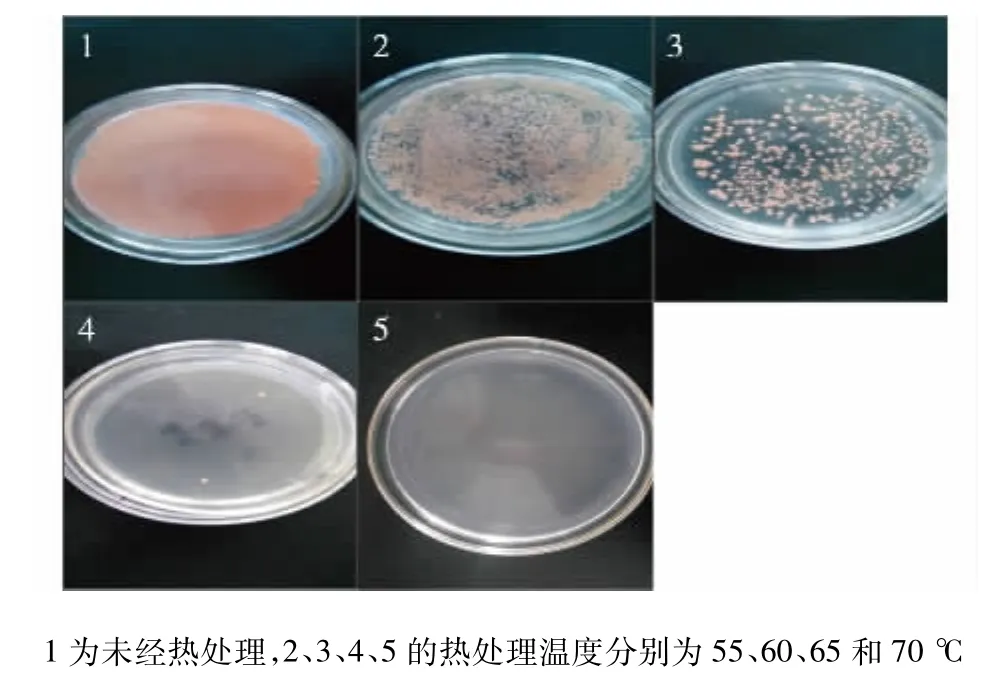
图3 不同热处理温度对胶红酵母的灭活效果Fig.3 Inactivation effects of different heat-treated temperature on Rhodotorula mucilaginosa
将胶红酵母菌体分别在55、60、65和70℃下水浴处理1 h后,以平板涂布的方式考察不同热处理温度的灭活效果,结果如图3所示。由图3可知:经55℃热处理1 h后,胶红酵母菌落数减少50%以上,且随着温度的升高,菌落数迅速降低,当70℃热处理1 h后,可以完全实现胶红酵母细胞的灭活。在70℃下热处理胶红酵母1 h后,添加30 g/L的灭活酵母菌体于培养48 h的阿魏蘑,并继续培养5 d后进行酶活测定,发现漆酶酶活提高至6 605 U/L。此结果表明,在阿魏蘑和胶红酵母共培养中,阿魏蘑漆酶表达量的提高主要是由于胶红酵母细胞中的某种活性物质,同时此活性物质对温度敏感,且高温下该物质容易失活。之前的研究中也有类似的结果,在L.plantarum NC8与一些革兰氏阳性菌共培养产细菌素NC8的研究中,发现添加55℃热处理的革兰氏阳性菌菌体可以诱导产生细菌素NC8,而添加高温灭菌和无细胞上清液则不能诱导产生细菌素[18]。
2.5 热处理胶红酵母最佳添加时间和添加量的研究
为进一步提高阿魏蘑的漆酶产量,笔者首先研究了70℃热处理胶红酵母的添加时间对漆酶产量的影响,结果见图4。由图4可知:在不同时间添加30 g/L的酵母后,阿魏蘑继续培养至第7天后发现,随着添加时间的往后推移,漆酶酶活呈现先升高后降低的趋势,在第2天时酶活水平达到最高,漆酶酶活约为6 500 U/L,因此选择在阿魏蘑培养至第2天进行热处理胶红酵母的添加。
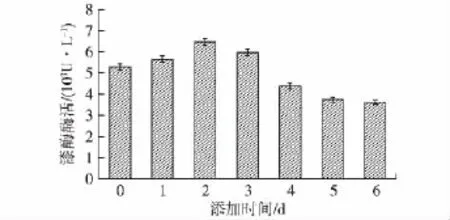
图4 热处理胶红酵母添加时间对漆酶酶活的影响Fig.4 Effects of the time of adding Rhodotorula mucilaginosa after heat treatment at 70℃
在阿魏蘑培养至第2天时,向其培养基中添加不同质量的热处理胶红酵母,结果如图5所示。由图5可以看出,随着灭活胶红酵母添加量的提高,漆酶酶活先是呈逐渐升高的趋势,当添加50 g/L的灭活胶红酵母菌体时,漆酶酶活达到最高水平,添加量继续提高时漆酶酶活开始有所下降。最终确定非活性胶红酵母最佳添加时间为阿魏蘑培养至第2天,添加量50 g/L,漆酶酶活可达到7 579 U/L,约为对照组的2.1倍,基本达到了阿魏蘑与胶红酵母共培养时的酶活水平。
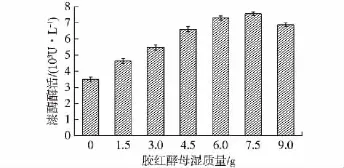
图5 热处理胶红酵母添加量对漆酶酶活的影响Fig.5 Effects of the amount of adding Rhodotorula mucilaginosa after heat treatment at 70℃
3 结论
阿魏蘑上清液与胶红酵母上清液混合后,随着胶红酵母上清液比例的增加,漆酶活力呈线性降低的趋势,且共培养后阿魏蘑生物量较单培养略少,因此上清液之间的协同促进作用和阿魏蘑生物量变化都不是致使阿魏蘑漆酶酶活提高的原因。经过70℃热处理,胶红酵母菌体对阿魏蘑产漆酶有显著的促进作用,而经高温灭菌的胶红酵母则没有促进作用,说明胶红酵母菌体中含有某种能促进阿魏蘑产漆酶的促进因子,且该促进因子是一种对热不稳定的物质。此外,笔者对70℃灭活胶红酵母的添加时间和添加量进行了优化,发现在阿魏蘑培养至48 h时,添加50 g/L的热处理胶红酵母,漆酶酶活提高至7 579 U/L。研究结果为进一步明确共培养过程中具有促进作用的物质及其促进机制奠定了基础。
[1]BALDRIAN P.Fungal laccases:occurrence and properties[J].FEMS Microb Rev,2006,30(2):215-242.
[2]CAAS A I,ALCALDE M,PLOU F,et al.Transformation of polycyclic aromatic hydrocarbons by laccase is strongly enhanced by phenolic compounds present in soil[J].Environ Sci Technol,2007,41(8):2964-2971.
[3]MOLDES D,VIDAL T.Laccase for biobleaching of eucalypt kraft pulp by means of a modified industrial bleaching sequence[J].Biotech Prog,2012,28(5):1225-1231.
[4]王寒,彭林,丁重阳,等.阿魏菇与胶红酵母共培养产漆酶对活性艳蓝W-RV的脱色[J].生物加工过程,2015,12(5): 74-78.
[5]YANG Y,WEI F X,ZHUO R,et al.Enhancing the laccase production and laccase gene expression in the white-rot fungus Trametes velutina 5930 with great potential for biotechnological applications by different metal ions and aromatic compounds[J].PloS One,2013,8(11):e79307.
[6]秦小琼,傅庭治,曹幼琴,等.红栓菌胞外漆酶的诱导,纯化及部分特性研究[J].微生物学报,1996(5):360-366.
[7]HONG Y Z,ZHOU H M,TU X M,etal.Cloning ofa laccase gene from a novel basidiomycete Trametes sp.420 and its heterologous expression in Pichia pastoris[J].Curr Microb,2007,54(4): 260-265.
[8]BROWN N L,BARRETT S R,CAMAKARIS J,et al.Molecular gene and transport analysis of the copper resistance determinant (pco)from Escherichia coli plasmid pRJ1004[J].Mol Microbiol,1995,17:1153-1166.
[9]NILADEVI K N,SUKUMARAN R K,JACOB N,et al.Optimization of laccase production from a novel strain-Streptomyces psammoticus using response surface methodology[J].Microbiol Res,2009,164(1):105-113.
[10]CHEN Q H,KRGENER S,HIRTH T,et al.Co-cultured production of lignin-modifying enzymes with white-rot fungi[J].Appl Biochem Biotech,2011,165(2):700-718.
[11]DONG Y C,WANG W,HU Z C,et al.The synergistic effect on production of lignin-modifying enzymes through submerged cocultivation of Phlebia radiata,Dichomitus squalens and Ceriporiopsis subvermispora using agricultural residues[J].Bioproc Biosyst Eng,2012,35(5):751-760.
[12]李静,方泽民,洪宇植,等.Chaetoomium globosum与Panus rudis共培养发酵合成漆酶[J].安徽大学学报(自然科学版),2011,35(6):93-97.
[13]PAN K,ZHAO N,YIN Q,et al.Induction of a laccase Lcc9 from Coprinopsis cinerea by fungal coculture and its application on indigo dye decolorization[J].Bioresour Technol,2014,162(6):45-52.
[14]WANG H,PENG L,DING Z,et al.Stimulated laccase production of Pleurotus ferulae JM301 fungus by Rhodotorula mucilaginosa yeast in co-culture[J].Process Biochem,2015,50(6):901-905.
[15]HOU H,ZHOU J,WANG J,et al.Enhancement of laccase production by Pleurotus ostreatus and its use for the decolorization of anthraquinone dye[J].Process Biochem,2004,39(11): 1415-1419.
[16]窦隆,陈莎,李传仁,等.糙皮侧耳P5漆酶酶学性质的初步研究[J].长江大学学报(自然科学版),2015(1):61-64.
[17]赵亮亮,谌斌,李燕荣,等.红芝组成型漆酶酶学性质的研究[J].北方园艺,2010(5):138-140.
[18]MALDANODA A,RUIZ-BARBA J L,JIMENEZ-DIAZ R.Production of plantaricin NC8 by Lactobacillus plantarum NC8 is induced in the presence of different types of gram-positive bacteria[J].Arch Microb,2004,181(1):8-16.
(责任编辑管珺)
Compound to enhance laccase production in co-culture of Pleurotus ferulae and Rhodotorula mucilaginosa
GUO Chaolin1,2,DING Zhongyang1,2,LU Jian1,2,GU Zhenghua1,2,ZHANG Liang1,2,SHI Guiyang1,2
(1.Key Laboratory of Industrial Biotechnology of the Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122,China)
Laccase production of Pleurotus ferulae was enhanced by the co-culture with Rhodotorula mucilaginosa and the compound enhancing laccase production was not clear.In this study,no laccase activity was detected in R.mucilaginosa culture broth and no enhanced laccase production was found after mixing culture broth of P.ferulae and R.mucilaginosa.Therefore,enhancement of laccase production in coculture was not brought by simply mixing broth of Pleurotus ferulae and R.mucilaginosa.The results showed that the addition of 30 g/L R.mucilaginosa cells heat-treated by 70℃improved laccase production,which was improved to 6 605 U/L,whereas sterilized cells had no influence on laccase production.The possible compound,which was responsible for enhancing effect in co-culture,was sensitive to temperature.After optimizing adding time and adding amount,the highest laccase production wasobtained by adding 50 g/L treated yeast cells to 2-day cultured P.ferulae,which was 7 579 U/L.Depending on this study,some compounds sensitive to temperature enhanced laccase production of P.ferulae and will be investigated in further research.
laccase;coculture;promoting factor;heat-treated cell;Pleurotus ferulae;Rhodotorula mucilaginosa
Q815
A
1672-3678(2017)04-0040-05
10.3969/j.issn.1672-3678.2017.04.007
2016-03-31
国家自然科学基金(31571822)
郭超林(1990—),男,河南周口人,研究方向:发酵工学;丁重阳(联系人),教授,E-mail:zyding@jiangnan.edu.cn;陆健(联系人),教授,E-mail:jlu@jiangnan.edu.cn

