微生物α-半乳糖苷酶的研究进展
闫巧娟 , 刘 瑜, 江正强
(1.中国农业大学 工学院,北京 100083;2.中国农业大学 食品科学与营养工程学院,北京 100083)
·大家专版·
微生物α-半乳糖苷酶的研究进展
闫巧娟1, 刘 瑜2, 江正强2
(1.中国农业大学 工学院,北京 100083;2.中国农业大学 食品科学与营养工程学院,北京 100083)
α-半乳糖苷酶在多种生物内广泛存在,微生物是目前α-半乳糖苷酶的主要来源。微生物α-半乳糖苷酶可按照底物特异性或序列同源性分类,在古菌、细菌和真菌中均存在,其性质与来源和家族有关,催化机理大多为构型保留机制,目前主要应用于食品与饲料工业,还可用于生物质降解和医药领域。展望了微生物α-半乳糖苷酶的研究趋势。本文对相关研究者具有一定的参考意义。
α-半乳糖苷酶;棉籽糖家族寡糖;工业应用
α-半乳糖苷酶(EC 3.2.1.22,α-D-半乳糖苷半乳糖基水解酶)能够从α-半乳寡糖、半乳甘露聚糖侧链、半乳糖脂和糖蛋白的非还原端逐个水解半乳糖残基[1]。该酶有着重要而广泛的应用,目前主要应用于食品与饲料工业中。在食品工业中,可水解食物中棉籽糖家族寡糖(raffinose family oligosaccharide,RFO),避免胃肠胀气的发生[2-3];在饲料工业中,可以将单胃动物不能利用的棉籽糖家族寡糖水解成半乳糖和蔗糖,提高饲料利用率,同时消除棉籽糖家族寡糖被肠道微生物分解引起的腹泻和胀气;此外还可以通过水解半乳甘露聚糖的侧链促进β-甘露聚糖酶水解[4],或者通过转糖苷活性合成α-低聚半乳糖及其他重要的新型糖苷化合物[5]。α-半乳糖苷酶的来源非常广泛,动物、植物和微生物中均有分布。自从1895年Bau[6]、Fischer等[7]从下面发酵啤酒酵母中分离了α-半乳糖苷酶以来,目前碳水化合物活性酶(carbohydrate-active enzyme,CAZy)数据库(http://www.cazy.org)中已确定的α-半乳糖苷酶已达134个。微生物α-半乳糖苷酶由于其产量较大、来源广泛、性能优良而得到较多的关注。因此,本文主要介绍微生物α-半乳糖苷酶的研究进展。
1 α-半乳糖苷酶的分类与来源
传统上,根据底物特异性,α-半乳糖苷酶可以分为两类:第一类仅水解人工合成的对硝基苯基底物和棉籽糖家族寡糖(包括棉籽糖、水苏糖)等分子量较小的底物(图1A);第二类除水解上述底物,还能够水解半乳甘露聚糖的半乳糖基侧链(图1B)。由于α-半乳糖苷酶属于糖苷水解酶(glycoside hydrolase, GH),CAZy数据库根据序列同源性将目前已知α-半乳糖苷酶归入GH 4、GH 27、GH 36、GH 57、GH 97和GH 110家族。GH 36和GH 27家族α-半乳糖苷酶占已知α-半乳糖苷酶的多数,分别大致对应于上述第一类和第二类α-半乳糖苷酶。其他家族α-半乳糖苷酶相对较少。
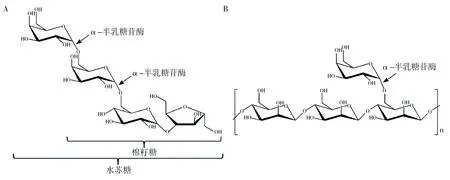
图1 α-半乳糖苷酶水解棉籽糖、水苏糖和半乳甘露聚糖示意图Fig.1 Schematic illustration of the hydrolysis effect of α-galactosidase towards raffinose, stachyose and galactomannanA:α-半乳糖苷酶水解棉籽糖和水苏糖示意图;B:α-半乳糖苷酶水解半乳甘露聚糖示意图A: Schematic illustration of the hydrolysis effect of α-galactosidase towards raffinose and stachyose; B: Schematic illustration of the hydrolysis effect of α-galactosidase towards galactomannan
α-半乳糖苷酶可由植物、动物和微生物产生。在植物中,α-半乳糖苷酶常见于果实与种子中[8-9]。哺乳动物和人体内的α-半乳糖苷酶参与糖鞘脂的降解,对脂代谢有重要作用[10]。α-半乳糖苷酶也常见于各种微生物,在古菌、细菌和真菌中均有存在[1]。目前CAZy数据库中已报道的α-半乳糖苷酶主要来自于细菌和真菌,古菌来源的α-半乳糖苷酶仅有4例,其中PyrococcusfuriosusDSM 3638和ThermococcusalcaliphilusAEDII12RA的GH 57家族是目前GH 57家族仅有的两个α-半乳糖苷酶,另外两例属于GH 36家族;细菌来源的α-半乳糖苷酶在GH 4、GH 27、GH 36、GH 97和GH 110家族中均存在,其中GH 4、GH 97和GH 110家族的α-半乳糖苷酶全部来自于细菌;真菌α-半乳糖苷酶虽然报道也较多,但已知仅存在于GH 27和GH 36家族,尚无其他糖苷水解酶家族真菌α-半乳糖苷酶的报道[11]。
2 微生物α-半乳糖苷酶的发掘与分子改造
2.1 天然α-半乳糖苷酶的研究
从自然界中筛选产α-半乳糖苷酶的菌株,进行酶的纯化和性质、应用研究,是挖掘α-半乳糖苷酶的传统方法。近年来乳杆菌α-半乳糖苷酶报道较多。如Roopashri等[2]报道了LactobacillusplantarumMTCC 5422的α-半乳糖苷酶,其最适pH值和温度分别为5.8和45 ℃,在55 ℃保温30 min后仍能保持稳定。陈俊亮等[12]纯化了长双歧杆菌KLDS2.0509 α-半乳糖苷酶,酶的最适pH 值为5.0,最适温度为42 ℃,在pH 5.0~6.0和42 ℃以下保持稳定,能够降解蜜二糖、棉籽糖和水苏糖,但不能水解瓜尔豆胶。杜新永等[13]研究了唾液乳杆菌XH4B α-半乳糖苷酶,确定酶的最适反应条件为pH 5.5和55 ℃。传统产α-半乳糖苷酶微生物筛选可以得到一些性质较好的酶,但是产酶水平较低,难以满足酶应用的需要。此外,酶的编码序列不清楚,因而难以进一步改造酶。
2.2 α-半乳糖苷酶的基因克隆、表达与性质

表1 微生物α-半乳糖苷酶的基因克隆、表达和性质
注:*预测分子量
从表1可以看出, 近来报道较多的是GH 27家族和GH 36家族的α-半乳糖苷酶。GH 27家族α-半乳糖苷酶分子量较低,多为45~60 kDa,个别GH 27家族α-半乳糖苷酶分子量较高,如StreptomycescoelicolorA3(2) 的α-半乳糖苷酶分子量为68 kDa[30],TalaromycesleycettanusJCM12802的α-半乳糖苷酶分子量为72 kDa[35]。GH 36家族α-半乳糖苷酶分子量相对较高,多在80 kDa以上,但是一些嗜热细菌具有较小分子量的GH 36家族α-半乳糖苷酶,如DictyoglomusthermophilumH-6-12 α-半乳糖苷酶Agal2的分子量为57 kDa[25];ThermusthermophilusHB27 α-半乳糖苷酶分子量为55 kDa[31]。细菌来源的α-半乳糖苷酶报道较多,多为GH 36家族;真菌来源的报道相对较少,大致平均分布在GH 27家族和GH 36家族中。细菌α-半乳糖苷酶嗜热性更好,如T.thermophilusHB27 α-半乳糖苷酶最适温度可达90 ℃[31];而真菌α-半乳糖苷酶最适温度一般不超过70 ℃;细菌来源的α-半乳糖苷酶的最适pH值多为6.0~6.5,而真菌来源的更偏酸性,最适pH值通常为5.5以下。
2.3 微生物α-半乳糖苷酶的分子改造
天然微生物α-半乳糖苷酶的性质往往不能够满足工业应用的需求。酶分子改造技术如定向进化和理性设计等能够按照人们和工业的需求改造酶分子,成为酶工程领域的重要研究手段。但是,α-半乳糖苷酶分子改造的报道很少,取得的效果也很有限。如Chen等[17]通过易错PCR结合DNA shuffling技术得到了Penicilliumjanczewskiizaleskα-半乳糖苷酶的突变体,最适pH值从5.2降到5.0,在pH 6.0~8.0的稳定性得到大幅提高,最适温度没有变化,在40 ℃时的稳定性有所提高。在酶的理性设计方面,尚无改造α-半乳糖苷酶的报道。因此,α-半乳糖苷酶的分子改造是目前亟待加强的研究领域之一。
3 微生物α-半乳糖苷酶的结构与催化机制
酶的空间结构取决于其氨基酸序列,同一家族的糖苷水解酶具有相似结构,从而催化机制也基本相同[36]。目前不同糖苷水解酶家族α-半乳糖苷酶的结构和催化机制见表2。
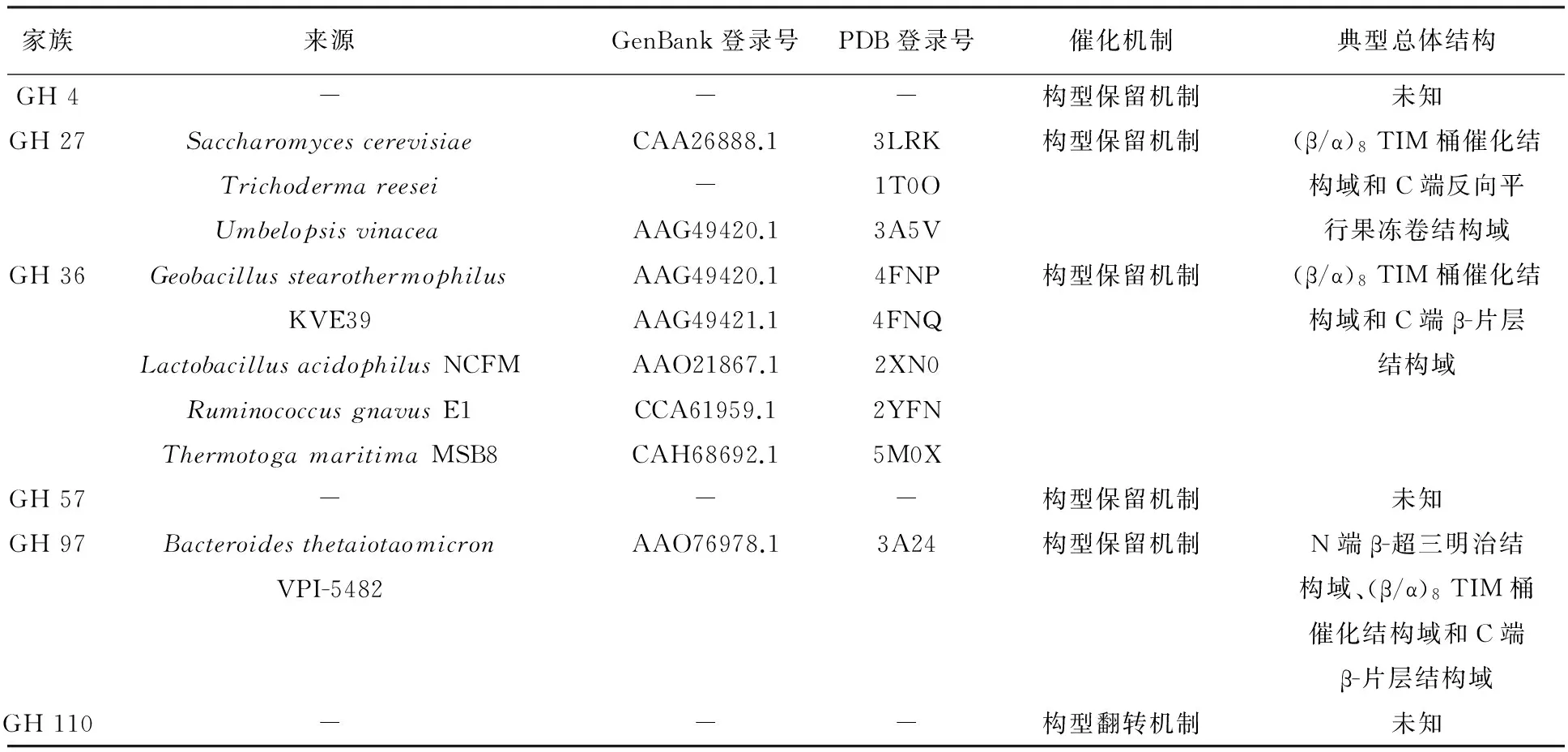
表2 微生物α-半乳糖苷酶的晶体结构与催化机理情况
注:“-”表示目前未知
从表2中可以看出,目前仅有GH 27、GH 36和GH 97家族的α-半乳糖苷酶的结构得到解析,其共同特点是催化结构域均为 (β/α)8TIM桶结构。除催化结构域以外,α-半乳糖苷酶结构中往往还存在一些额外的结构域,如GH 27家族C端存在反向平行果冻卷结构域,GH 36家族C端β-片层结构域以及GH 97家族的N端β-超三明治结构域和C端β-片层结构域,这些结构域的功能目前仍不十分明确,尚待进一步研究[37-39]。一些家族的α-半乳糖苷酶结构还不清楚,如GH 4、GH 57和GH 110家族的α-半乳糖苷酶的结构尚未报道。
α-半乳糖苷酶催化口袋的形状同酶的底物选择性密切相关。第一类α-半乳糖苷酶(一般为GH 36家族)的催化口袋通常深而窄,能够容纳无分支的蜜二糖和棉籽糖,但是却不能同具有分支的半乳甘露聚糖结合;而第二类α-半乳糖苷酶(一般为GH 27家族)具有较浅的催化口袋,因而水解具有分支的半乳甘露聚糖能力较强[40]。对于GH 27家族α-半乳糖苷酶,较浅的催化口袋有利于α-半乳糖苷酶水解半乳甘露聚糖底物内部分支,而催化口袋较深的酶只能水解半乳甘露聚糖末端的侧链[37]。在催化机制方面,与其他的糖苷水解酶一样,α-半乳糖苷酶的催化机制也可以分为构型保留机制和构型翻转机制两种,催化残基一般为谷氨酸或天冬氨酸残基[41]。绝大多数已知α-半乳糖苷酶采取构型保留机制进行催化,仅GH 110 家族α-半乳糖苷酶采取构型翻转机制[42]。另外,GH 4家族酶的催化过程额外需要NAD+作为辅因子,中间过程中有氧化-还原反应的发生[43]。
4 微生物α-半乳糖苷酶的应用
4.1 α-半乳糖苷酶在食品工业中的应用

4.1.2 α-半乳糖苷酶用于合成α-低聚半乳糖 α-低聚半乳糖是一种益生元,能够促进肠道双歧杆菌和乳杆菌的增殖,降低梭菌的数量[49]。α-低聚半乳糖可通过α-半乳糖苷酶的转糖苷反应合成。Wang等[50]在乳酸乳球菌中表达了罗伊乳杆菌α-半乳糖苷酶,以蜜二糖为糖基供体,岩藻糖、乳糖和N-乙酰氨基葡萄糖为糖基合成寡糖,转糖苷效率分别为19.8%、35.0%和22.1%,新合成的糖苷键连接方式有α-1,3、α-1,4和α-1,6连接。Nakai等[51]以对硝基苯基-α-半乳糖苷为糖基,以多种单糖和二糖合成了一系列寡糖,其中5种寡糖为首次报道,得率为37%~74%。目前α-低聚半乳糖的合成常以对硝基苯基-α-D-吡喃半乳糖苷或蜜二糖作为糖基供体,成本较高,生产和应用受到很大限制,开发能以廉价底物进行合成的酶至关重要。
4.2 α-半乳糖苷酶在饲料工业中的应用
豆粕作为大豆榨油后的副产品是动物饲料的重要组成部分,在家禽饲料中的添加比例高达48%,在家猪饲料中的添加比例达26%[45]。但是,作为单胃动物的家禽和家猪不能够消化利用豆粕中的棉籽糖家族寡糖,降低豆粕的利用效率;此外,肠道微生物能够代谢这些寡糖并产气,从而导致动物胃肠胀气和腹泻,产生抗营养性[45]。α-半乳糖苷酶能够将棉籽糖家族寡糖水解成动物可以利用的半乳糖和蔗糖,不仅能够提高饲料利用率,还能够解决动物胃肠胀气的问题,消除棉籽糖家族寡糖的抗营养性[3,52]。除棉籽糖家族寡糖外,饲料中半乳甘露聚糖也是一种抗营养因子,可以增加胃肠内容物的黏稠度,不利于动物对饲料的消化和吸收[52-53]。α-半乳糖苷酶能够协同β-甘露聚糖酶水解半乳甘露聚糖,降低胃肠内容物的黏稠度,提高饲料利用率[32,53-54]。用作饲料添加剂的α-半乳糖苷酶需要饲料造粒过程中高温,因此具有良好耐热性的α-半乳糖苷酶更适合在饲料领域应用。此外,能够耐受胃液造成的强酸性环境和消化道分泌以及外加蛋白酶降解的α-半乳糖苷酶能够在动物胃肠道中发挥降解作用[55]。因此,耐热、耐酸和抗蛋白酶的α-半乳糖苷酶成为近年来的研究热点之一。Katrolia等[34]研究了Rhizomucormiehei来源的α-半乳糖苷酶RmGal36,显示该酶在55 ℃保温30 min后能维持80%以上的活性,并对胰蛋白酶、蛋白酶K和芽胞杆菌蛋白酶具有很强抗性。Bisporasp. MEY-1的α-半乳糖酶最适pH值和温度分别为3.5和55 ℃,在pH 2.2~8.0保持稳定,在模拟消化液中也表现出较好的稳定性[54]。
4.3 α-半乳糖苷酶在生物质降解和生物能源中的应用
半乳甘露聚糖(常见的有瓜尔豆胶和槐豆胶等)是一种半纤维素,由β-1,4连接的甘露糖残基组成的主链和α-1,6连接的半乳糖残基侧链组成,侧链可以被一些α-半乳糖苷酶所降解,解除了位阻效应,促进β-甘露聚糖酶的水解作用[4]。Malgas等[56]采用两种α-半乳糖苷酶(GH 27和GH 36家族)和两种β-甘露聚糖酶(GH 5和GH 26家族)研究了它们对瓜尔豆胶和槐豆胶的降解作用,结果表明GH 36家族α-半乳糖苷酶与两种β-甘露聚糖酶均无协同降解作用,GH 27家族α-半乳糖苷酶能够同GH 26家族β-半乳糖苷酶表现出较强的协同作用。Wang等[32]研究表明NeosartoryafischeriP1的两个重组GH27家族α-半乳糖苷酶(rGal27A和rGal27B)能够与相同来源的GH 5家族甘露聚糖酶(rMan5P1)表现出协同降解半乳甘露聚糖的作用,其中rGal27A和Man5P1组合协同系数可达11.76。目前一些生物质降解酶制剂中已经添加α-半乳糖苷酶,如诺维信的Novozyme 188,杰能科的Spezyme CP、Multifect(xylanase)、Multifect(pectinase)和GC220等[57]。
大豆糖蜜是大豆蛋白生产过程中的副产物,含有大量的棉籽糖家族寡糖,可占大豆糖蜜中总糖的一半[58-60]。大豆糖蜜可用于乙醇和丁醇的生产,但是许多工业微生物(酿酒酵母、运动发酵单胞菌、丙酮丁醇梭菌等)水解棉籽糖家族寡糖能力缺乏或者不足,发酵结束后残糖含量较高,造成浪费[59-61]。为了解决这一问题,da Silva等[62]以α-半乳糖苷酶水解后的大豆糖蜜发酵乙醇,产量可提高10.4%;Dong等[58]利用丙酮丁醇梭菌以酶解大豆糖蜜作为碳源进行丁醇发酵,在初始糖浓度为54 g/L时丁醇发酵水平可达8.7 g/L。
4.4 α-半乳糖苷酶在医药中的应用
B型血红细胞表面抗原末端含有α-1,3连接的半乳糖分支,而O型血红细胞缺乏该结构。GH 110家族的一些α-半乳糖苷酶对α-1,3连接的半乳糖支链具有严格的特异性,能够使B型血转化为受血人群更广的O型血[42]。此外,非灵长类动物细胞表面存在以α-1,3键直链连接于细胞表面糖链末端的半乳糖残基,能够在人类体内引起强烈的排斥反应。Liu等[63]以兔和猪红细胞为研究对象,证实Bacteroidesfragilis的GH 110家族α-半乳糖苷酶BfGal110B能够特异性去除该半乳糖残基。结果表明该酶具有在器官异种移植中的应用潜力。
α-半乳糖苷酶还可用于糖类药物的合成。连接于细胞表面的Globotriose (Galα1-4Galβ1-4Glc) 是志贺样毒素受体,外加Globotriose能够同志贺样毒素结合从而消除毒素对人体的危害[64]。 Gong等[22]利用具有严格立体选择性的BacteroidesfragilisNCTC9343的α-半乳糖苷酶以对硝基苯基-α-半乳糖苷和乳糖合成了Globotriose,产率可达32.4%。酶法合成糖类药物具有反应条件温和、效率高和特异性强的特点,具有很大的应用潜力。
5 展 望
微生物α-半乳糖苷酶在多个行业有着重要的应用,但是酶的性能和生产成本是限制其广泛应用的主要因素,因此获得性质符合应用需要的微生物α-半乳糖苷酶并高水平表达是目前α-半乳糖苷酶研究亟待解决的问题。目前,除了继续加强产酶菌株的筛选和酶基因的挖掘外,还需对酶分子进行改造,使酶的性能符合应用的需要。为了提高α-半乳糖苷酶的表达水平,需要对酶基因和宿主进行改造,消除在基因表达、蛋白修饰和分泌等各方面存在的障碍,大幅提高酶的表达水平。在α-半乳糖苷酶的结构研究方面,亟需解析结构未知家族的α-半乳糖苷酶,阐明其催化机制,为酶的分子改造和应用奠定基础。在α-半乳糖苷酶应用研究方面,开拓新的应用领域,推动α-半乳糖苷酶更广泛应用,也是目前重要课题。随着相关研究的继续深入,更多性能优良的微生物α-半乳糖苷酶将被发现和应用,从而创造更大的经济和社会效益。
Advances in Microbial α-Galactosidase
YAN Qiao-juan1, LIU Yu2, JIANG Zheng-qiang2
(1.CollegeofEngineering,ChinaAgriculturalUniversity,Beijing100083;2.CollegeofFoodScienceandNutritionalEngineering,ChinaAgriculturalUniversity,Beijing100083)
α-Galactosidases are widely distributed in various organisms, and microorganisms are the major source of α-galactosidases. Microbial α-galactosidases can be classified base on the substrate specify and sequence homology, and exist in archaea, bacteria and fungi. They show different properties varied with the sources and families and most of them adopt configuration maintaining mechanism. Microbial α-galactosidases have mainly been applied in food and feed industry, and also in biomass degradation and medicine. At last the development trend of α-galactosidases was prospected. This article will provide useful information to the related researchers.
microorganism;α-galactosidase;raffinose family oligosaccharide; industrial application
国家杰出青年科学基金项目(31325021)
闫巧娟 女,教授。主要研究方向为生物质资源利用。E-mail:yanqj@cau.edu.cn
2017-04-15
闫巧娟,博士,教授,教育部新世纪优秀人才,北京食品营养与人类健康高精尖创新中心岗位科学家。1997年硕士毕业于中国农业大学食品学院后留校任教,2004年晋升副教授,2009年晋升教授。长期从事农产品生物转化方面的科学研究,主要在食品相关酶制剂及其水解产物、功能性低聚糖、天然功能成分和微生物产有机酸等方面开展工作。近十年来,在木聚糖酶、葡聚糖酶、半乳糖苷酶和甘露聚糖酶等的产酶菌株筛选、基因克隆表达、酶的纯化和性质及水解特性方面开展深入研究,得到多个性能优良的新型酶。主持完成国家863计划、国家自然科学基金项目等20多项。发表学术论文150余篇,其中SCI收录论文75篇并被他引800多次;授权国家发明专利30余项。获国家科技进步二等奖2项和省部级奖励3项。
Q814.4
A
1005-7021(2017)03-0001-09
10.3969/j.issn.1005-7021.2017.03.001
——全棉籽的加工与利用

