1株耐高温生物表面活性剂产生菌的特性研究
尤 贺, 张丽敏, 栾 静, 孙玉梅
(大连工业大学 生物工程学院,辽宁 大连 116034)
1株耐高温生物表面活性剂产生菌的特性研究
尤 贺, 张丽敏, 栾 静*, 孙玉梅
(大连工业大学 生物工程学院,辽宁 大连 116034)
研究了耐高温生物表面活性剂产生菌ZY-3的生理生化特性,并通过测定发酵液的菌体密度、表面张力和乳化活性等指标,研究不同碳源和初始pH对菌株ZY-3生长和产生物表面活性剂的影响,同时对其所产生物表面活性剂进行了初步分离和性质分析。菌株ZY-3被初步鉴定为芽胞杆菌属(Bacillus),具有产酸、不产H2S、还原硝酸盐等特性。在以淀粉为碳源、初始pH 6.0的培养基中发酵,产生物表面活性剂多且稳定;在种子培养基和发酵培养基中都有淀粉的条件下,菌体生长较多,降低表面张力和乳化的作用均较强,所产生物表面活性剂可以使发酵液的表面张力从72.1 mN/m降到53.1 mN/m,乳化活性从0升高到24%。初步判断产物为糖脂类阴离子表面活性剂。
生物表面活性剂;耐高温菌株ZY-3;碳源
微生物采油是通过外源微生物或内源微生物的有益活动及其代谢产物的综合作用来提高原油采收率。微生物的有益活动包括菌体细胞的增大和增多以及对油藏中原油的降解、降黏等作用[1-4]。而有利于采油的微生物代谢产物包括生物表面活性剂、生物聚合物、小分子有机溶剂、气体和酶等[5-6]。有报道在物理模拟岩心实验中向岩心管中注入低浓度的生物表面活性剂即可开采35%~45%的原油[7]。较充足的营养是微生物正常生长繁殖和代谢的保证,也是实现微生物采油的基础,所需营养物质依菌种而异[8]。碳源和氮源的影响较大,其对微生物采油的影响研究也较多。通过向油井中注入糖蜜、玉米浆等廉价营养物质,可提高原油采收率[9]。分别以淀粉水解液为碳源、硝酸钠为氮源、磷酸氢二铵为磷源,促进内源微生物产大量有机酸和生物表面活性剂,以提高石油采收率[10]。 油藏是一种高温、高压、高矿化度、贫营养的恶劣地层环境,研究耐高温采油微生物利用不同营养物质的生长代谢,对微生物采油技术的改进和完善具有十分重要的意义。本研究对耐高温菌株ZY-3进行生理生化特性测定,并研究碳源和初始pH对其生长和产生物表面活性剂的影响,通过测定发酵液表面张力和乳化活性反映生物表面活性剂的生成情况。
1 材料与方法
1.1 材料
1.1.1 菌株 耐高温菌株ZY-3从辽河油田的原油中分离,在18%(体积分数)甘油中于-80 ℃冰箱保存。
1.1.2 试剂 实验用化学试剂均为分析纯、化学纯以及生化试剂。
1.1.3 仪器 Jzhy1-180界面张力仪(承德市材料试验机厂),722S型可见光分光光度计(上海精密科学仪器有限公司),日立CR21G高速冰冻离心机(日本HITACHI公司),GC-8900气相色谱仪(滕州市经纬分析仪器有限责任公司)。
1.1.4 材料 TLC铝板(silica gel 60 F254,德国Merck公司)。
1.2 方法
1.2.1 培养基的配制 ①斜面培养基:牛肉膏5 g,蛋白胨10 g,NaCl 5 g,琼脂20 g,去离子水定容至1 000 mL,pH 7.0;②种子培养基:牛肉膏5 g,蛋白胨10 g,NaCl 5 g,去离子水定容至1 000 mL,pH 7.0;③发酵培养基:KH2PO43.4 g,Na2HPO41.5 g,(NH4)2SO44 g,MgSO4·7H2O 0.7 g,酵母粉0.2 g,液体石蜡17 g,去离子水定容至1 000 mL;④碳源发酵培养基:NaCl 10 g,NH4Cl 0.5 g,KH2PO40.5 g,K2HPO41 g,MgSO4·7H2O 0.5 g,CaCl20.02 g,KCl 0.1 g,FeCl2·H2O 0.002 g,碳源2 g,去离子水定容至1 000 mL,pH 7.0。碳源分别为葡萄糖、木糖、蔗糖、淀粉、纤维素、液体石蜡。生理生化试验所用培养基均参考文献[11-16]。以上培养基的灭菌条件均为121 ℃,20 min。其中,蔗糖溶液通过0.45 μm水系微孔滤膜过滤除菌。
1.2.2 菌种活化 保存菌种接种在斜面培养基中,60 ℃静置培养24 h。
1.2.3 种子液的制备 在液体种子培养基中接入活化的菌种2环/100 mL,60 ℃静置培养24 h。
1.2.4 碳源对菌株ZY-3生长及产生物表面活性剂的影响 将种子液按5%(体积分数)接种量接种到含有不同碳源的碳源发酵培养基中,60 ℃静置培养7 d,每24 h取样,测定发酵液菌体密度和表面张力。
1.2.5 pH对菌株ZY-3生长及产生物表面活性剂的影响 用0.1 mol/L柠檬酸和0.2 mol/L磷酸氢二钠将发酵培养基的初始pH分别调至4.0、5.0、6.0、7.0、8.0。将种子液按5%(体积分数)接种量接种到不同初始pH的发酵培养基中,60 ℃静置培养7 d,每24 h取样,测定发酵液菌体密度和乳化活性。
1.2.6 不同液体菌种与发酵液组合培养对ZY-3发酵的影响 用含0.2%(质量分数)淀粉和不含淀粉的种子培养基培养ZY-3,将种子液按5%(体积分数)的接种量分别接种到初始pH 6.0的以1.7%(质量分数)淀粉或液体石蜡为碳源的发酵培养基中,60 ℃静置培养7 d,每24 h取样,测定发酵液菌体密度、表面张力和乳化活性。
1.2.7 测定方法 ①发酵液处理:定性滤纸过滤除去发酵液残油,将滤液于3 000 g、4 ℃离心20 min,所得上清液用于测定表面张力、乳化活性;②表面张力测定:采用表面张力仪测定[12];③pH测定:采用精密pH计测定;④乳化活性测定:把1.5 mL无菌上清液与1 mL液体石蜡混匀,漩涡振荡5 min,静置24 h。乳化活性(%)=(乳化层高度/液体总高度)×100%[12];⑤菌体密度测定:采用比浊法[13]。把4 mL发酵液与0.5 mL TritonX-100(0.2%,质量分数)溶液混匀,于3 000 g、4 ℃离心20 min,弃上清,用去离子水恢复原体积,于600 nm测定菌悬液OD。
1.2.8 生物表面活性剂提取与分析 ①生物表面活性剂的提取:将除油发酵上清液和等体积的三氯甲烷/甲醇(2∶1,体积比)一起加入250 mL的分液漏斗中,手动摇匀200下,静置,待混合液分层后收集下层液体,重复操作3次。合并萃取相,于40 ℃旋转蒸发,除去有机相,得到生物表面活性剂粗品[14];②生物表面活性剂的定性分析:采用薄层色谱(TLC)对生物表面活性剂的成分进行鉴定,将生物表面活性剂粗品溶于氯仿中,点样于硅胶板上,用V(氯仿)∶V(甲醇)∶V(水)=65∶15∶2进行展层,当样品展到一定距离时,取出硅胶板,立即用吹风机吹干,分别进行以下操作:a.苯酚-硫酸显色:展层后的硅胶板直接喷上苯酚-硫酸显色剂,在105 ℃烘箱中加热5 min后,观察显色现象。b.茚三酮显色及原位酸水解-茚三酮显色:展层后的硅胶板一块直接喷上0.5%茚三酮显色剂,在105 ℃烘箱中加热5 min后,观察显色现象。另一块硅胶板放入装有2 mL浓盐酸的密闭容器中105 ℃熏蒸2 h。盐酸挥发后用0.5%茚三酮显色剂显色,在105 ℃烘箱中加热5 min后,观察显色现象[15];③生物表面活性剂带电性分析:a.阴离子生物表面活性剂检测方法:把5 mL除油发酵上清液与2倍体积亚甲基蓝溶液(0.003%,质量分数)和等体积的氯仿混合,充分振荡后,氯仿层呈蓝色则说明发酵液中的生物表面活性剂为阴离子[16]。b.阳离子生物表面活性剂检测方法:把5 mL除油发酵上清液与2~5滴溴酚蓝溶液(0.04%,质量分数)混合,充分振荡后,发酵上清液和溴酚蓝混合溶液呈深蓝色则说明该发酵液中的生物表面活性剂为阳离子[16]。
2 结果与分析
2.1 菌株ZY-3的初步鉴定及其所产生物表面活性剂的定性分析
显微观察分离纯化后的菌株ZY-3为杆状,6 μm×0.8 μm。生理生化鉴定结果:革兰染色阳性,产过氧化氢酶,不产H2S,M.R.反应阳性,V.P.反应阴性,还原硝酸盐,牛奶石蕊褪色凝固,脲酶阴性,能水解淀粉,不水解酪素,不液化明胶,能同化葡萄糖、甘油、蔗糖和甘露醇。根据参考文献[11-17],初步鉴定菌株ZY-3为芽胞杆菌属(Bacillus)。
经TLC定性分析,只有苯酚-硫酸显色时出现棕色斑点,茚三酮显色及原位酸水解-茚三酮显色均未出现显色反应,说明菌株ZY-3所产生物表面活性剂为糖脂类,结合带电性分析,为糖脂类阴离子表面活性剂。
2.2 单糖和二糖对菌株ZY-3生长和发酵液表面张力的影响
由图1可知,菌株ZY-3以葡萄糖、木糖和蔗糖为碳源的发酵液表面张力总体呈震荡下降趋势,且在发酵前期下降速度快。在以葡萄糖为碳源的发酵培养基中生长量最小,发酵1 d后菌体总量变化不大,OD600保持在0.3左右。发酵第5天的发酵液表面张力降至最低值54.5 mN/m,降低了24.3%。可能是菌体到达稳定期后更易积累生物表面活性剂。在木糖和蔗糖发酵培养基中的生长趋势一致,利用木糖为碳源菌体生长较快,而且发酵液表面张力总体水平较低,表面张力的降低意味着产生了生物表面活性剂。结果表明,菌株ZY-3利用木糖生长良好,产生物表面活性剂较稳定;利用葡萄糖虽然生长较弱,但产生物表面活性剂能力较强;利用蔗糖生长较慢,但生长量较多,产生物表面活性剂不够稳定。
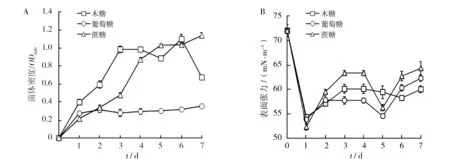
图1 菌株ZY-3利用单糖和二糖的发酵液菌体密度及表面张力变化Fig.1 Change of cell density and surface tension of fermentation broth by strain ZY-3 on mono-and di-sacchacharidesA:发酵液菌体密度变化情况;B:发酵液表面张力变化情况,图2同A:cell density of fermentation broth;B:surface tension of fermentation broth,Figure 2 with
2.3 多糖对菌株ZY-3生长和发酵液表面张力的影响
由图2可知,菌株ZY-3以淀粉、纤维素、葡萄糖为碳源时,发酵第1天,发酵液表面张力均明显降低,随后呈震荡下降趋势,菌体生长趋势基本一致,且菌体生长量相对较小。在纤维素发酵培养基中菌体生长量最小,发酵液表面张力降低幅度最小,为17.4%;而淀粉发酵培养基中菌体生长量最大,发酵液表面张力降低幅度最大,为27.1%。以淀粉和葡萄糖为碳源的发酵液表面张力降低的较多,在发酵后期表面张力升高,可能是生物表面活性剂被菌体分解或利用。
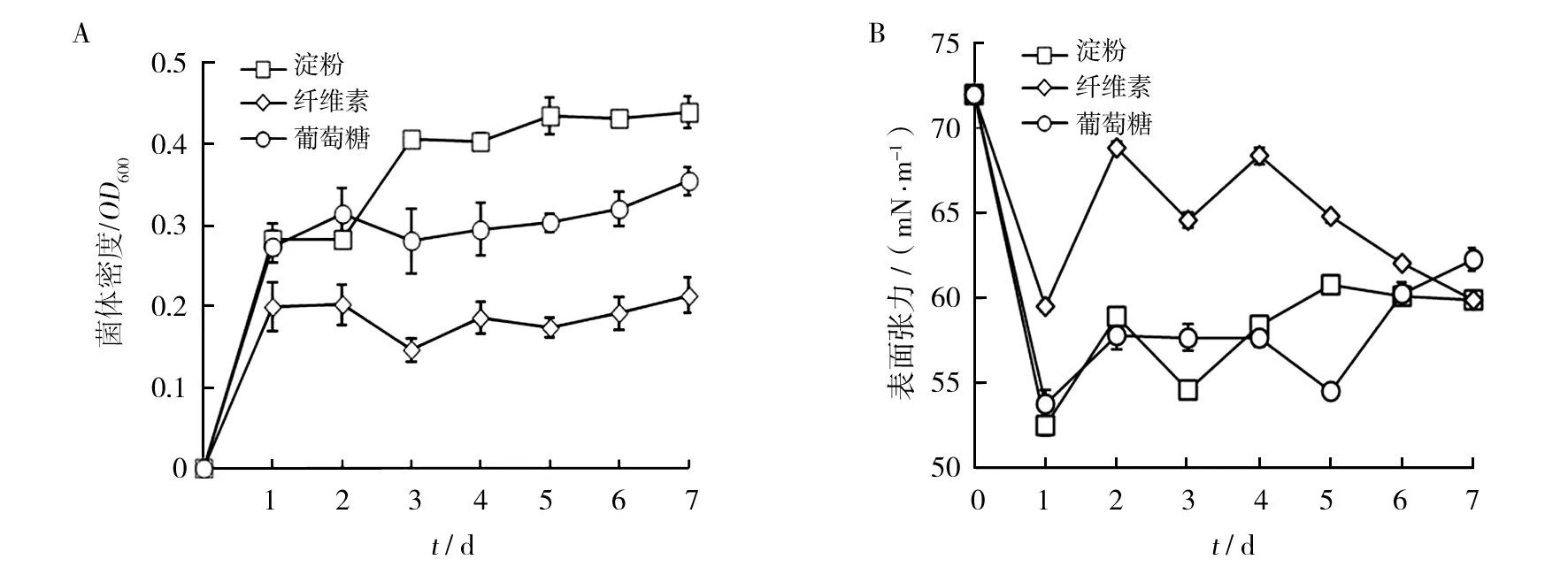
图2 菌株ZY-3利用多糖和单糖的发酵液菌体密度及表面张力变化的比较Fig.2 Comparison of change of cell density and surface tension of fermentation broth by strain ZY-3 on polysaccharides and monosacchacharides
2.4 pH对菌株ZY-3的生长和发酵液乳化活性的影响
由图3A可知,菌株ZY-3在初始pH 4.0的发酵培养基中菌体生长缓慢且菌体生长量小;在初始pH 5.0的发酵培养基中虽然在发酵初期生长较少,但在第2天迅速生长到最大,随后菌体量略有减少,但变化不大;在初始pH 6.0的发酵培养基中菌体却表现稳步生长,发酵到第5天接近最大生长量。在初始pH 7.0的发酵培养基中发酵1 d达到较大生长后,菌体量增长较小。可见,发酵培养基的初始pH对菌株的生长影响显著,初始pH 5.0时有利于菌体生长。
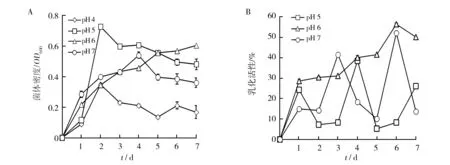
图3 菌株ZY-3在不同初始pH的发酵液菌体密度及乳化活性变化Fig.3 Change of cell density and emulsifying activity of fermentation broth by strains ZY-3 at various initial pH valuesA:发酵液菌体密度变化情况;B:发酵液乳化活性变化情况A:cell density of fermentation broth;B:emulsifying activity of fermentation broth
由图3B可知,菌株ZY-3在不同初始pH条件下,发酵前期的发酵液乳化活性相差较小,初始pH 5.0的发酵液在发酵初期虽较高,但不稳定,起伏变化较大。初始pH 6.0的发酵液乳化活性稳步升高,发酵第6天达到最大值56.25%,而且在整个发酵过程中都处于较高水平。初始pH 7.0的发酵液在发酵初期乳化活性较低,且在整个过程中起伏变化较大。发酵液具有乳化活性意味着产生了生物表面活性剂。可见,菌体生长与乳化活性的变化不完全一致,在初始pH 6.0时合成生物表面活性剂较稳定。
2.5 不同液体菌种与发酵液组合培养对ZY-3发酵的影响
由图4、图5和图6可知:①在含有淀粉的种子培养基和发酵培养基组合下培养,随培养时间增加,菌体数量增加,发酵液的表面张力逐渐下降,乳化活性也逐渐增大。该组合的菌体生长量最大,发酵液表面张力降得较低,降低的速度较快,发酵第7天降至最低值53.1 mN/m,降低了26.3%,降低幅度接近于石蜡发酵培养基的发酵液表面张力。发酵液乳化活性较大,发酵第7天达到最大值24%。②在无淀粉种子培养基和有淀粉的发酵培养基组合下培养,随培养时间增加,菌体数量增加,发酵液表面张力逐渐降低,乳化活性呈波动态增大趋势。此组合的菌体生长量较大,发酵液表面张力降低最慢,发酵第7天降至最低值55.1 mN/m,降低了23.5%。发酵液乳化活性最低,发酵第7 天达到最大值18%。③在无淀粉的种子培养基和发酵培养基组合下培养,发酵前期,菌体生长缓慢,发酵液的表面张力明显减小,乳化活性逐渐增大。发酵5 d,乳化活性提高的同时,菌体数量明显增多,说明乳化剂的产生有助于菌体利用液体石蜡进行生长。该组合的菌体生长较少,但发酵液表面张力降低最快,发酵第7 天降至最低值51.1 mN/m,降低了29%。发酵液乳化活性最高,发酵第7 天达到最大值49%。
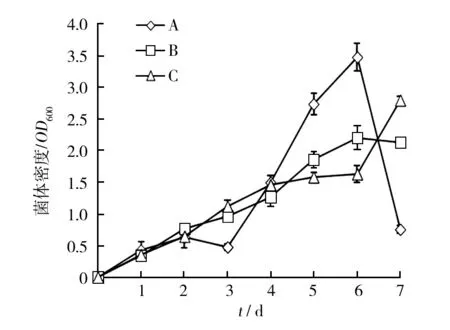
图4 不同培养组合的发酵液菌体密度变化Fig.4 Change in cell density of fermentation broth by various cultures combinationA:种子培养基和发酵培养基均有淀粉;B:种子培养基无淀粉和发酵培养基有淀粉;C:种子培养基和发酵培养基均无淀粉,图5、6同A:the media for inocula and fermentation with starch;B: the media for inocula without starch, the media for fermentation with starch;C:the media for inocula and fermentation without starch,Figure 5,6 with

图5 不同培养组合的发酵液表面张力变化Fig.5 Change in surface tension of fermentation broth by various combination cultures
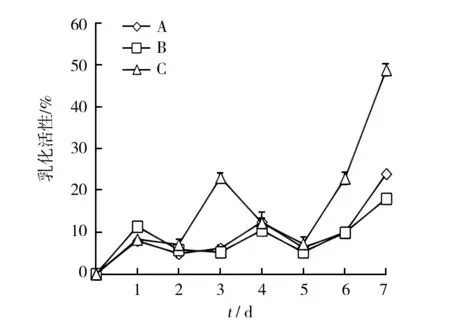
图6 不同培养组合的发酵液乳化活性变化Fig.6 Change in emulsification activity of fermentation broth by various combination cultures
3 讨 论
菌株ZY-3被初步鉴定为芽胞杆菌属(Bacillus),产糖脂类阴离子表面活性剂,能降低发酵液的表面张力和乳化液体石蜡。冯蕾等[18]也分离到同属的菌株,在油井中应用可使稠油黏度(25 ℃)下降25.2%~70.6%。有研究表明,酸可有效地溶解储油岩层孔隙中沉积的碳酸盐,增大油层的孔隙度和渗透率。而H2S为有毒有害气体,会造成油井和油田管线腐蚀。能还原硝酸盐说明可以利用硝酸盐代替分子氧作为受氢体进行无氧呼吸,保证在缺氧的油藏环境能生长和代谢[18-19]。本研究中,菌株ZY-3具有产酸、不产H2S、还原硝酸盐等特性,这些特性有助于菌株ZY-3应用于微生物采油。菌株ZY-3在以淀粉为碳源、初始pH 6.0的培养基中发酵,产生物表面活性剂多且稳定。这与向培养基中添加淀粉、木糖更有利于AcinetobacterBHSN生长和合成生物表面活性剂的结果一致[20]。在种子培养基和发酵培养基中都有淀粉的条件下,菌株ZY-3生长较多,乳化和降低表面张力的作用均较强,所产生物表面活性剂可以使发酵液的表面张力从72.1 mN/m降到53.1 mN/m,乳化活性从0升高到24%。以液体石蜡为碳源,发酵液乳化活性高,这样有助于菌株利用液体石蜡,而以淀粉为碳源,菌体生长量大,表面张力却与液体石蜡碳源的接近,发酵液乳化活性较低,这样就不利于乳化原油中的低分子量组分并进一步利用原油,可以减少菌株对原油的利用,达到更多采油的目的。本研究结果表明,采用种子培养基和发酵培养基中均有淀粉的组合更有利于微生物采油。Mohammad等[21]向接种GeobacillustoebiiR-32639的模拟微生物采油模型中注入淀粉等营养剂,可使原油表面张力降低25.3%,黏度降低14.1%,增强原油在岩石孔隙间的流动性,提高原油采收率。比较可知,菌株ZY-3以淀粉为碳源发酵的表面张力降低水平与之相近,结合该菌株产酸、不产H2S、还原硝酸盐等特性,可推断菌株ZY-3具有应用于微生物采油的潜力。本研究只对ZY-3进行初步鉴定,今后还将分析16S rDNA序列和全细胞脂肪酸组成,进一步鉴定菌种,并加强其对采油的应用研究,为微生物采油提供依据。
[1] 孔祥平.一株地衣芽胞杆菌在模拟油藏环境下的生长和运移[D].青岛:中国海洋大学, 2007.
[2] Tang X, Zhu Y, Meng Q.Enhanced crude oil biodegradability ofPseudomonasaeruginosaZJU after preservation in crude oil-containing medium[J].World Journal Microbiol Biotechnol, 2007, 23(1):7-14.
[3] Liu JF, Ma LJ, Mu BZH, et al.The field pilot of microbial enhanced oil recovery in a high temperature petroleum reservoir[J].Journal of Petroleum Science and Engineering, 2005, 48(2):265-271.
[4] Randhir S.Utilization of molasses for biosurfactant production by twoBacillusstrains at thermophilic conditions[J].Journal of the American Oil Chemists Society, 1997, 74:887-889.
[5] 郝东辉.采油微生物筛选鼠李糖脂产脂性能及关键酶基因克隆与表达研究[D].济南:山东大学, 2008.
[6] 伍晓林.BrevibacillusBrevis和BacillusCereusMEOR机制的研究及在大庆油田的应用[D].无锡:江南大学, 2005.
[7] Bailey SA, Kenney TM, Schneider D.Microbial enhanced oil recovery: diverse successful applications of biotechnology in the oil field[J].SPE J, 2001,20(1):1-9.
[8] 周德庆.微生物学教程(第2版)[M].北京:高等教育出版社, 2004: 82-83.
[9] Jenneman GE, Moffitt PD, Young GR.Application of a microbial selective plugging process at the morth burbank unit:Prepilot tests[J].SPE Production and Facilities, 1996, 14(2):11-17.
[10]郭辽原, 张玉真, 杨年文, 等.邵家油田沾3块内源微生物驱激活剂优化及现场试验[J].油气地质与采收率, 2012, 19(1):79-81.
[11]周德庆.微生物学实验教程(第2版)[M].北京:高等教育出版社, 2006.
[12] Nitschke M, Pastore GM.Production and properties of a surfactant obtained fromBacillussubtilisgrown on cassava wastewater[J].Bioresource Technology, 2006, 9(7):336-341.
[13]吉本斯.伯杰氏细菌鉴定手册(第8版)[M].北京:科学出版社, 1984.
[14]包木太.采油微生物的代谢过程[J].化学研究与应用, 2003, 15(4):555-557.
[15]张天胜.生物表面活性剂及其应用[M].北京:化学工业出版社, 2005:238-239.
[16]诸葛健.工业微生物资源开发应用与保护[M].北京:化学工业出版社, 2002.
[17]周德庆.微生物学实验手册[M].上海:上海科学技术出版社, 1983:137-163.
[18]冯蕾, 杨新平, 陈竞, 等.几株采油微生物生理生化特性研究、菌种鉴定及初步评价[J].油田化学, 2005, 4(2):370-374.
[19]王红波, 代学成, 张群志, 等.采油微生物生理生化特征研究[J].石油钻采工艺, 2008, 3(4):120-123.
[20]曹娟, 徐志辉, 李凌之.产生物表面活性剂的石油降解菌AcinetobacterBHSN的研究[J].生态与农村环境学报,2009, 7(1):73-78.
[21]Mohammad Fulazzaky, Dea Indriani Astuti, Mohamad Ali Fulazzaky.Laboratory simulation of microbial enhanced oil recovery usingGeobacillustoebiiR-32639 isolated from the Handil reservoir[J].RSC Advances, 2015, 5(5):3908-3916.
Characterizations of a Thermotolerant Bio-Surfactant Producing Bacterium
YOU He, ZHANG Li-min, LUAN Jing, SUN Yu-mei
(Coll.ofBio-Engin.,DalianPolytechnicUni.,Dalian116034)
The physiobiochemical characteristics of a thermotolerant bacterium strain ZY-3 and characteristics of bio-surfactant produced by the strain were studied. The impact of different carbon sources on cell growth and bio-surfactant production of strain ZY-3 was also studied by measuring the cell density and surface tension and emulsification activity in the fermentation broth. The bio-surfactant produced was initially isolated and analyzed accordingly. The strain ZY-3 was primarily identified as the genusBacillus, it had the features of producing acid and reduce nitrates, but not produce H2S. When strain ZY-3 was fermented in a medium with starting pH at 6.0 and starch as carbon source, more and stable bio-surfactants were produced. When the media for seed and fermentation contained starch, the cell grew better, and the produced surfactant reduced surface tension and stronger emulsification, the produced bio-surfactant could reduced the surface tension of fermentation broth from 72.1 mN/m to 53.1 mN/m, and emulsification activity increased from 0 to 24%. It was judged initially that the product was glycolipid anion surfactant.
bio-surfactant; thermotolerant strain ZY-3; carbon source
国家自然科学基金项目 (31371742)
尤贺 男,硕士研究生。研究方向为微生物代谢控制发酵。E-mail:716863212@qq.com
* 通讯作者。女,硕士,工程师。研究方向为微生物发酵工程。E-mail:luanjing@dlpu.edu.cn
2016-04-19;
2016-08-06
Q93
A
1005-7021(2017)03-0010-06
10.3969/j.issn.1005-7021.2017.03.002

