黑曲霉产木聚糖酶的分离纯化与鉴定研究
高月淑, 许敬亮, 袁振宏, 蒋剑春*, 何敏超, 张 宁
(1.中国林业科学研究院 林产化学工业研究所,江苏 南京 210042; 2.中国科学研究院 广州能源研究所, 广东 广州 510640)
黑曲霉产木聚糖酶的分离纯化与鉴定研究
高月淑1, 许敬亮2, 袁振宏2, 蒋剑春1*, 何敏超2, 张 宁1
(1.中国林业科学研究院 林产化学工业研究所,江苏 南京 210042; 2.中国科学研究院 广州能源研究所, 广东 广州 510640)
木聚糖酶的分离纯化是对其进行酶学研究和分子改良研究的基础。利用实验室选育的黑曲霉菌株AspergillusnigerSM24/a进行木聚糖酶发酵,粗酶液经过(NH4)2SO4分级沉淀Bio-Gel P6除盐、UNO sphere Q阴离子交换和Enrich SEC70凝胶色谱层析四个步骤的分离纯化,成功获得了3种木聚糖酶蛋白定义为X-Ⅰ、X-Ⅱ和X-Ⅲ。随着纯化步骤的增加,各组分酶比活力得到显著提高,其数值分别为37.41、34.56和53.96 U/mg,纯化倍数分别为3.96、3.66和5.72。经质谱分析和蛋白氨基酸序列比对,初步认定X-Ⅰ属于糖基水解酶第十家族内切-β-1,4-木聚糖酶,X-Ⅱ和X-Ⅲ均属于糖基水解酶第十一家族木聚糖酶。
黑曲霉;木聚糖酶;分离纯化;鉴定
植物半纤维素的主要组分是木聚糖, 主链由β-1,4-糖苷键连接吡喃型木糖残基构成。木聚糖主链的降解至少需要木聚糖酶(eno-xylanase, EC 3.2.1.8)和β-木糖苷酶(β-xylosidase,EC 3.2.1.37)协同作用,其中木聚糖酶作用于木聚糖主链骨架,将其降解为木寡糖,同时伴有少量木糖、阿拉伯糖和甘露糖,是降解木聚糖的关键酶[1-2]。另外,外切木聚糖酶(eno-xylanase, EC 3.2.1.37)对木聚糖到木糖的降解过程也有明显促进作用[3]。木聚糖酶可广泛应用于生物转化、食品、饲料、造纸等行业[4-6],尤其随着人们对生物质能源的关注,对包括木聚糖酶在内的纤维素酶系研究日益增多[7-9],木聚糖酶的分离纯化可以为其酶学性质及分子克隆研究奠定基础。本研究选用黑曲霉菌株AspergillusnigerSM24/a进行木聚糖酶发酵,通过(NH4)2SO4分级沉淀、Bio-Gel P6除盐、UNO sphere Q阴离子交换和Enrich SEC70凝胶色谱,分离纯化到3种木聚糖酶,并通过蛋白质谱与NCBI数据库比对,初步鉴定酶蛋白类型。
1 材料与方法
1.1 材料
1.1.1 试验菌株 黑曲霉AspergillusnigerSM24/a,由中国科学院广州能源研究所生物质生化转化实验室自行筛选,最高木聚糖酶活力可以达到9 100 U/g干曲。
1.1.2 试剂 BCA法蛋白定量试剂盒,购自北京百泰克生物技术有限公司。
1.2 方法
1.2.1 木聚糖酶活测定 取适当稀释的酶液0.5 mL,加入质量分数1% 的木聚糖溶液1 mL混匀,50 ℃保温30 min,用3,5-二硝基水杨酸(DNS)法测定还原糖(以木糖为标准)含量,以1 min释放1 μmol木糖的酶量为1个酶活力单位[10]。
1.2.2 (NH4)2SO4盐析分级沉淀 取100 mL木聚糖粗酶液置于冰浴中,按照不同饱和度缓慢加入(NH4)2SO4粉末,12 000 r/min冷冻离心15 min,用0.2 mol/L、pH为5.0的醋酸-醋酸钠缓冲液复溶沉淀,上清液继续追加到相应饱和度,重复磁力搅拌、冷冻、离心复溶步骤,至不再有沉淀产生为止。复溶的液体置于4 ℃冰箱中保藏备用。
1.2.3 Bio-Gel P6凝胶过滤除盐 取上述步骤浓缩后的1 mL蛋白清液上样至Bio-Gel P6层析柱中,以pH 5.0的醋酸-醋酸钠缓冲液平衡并洗脱,洗脱速度2 mL/min,收集对应各峰的蛋白酶液进行酶活性及蛋白含量的测定。
1.2.4 UNO sphere Q阴离子交换层析 将除盐浓缩后的1 mL蛋白清液上样于经醋酸-醋酸钠缓冲液(pH 5.0)平衡好的UNO sphere Q阴离子交换柱,A液用醋酸-醋酸钠缓冲液(pH 5.0)作为起始缓冲液,B液用外加1 mol/L NaCl的醋酸-醋酸钠缓冲液(pH 5.0)作为洗脱缓冲液,按照0~1 mol/L NaCl线性梯度洗脱蛋白质,洗脱速度2 mL/min,收集所有出峰酶液,对其进行酶活性及蛋白含量的测定。
1.2.5 Enrich SEC70凝胶排阻层析 将经过阴离子交换层析初步纯化后的0.25 mL蛋白清液上样于经醋酸-醋酸钠缓冲液(pH 5.0)平衡好的Enrich SEC70凝胶柱中,洗脱速度1.5 mL/min,收集所有出峰酶液,对其进行酶活性及蛋白含量的测定。
1.2.6 SDS-PAGE蛋白电泳 采用SDS-PAGE不连续垂直凝胶电泳,电极液采用Tris-甘氨酸缓冲体系,分离胶缓冲液pH 8.8,浓度为10%,浓缩胶缓冲液pH 6.8,浓度为5%,70 V恒压电泳2.5 h[11]。
1.2.7 木聚糖酶酶谱分析 琼脂糖板的制备:准确称取20 mg木聚糖、400 mg琼脂,溶于20 mL蒸馏水中,电炉加热溶解后,灌入已预热到60 ℃左右模板中,冷凝后去掉玻璃板即得木聚糖胶板。在样品制备、分离胶、buffer中不加SDS与巯基乙醇。采用1.2.6中电泳操作方式进行凝胶活性电泳后,将凝胶铺在含木聚糖的胶板上,50 ℃恒温箱中保温1 h。电泳胶进行染色、脱色,木聚糖胶用0.1%刚果红染色0.5 h后,再用1 mol/L NaCl漂洗脱色、扫描仪扫描成像[12]。
1.2.8 蛋白质谱检测 利用德国布鲁克(Bruker Dalton)Autoflex speedTMMALDI-TOF-TOF质谱仪进行质谱分析。UV波长为355 nm,重复速率为200 HZ,加速电压为20 000 V,最优质量分辨率为1 500 Da。扫描质量范围为700~3 200 Da,收集信号。胰酶自切峰为内标校正质谱仪。利用软件flexAnalysis(Bruker Dalton)过滤基线峰、识别信号峰。利用BioTools(Bruker Dalton)软件搜索NCBI数据库,寻找匹配的相关蛋白质,具体操作由广州辉骏生物科技有限公司完成。
2 结果与分析
2.1 木聚糖酶谱和PAGE图谱
黑曲霉菌株SM24/a木聚糖酶酶谱如图1所示。该菌株所产粗酶液蛋白条带复杂,但经木聚糖凝胶板孵育后,木聚糖酶谱图上有3条清晰的透明条带即木聚糖酶条带,可以推断该粗酶液中至少有3种木聚糖酶,按照分子量大小依次命名为X-Ⅰ、X-Ⅱ、X-Ⅲ。
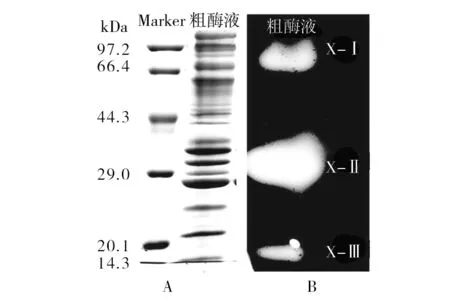
图1 木聚糖酶SDA-PAGE(A)和活性酶谱(B)分析Fig.1 SDS-PAGE(A) and Zymogram(B) of culture filitrate
2.2 硫酸铵分级沉淀
沉淀用0.2 mol/L、pH为5.0的醋酸-醋酸钠缓冲液复溶到10 mL,测定其木聚糖酶活力以及蛋白量。随着硫酸铵饱和度的增加,沉淀中的蛋白量以及木聚糖酶活力都呈现先升高后降低的趋势。当硫酸铵饱和度低于40%时,酶活力和蛋白量都很低;当饱和度在50%~70%时,沉淀中蛋白量以及木聚糖酶活力达到最高;当饱和度高于70%时,蛋白量继续增加但是酶活力却明显下降,说明在此饱和度下杂蛋白开始逐渐增多;当饱和度超过80%时,蛋白量比例继续增大,酶活力降得很低。为了提高蛋白纯化的效果和得率,确定最佳硫酸铵饱和度为40%~80%。
2.3 Bio-Gel P6脱盐
经硫酸铵分级沉淀后酶液脱盐结果如图2所示。由于蛋白分子量较大,在经过Bio-Gel P6脱盐柱时,只是在填料颗粒间隙中流动,所以很快被洗脱下来,而小分子物质和盐则会通过大量微孔,需在柱内停留更长的时间才被逐渐洗脱。图2中有两个主要的峰,大部分酶蛋白在第一管A1中洗脱下来,此时电导率较低,而小分子的盐逐渐在后面洗脱,电导率逐渐升高后降低。
2.4 UNO sphere Q阴离子交换层析
脱盐后的酶液经过阴离子交换层析的洗脱图谱如图3所示。图3中出现3个比较明显的洗脱峰,取A1、A9 和A14管,分别记为Q1、Q9和Q14,进行酶谱和凝胶电泳检测,结果见图4、5。
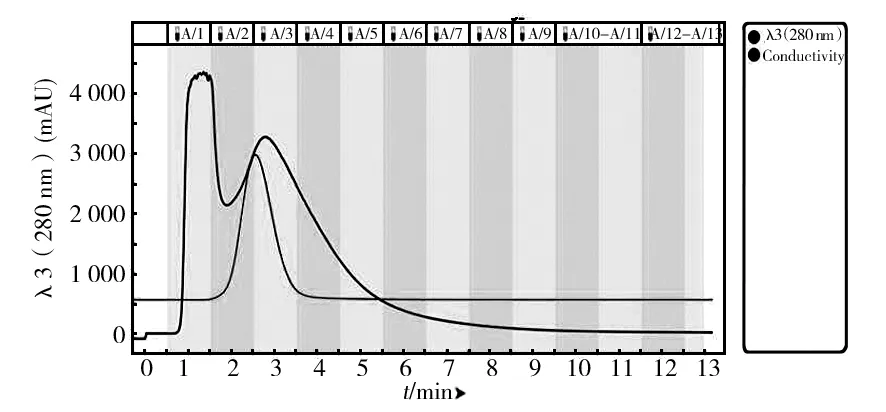
图2 Bio-Gel P6 脱盐图谱Fig.2 Bio-Gel P6 desalting chromatogram
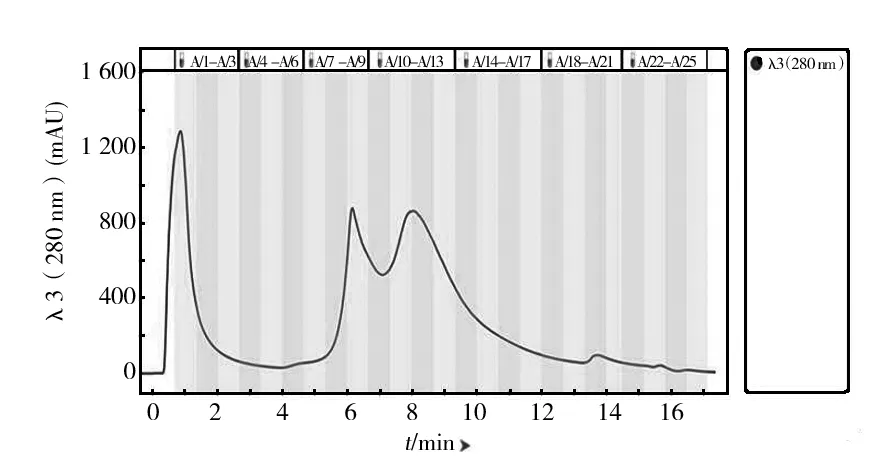
图3 UNO sphere Q 阴离子交换层析图谱Fig.3 UNO sphere Q ion exchange chromatogram
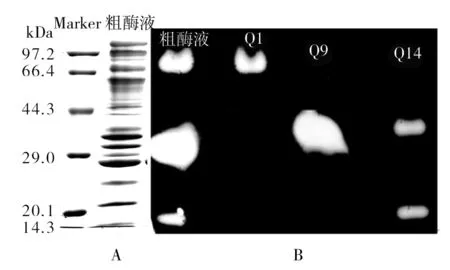
图4 木聚糖酶SDA-PAGE(A)和离子交换后组分活性酶谱分析(B)Fig.4 SDA-PAGE (A) and Zymogram (B) of xylanases seperated by ion exchange chromatogram
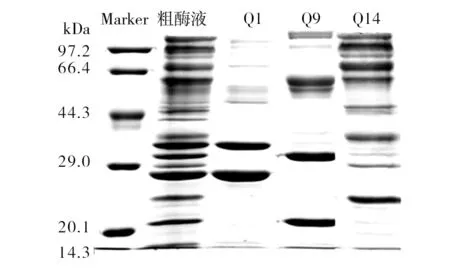
图5 离子交换后组分SDS-PAGE图谱Fig.5 SDS-PAGE of different compositons seperated by ion exchange chromatogram
从图4的活性酶谱分析可以看出,Q1与Q9分别含有一个木聚糖酶蛋白分子X-Ⅰ与X-Ⅱ,Q14中含有两个木聚糖酶蛋白,其中一个分子量大小与X-II相近,推断二者为同一蛋白,而另一个木聚糖酶蛋白分子为X-III。同时图5中SDS-PAGE结果显示这三个洗脱峰中含有其他杂带,因此,为达到纯化分离效果需进一步的色谱层析。
2.5 Enrich SEC70(10×300)凝胶色谱层析
凝胶过滤层析是根据蛋白质分子大小不同而达到分离效果,高分子量的蛋白质在填料颗粒间隙中流动,比小分子量蛋白更早被洗脱下来。为了实现进一步的分离纯化,对Q1、Q9和Q14中的酶液进行凝胶色谱层析,结果如图6、7和8所示,Q1蛋白成分相对简单,得到两个主要的峰,记为Q1-S11和Q1-S12;Q9中出现3个峰,取对应的洗脱液记为Q9-S5、Q9-S7和Q9-S8,Q1和Q9都很好地实现了基线分离;Q14的蛋白成分复杂,前面几个峰相互重叠,仅取最后一个单一峰记为Q14-S13,同时将所有出峰位置对应洗脱液组分收集进行酶活测定,最后测得Q1-S12、Q9-S8和Q14-S13三个组分有木聚糖酶活力。将这3个组分进行木聚糖酶谱和SDS-PAGE验证,结果如图9和10所示,在Q1-S12、Q9-S8和Q14-S13中获得纯度较高的不同蛋白条带,分别对应粗酶液酶谱上的木聚糖酶蛋白分子X-Ⅰ、X-Ⅱ和X-Ⅲ。
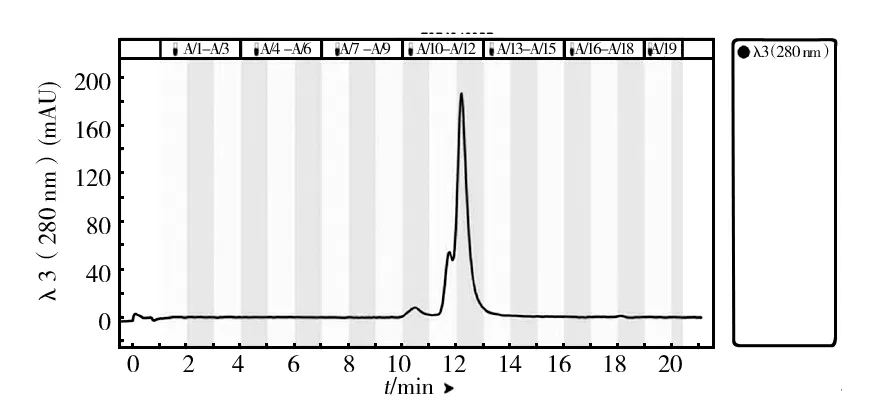
图6 Q1 样品的Enrich SEC70凝胶色谱图Fig.6 Enrich SEC70 size exclusion chromatogram of Q1
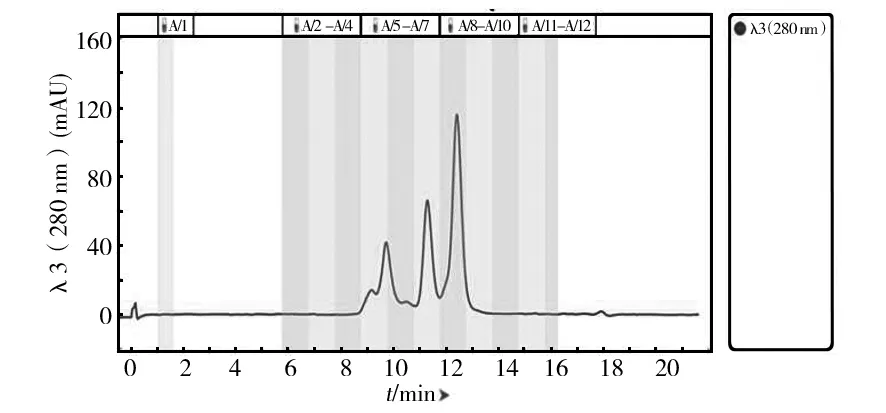
图7 Q9 样品的Enrich SEC70凝胶色谱图Fig.7 Enrich SEC70 size exclusion chromatogram of Q9

图9 Q1-S12、Q9-S8和Q14-S13木聚糖酶活性酶谱Fig.9 Xylanase zymogram of Q1-S12、Q9-S8 and Q14-S13

图10 Q1-S12、Q9-S8和Q14-S13SDS-PAGE图谱Fig.10 SDS-PAGE of Q1-S12、Q9-S8 and Q14-S13
2.6 3种木聚糖酶的质谱检测
将纯化后的3条木聚糖条带从电泳胶板切下,进行蛋白质谱检测,利用BioTools(Bruker Dalton)软件搜索NCBI数据库,寻找匹配的相关蛋白质,明确鉴定的蛋白质类型。质谱所得肽段与多肽蛋白数据库中已知蛋白质的氨基酸序列比对,发现X-I蛋白与AspergilluskawachiiIFO 4308、AspergillusnigerCBS 513.88等菌株所产木聚糖酶系中内切-β-1, 4木聚糖酶同源性较高,属于糖基水解酶中的第10家族;X-Ⅱ蛋白与Aspergillusniger某些菌株所产木聚糖酶系中木聚糖酶同源性较高,属于糖基水解酶中的第11家族;X-Ⅲ蛋白与Aspergillusniger某些菌株所产木聚糖酶系中木聚糖酶同源性较高,属于糖基水解酶中的第11家族。
2.7 纯化回收率的计算
通过几种纯化方法的结合可以顺利实现粗酶液整个纯化过程。将100 mL粗酶液各个纯化步骤所得组分用标准曲线法和DNS法分别进行蛋白质和酶活力的测定,比酶活、纯化倍数及回收率结果见表1。分析表中数据可知,(NH4)2SO4分级沉淀会造成部分木聚糖酶蛋白损失,同时也有一定纯化效果,经过分级沉淀后木聚糖酶纯化倍数为1.8倍。经过Bio-Gel P6脱盐步骤,蛋白损失相对较少,沉淀后的酶液获得进一步的纯化,纯化倍数为2.13倍。经过阴离子柱UNO sphere Q和凝胶色谱柱Enrich SEC70后,各个收集管中的木聚糖酶蛋白组分得到更进一步的提纯。由于粗酶液中还有其他内切酶组分,而实验只选取其中酶活较高、杂蛋白较少的组分进行重点分析,其他组分均被去除,酶的损失很大。分离纯化后获得了3种木聚糖酶组分,各组分酶比活力得到显著提高,其数值分别为37.41、34.56和53.96 U/mg,其纯化倍数分别为3.96、3.66和5.72。同时单一酶组分的回收率均较低下,这与覃拥灵等[13]和杨云龙等[14]纯化结果相似,其原因可能是由于纯化过程操作步骤较繁琐,导致木聚糖酶部分失活[15-16]。
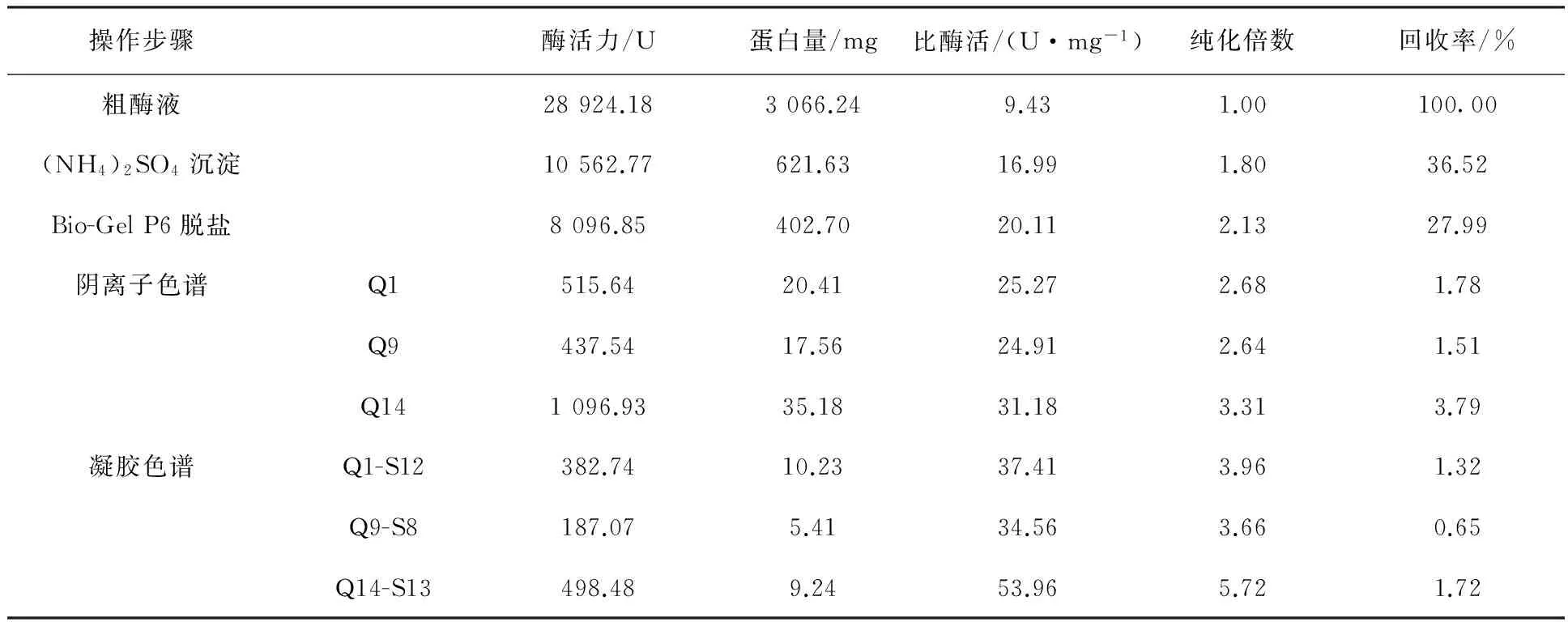
表1 Aspergillus niger SM24/a的木聚糖酶纯化结果
3 讨 论
本文研究了黑曲霉AspergillusnigerSM24/a所产木聚糖酶的纯化体系,经过饱和度40%~80% (NH4)2SO4沉淀、Bio-Gel P6除盐、UNO sphere Q阴离子交换和Enrich SEC70凝胶色谱层析,成功实现了其粗酶液中3种木聚糖酶蛋白X-Ⅰ、X-Ⅱ和X-Ⅲ的分离纯化。经过质谱分析和蛋白氨基酸序列比对,初步认定X-Ⅰ属于糖基水解酶第十家族内切-β-1, 4木聚糖酶,X-Ⅱ和X-Ⅲ均属于糖基水解酶第十一家族木聚糖酶。研究结果为研究其酶学性质和分子改良提供材料,同时为进一步利用该酶进行木质纤维素酶解及低聚木糖制备奠定基础。

·写作常识·
本刊常用的计量单位
为了更好地执行国务院发布的《关于在我国统一实行法定计量单位的命令》的规定,根据国标(GB3100~3102-93)标准,单位符号一般用英文小写(正体),来源于人名的单位,其符号的首字母大写,只有体积单位升例外,它的符号用“L,(l)”,推荐采用L。现将本刊常用计量单位符号及与之容易混淆的符号介绍如下,希望作者参照执行。
时间:年用a,不用y,yr;星期、周(无符号),不用wk;月(无符号),不用mo;日用d,不用day;小时用h,不用hr;分钟用min,不用m;秒用s,不用sec表示。
溶液浓度:用mol/L,不用M(克分子浓度)和N(当量浓度)等非许用单位表示。
百分浓度:务必注明是重量百分浓度,还是体积百分浓度。
面积:公顷用hm2,不用ha,亩或公亩,换算因数为 1hm2=15亩。
旋转速度:用r/min,×g,不用rpm。
蒸汽压力:用Pa或kPa、MPa表示,不用大气压at,kg/m2或kg/cm2等。
光密度:用OD(斜体)表示。
生物大分子的分子量:蛋白质用u或ku,核酸用bp或kb表示。
Isolation, Purification, and Identification of Xylanase fromAspergillusnigerSM24/a
GAO Yue-shu1, XU Jing-liang2, YUAN Zhen-hong2, JIANG Jian-chun1, HE Min-chao2, ZHANG Ning1
(1.Inst.ofChem.Indust.ofForestProducts,ChineseAcad.ofForestry,Nanjing210042; 2.GuangzhouInst.ofEnergyConvers'n,ChineseAcadofSci.,Guangzhou510640)
Separation and purification of xylanase are the base of carrying out its enzymological study and molecular improvement. Xylanase fermentation was carried out usingAspergillusnigerSM24/a bred in the lab. The crude enzyme solution was fractionally precipitated with (NH4)2SO4, desalinated by Bio-Gel P6, separated and purified with UNO sphere Q anion exchange and Enrich SEC70 gel chromatography, these four steps, and successfully obtained three kinds of xylanase, and named as X-I, X-II, and X-III. As the increment of purification steps, the specific activity of each component was significantly improved, their numerical value respectively were 37.41 U/mg, 34.56 U/mg and 53.96 U/mg, and the purification folds were 3.96, 3.66, and 5.72 respectively. Through mass spectrometry and amino acid sequence comparison, it was initially confirmed that X-I belonged to endo-β-1,4-xylanase of glycosyl hydrolase family 10, and both X-II and X-II belonged to xylanase of glycosyl hydrolase family 11.
Aspergillusniger; xylanase; separation and purification; identification
江苏省自然科学基金项目(BK20160150);中国林科院林业新技术所基本科研业务费专项(CAFYBB2017SY034);
中国科学院可再生能源重点实验室开放基金项目(y507k71001)
高月淑 女,助理研究员,博士。主要从事生物质生化转化技术研究。Tel:025-85482436,E-mail:gaoyueshu2199@163.com
2016-07-13;
2016-09-09
Q554
A
1005-7021(2017)03-0016-06
10.3969/j.issn.1005-7021.2017.03.003
* 通讯作者。男,博士,研究员,博士生导师。主要从事林产化学工业加工和生物质能源开发技术研究。Tel:025-85482488,
E-mail:bio-energy@163.com

