等离子体法诱变淡紫拟青霉产几丁质酶菌种的筛选
谷 军, 张晓彦*, 孟利强,3, 沙长青
(1.黑龙江省科学院 微生物研究所,黑龙江 哈尔滨 150010;2.黑龙江省科学院,黑龙江 哈尔滨 150001;3.哈尔滨工业大学,黑龙江 哈尔滨 150090)
等离子体法诱变淡紫拟青霉产几丁质酶菌种的筛选
谷 军1, 张晓彦1*, 孟利强1,3, 沙长青2
(1.黑龙江省科学院 微生物研究所,黑龙江 哈尔滨 150010;2.黑龙江省科学院,黑龙江 哈尔滨 150001;3.哈尔滨工业大学,黑龙江 哈尔滨 150090)
采用菌株诱变技术,提高生防用淡紫拟青霉菌株产几丁质酶的能力。通过常温常压等离子体诱变技术(MPMS)对淡紫拟青霉进行诱变育种处理,对处理的菌种先采用透明圈法进行初筛,然后采用发酵方法进行复筛。采用MPMS法诱变淡紫拟青霉产几丁质酶菌种时,温度25 ℃,处理时间30 s,样品处理量60 μL,诱变菌的致死率为30.33%时,正突变率为14%。采用摇瓶分批发酵培养,诱变菌种的几丁质酶活为0.17 U/mL。结果表明,经过对淡紫拟青霉的诱变处理,获得高活性几丁质酶产生菌株,几丁质酶酶活提高180%。
淡紫拟青霉;诱变育种;等离子体法诱变育种技术
根结线虫(Meloidogynespp.)是农作物的一种主要害虫,它分布广,对许多经济作物造成严重危害[1],由于化学杀虫剂造成农产品的农药残留和环境污染 ,根结线虫病害的生物防治受到越来越广泛的重视。淡紫拟青霉(Paecilomyceslilacinus)是线虫卵的寄生真菌,被认为是最具有应用前景的线虫生防真菌[2-4],而淡紫拟青霉防治根结线虫,起主要作用的是该菌产生的几丁质酶[5-6]。因此,几丁质酶的产生量及其活性对能否很好地防治线虫有重要作用,筛选出产酶活性高的淡紫拟青霉菌种,对更好地发挥其生物防治作用具有重要意义。多功能等离子体诱变系统(MPMS)以等离子体为主要诱变剂,在高压交变电场作用下,空气介质形成等离子体[7-9],等离子体中含有氮正离子(N+)、原子态氧(O)、OH自由基等活性成分,可使微生物的细胞膜受损,增加其通透性[10-11]。此类活性粒子进入细胞后,使DNA和蛋白质等生物大分子受损,同时激发细胞自身的修复机制,在此过程中,微生物将产生大量突变体[12]。本研究采用MPMS法对淡紫拟青霉进行诱变处理,提高其产几丁质酶的能力,为淡紫拟青霉在农业生物防治上的应用做准备。高通量筛选是获得高产突变株的关键步骤,通常的化学分析方法比较精确,但该法较为繁琐,不方便实现菌株的快速筛选。在筛选平板中加入胶体几丁质,通过产生透明圈的大小判断菌株产酶情况,可以缩减工作量,因此探寻新的高通量筛选产几丁质酶菌株的方法至关重要。
1 材料与方法
1.1 材料
1.1.1 菌株 淡紫拟青霉(Paecilomyceslilacinus),本实验室分离鉴定保藏。
1.1.2 试剂 磷酸二氢钾、3,5-二硝基水杨酸、硫酸铵、硫酸镁、盐酸等试剂均为分析纯(AR),葡萄糖、蔗糖、玉米淀粉、酵母膏、蛋白胨、几丁质为生化试剂(BR)。
1.1.3 仪器 MPMS多功能等离子体诱变系统(北京艾德豪克国际技术有限公司);HWS 24型电热恒温水浴锅(上海一恒科技有限公司);SKY-1102C恒温震荡培养箱 (金坛市盛蓝仪器制造有限公司);SP-756PC可见紫外分光光度计(上海光谱仪器有限公司);YSQ-LS-100S11型立式压力蒸汽灭菌器(上海博讯实业有限公司);DRP-9162 电热恒温培养箱(上海森信实验仪器有限公司)。
1.1.4 培养基(质量分数,%) ①斜面试管培养基:可溶性淀粉2,K2HPO40.1,KNO30.1,MgSO40.05,NaCl 0.05,FeSO40.001,琼脂2,pH自然;②种子培养基:可溶性淀粉2,K2HPO40.1,KNO30.1,NaCl 0.05,MgSO40.05,FeSO40.001,pH自然;③发酵培养基:可溶性淀粉2,100目几丁质粉0.1,K2HPO40.1,KNO30.1, MgSO40.05,NaCl 0.05,FeSO40.001,pH自然;④筛选培养基:可溶性淀粉2,2%的胶体几丁质10,K2HPO40.1,KNO30.1, MgSO40.05,NaCl 0.05,FeSO40.001,琼脂2,pH自然。上述培养基灭菌采用湿热灭菌,条件为121 ℃,30 min 。
1.2 方法
1.2.1 胶态几丁质的制备 取5 g几丁质加入50 mL浓盐酸中,充分搅拌后放入4 ℃冰箱静置冷藏24 h,加入50%乙醇200 mL,沉淀出胶态几丁质。将沉淀物反复水洗至中性(pH 7.0±0.2),用蒸馏水定容至250 mL,得到质量分数为2%的胶态几丁质。
1.2.2 几丁质酶活性分析 ①透明圈法:将筛选菌株涂布到筛选培养基的筛选平皿中,28 ℃ 静止培养4 d后,分别测定平皿中菌落周围显现透明圈的直径R2和淡紫拟青霉的菌落直径R1,计算R2/R1比值来比较菌株几丁质酶的相对活性[13]。②DNS比色法[14-15]:采用测定还原糖的方法测定几丁质酶的酶活。首先做葡萄糖标准曲线,配置不同梯度浓度的葡萄糖标准溶液,加入DNS(3,5- 二硝基水杨酸)后,100 ℃水浴10 min,在 540 nm 波长下测定吸光值(OD),以OD值为纵坐标、葡萄糖浓度(mg/mL)为横坐标绘制出标准曲线。然后将测定的发酵液样品OD值与标准曲线相比较,计算出几丁质酶活。方法:取样品发酵液,纱布过滤,上清液作为待测发酵酶液;在3根试管中分别加入1 mL待测几丁质酶的发酵液和1 mL的1%胶态几丁质,其中1根试管加入1 mL DNS,置于100 ℃恒温水浴锅中保持10 min,作对照,另外2根试管于40 ℃水浴锅中保持60 min的酶解反应后,各加入1 mL DNS,放入100 ℃水浴锅中进行灭活10 min;在3根试管中各加入10.0 mL蒸馏水,离心后取上清液利用分光光度计在540 nm波长处测量OD值,将测定结果与葡萄糖标准曲线相比较,并测算出还原糖含量,进而计算出几丁质酶活力。酶活力单位(U/mL)定义为40 ℃条件下,几丁质酶每1 min分解几丁质产生1 μmoL还原糖所需要的酶活为1个活力单位。
1.2.3 淡紫拟青霉孢子菌悬液的制备 将经过活化的淡紫拟青霉菌种涂布到斜面试管培养基中,培养温度28 ℃,在生化培养箱中静止培养5 d,待菌体表面全部由白色转变为淡紫色后,用无菌水洗出孢子,充分混拌均匀,适当稀释使孢子悬液中的孢子数达到2×105cfu/mL左右,备用。
1.2.4 诱变方法 首先打开MPMS后进行消毒(紫外线)30 min,连接氮气罐,打开阀门,进气压力调至0.3 MPa,恒定后,开始进行诱变处理操作。在不锈钢诱变杯(内径16.2 mm,高度7.9 mm)中装入不同体积淡紫拟青霉孢子菌悬液(超净工作台中进行),装入到MPMS系统中后,设置诱变参数(处理时间、平台高度、样品装量)启动系统开始工作。完成后取出诱变杯,吸出样品,并将洗出液合并,定容。然后涂平板进行菌株的筛选测定工作。
1.2.5 致死率曲线的测定 将经过诱变处理和未经诱变处理的菌液用无菌水稀释到适当浓度,涂布到平板固体培养基上,置于28 ℃培养箱中恒温静置培养70 h,进行菌落计数。以未经等离子诱变处理的菌落数为对照,计算出不同诱变处理条件后菌株的致死率,以诱变处理时间为横坐标,菌种的致死率为纵坐标绘制致死率曲线。
致死率(%)=
1.2.6 正负突变率 几丁质酶产量低于对照10%视为负突变株,几丁质酶产量高于对照10%的视为正突变株。


1.2.7 诱变菌株的筛选 ①平板透明圈法初筛:取经过诱变处理的样品,涂布到几丁质酶初筛培养基平板上进行培养,挑取R2/R1比值大的菌株到斜面试管中作为初筛得到的菌,详见1.2.2;②摇瓶发酵法进行菌种复筛:将初筛获得的效果较好的菌株作为发酵菌株进行摇瓶发酵,并将原菌株作为对照菌株进行对比发酵试验,发酵条件为温度28 ℃,500 mL三角瓶装量100 mL发酵液,摇床转速150 r/min,时间72 h。测定发酵液的几丁质酶活。
1.2.8 遗传稳定性考察 选取经过复筛得到的诱变菌株,在固体斜面试管中连续传代培养8次,比较不同传代次数菌株几丁质酶活的产率情况,确定诱变菌株的遗传稳定性。
2 结果与分析
2.1 MPMS不同处理对淡紫拟青霉菌株致死率的影响
2.1.1 不同处理时间对致死率的影响 将制备好的孢子悬液进行诱变处理,诱变处理时间分别为0、30、60、90、120 s。0 s为对照,处理完成后,统计结果,计算致死率,结果如图1所示。结果显示,诱变处理时间对菌株致死率影响较大,随诱变处理时间加长,菌株的死亡率提高,在处理30 ~60 s阶段,致死率的提升速度最大,当诱变处理30 s时,淡紫拟青霉孢子旳死亡率为30.33%,处理60 s时死亡率79.67%,90 s以后几乎全部死亡。
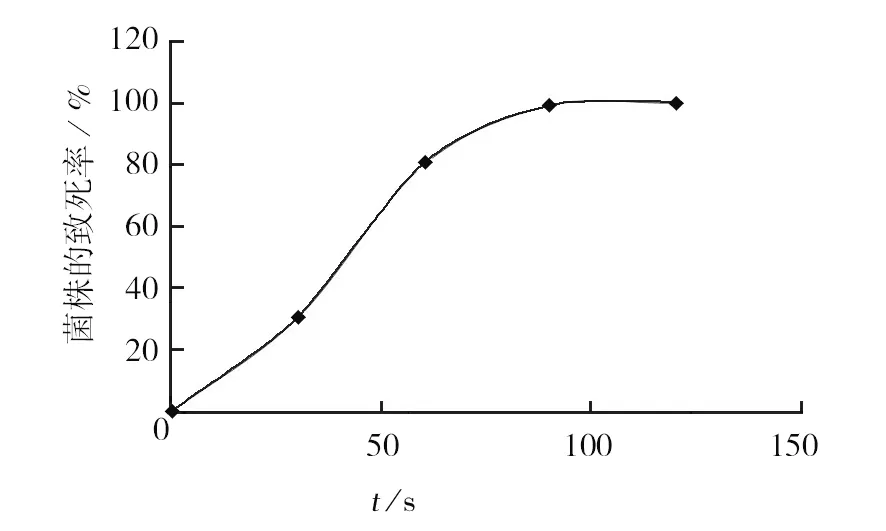
图1 MPMS不同处理时间对淡紫拟青霉菌株致死率Fig.1 Fatality rate of MPMS different processing time of Paecilomyces lilacinus
2.1.2 不同样品装量对致死率的影响 每个诱变杯中的样品装量分别为40、60、80 μL,诱变处理时间分别为30、50、70 s。处理完成后,统计结果并计算致死率,结果如图2所示。不同样品装量决定处理样品的厚度,装量越多,样品在诱变杯中的厚度越大,结果显示随处理样品装量的增加,样品的厚度也在提高,处理样品的死亡率逐渐降低。装量80 μL,时间30 s,死亡率为18.3%;而装量40 μL,时间30 s,死亡率为58.7%,相差3倍。因此,装量是影响诱变死亡率的一个重要因素。
2.2 MPMS不同处理时间对淡紫拟青霉菌株正负突变的影响
2.2.1 不同处理时间的菌株突变情况 样品装量为60 μL,诱变处理时间分别为30、40、50、60 s。培养后,统计结果并计算突变率,结果见表1。不同诱变处理时间与正突变率大小之间没有明显的相关性,正突变率在8.67%~21.35%间变动,40 s时正突变率最高,60 s正突变率最小。处理时间与负突变率的大小之间没有明显的相关性,但负突变概率是正突变概率的1.5~4.0倍。说明诱变处理对微生物细胞的损伤是随机的。
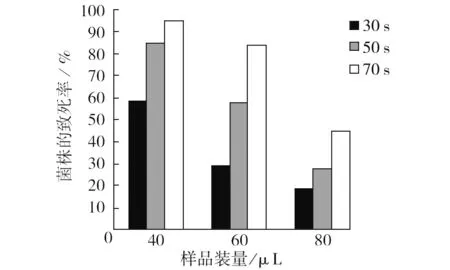
图2 不同样品装量对致死率的影响Fig.2 Fatality rate ofdifferent samples charge processing
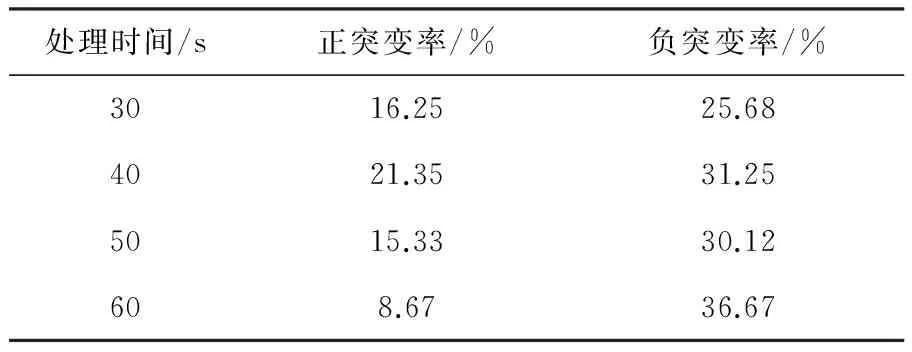
处理时间/s正突变率/%负突变率/%3016.2525.684021.3531.255015.3330.12608.6736.67
2.2.2 不同处理样品量的突变情况 样品装量分别为40、60、80、100 μL,诱变处理时间为30 s。培养后统计结果见表2。不同处理样品的装量与正突变之间的相关性不明显,正突变率在4.59%~12.33%,随样品量的提高,正突变率有降低的趋势,但相关性不明显。样品的装量与负突变率之间的相关性也不十分明显,负突变率在12.10%~29.12%之间变动,大约高于正突变率2~3倍。

表2 不同诱变处理的样品量对突变的影响
2.3 高活性淡紫拟青霉菌株的筛选
按照初筛的方法进行诱变菌株的初筛,将其中较好的前14株菌进行摇瓶发酵产酶实验,试验结果见表3。以R2/R1为横坐标,OD值为纵坐标作散点图,进行二组数据的相关性分析。由图3可知,随着R2/R1比值的提高OD也提高,规律性非常明显,而且R2为0.928 6,非常接近1,表明R2/R1和OD二者之间有很强的正相关性,说明R2/R1的比值代替测定OD值的方法进行几丁质酶活性初步测定的方法是可行的。
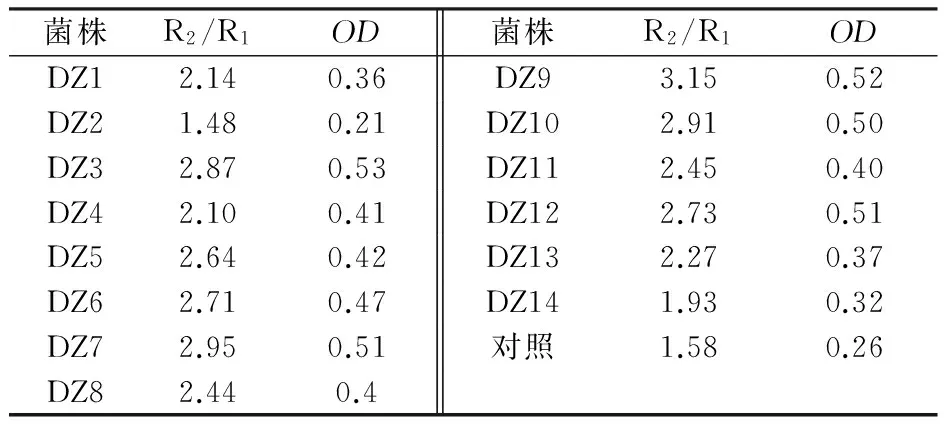
表3 初筛菌株的产酶情况
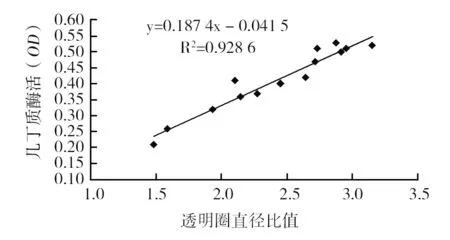
图3 几丁质酶活与透明圈直径比的相关性Fig.3 Correlation of chitinase live and diameter ratio of transparent circle
2.4 遗传稳定性考察
筛选的菌株经过8次试管培养基传代培养,分别测定产酶情况。由表4可知,经过8次传代,DZ3的OD值从0.50降到0.46,降低8%;DZ7的OD值从0.52降到0.50,降低4%;DZ9的OD值从0.50降到0.35,降低30%。DZ7诱变菌株的遗传稳定性较好,没有明显下降。DZ9的遗传稳定性不好,下降明显。
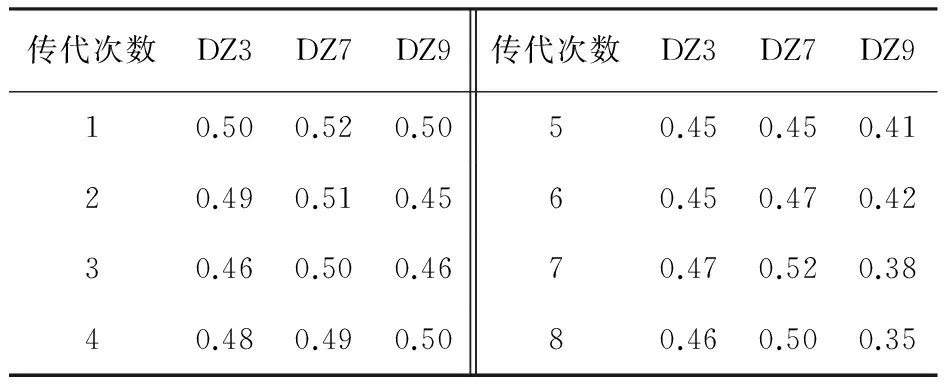
表4 淡紫拟青霉传代次数对酶活产率的影响
2.5 高产突变菌株摇瓶发酵实验情况
将经过诱变处理得到的菌株DZ3、DZ7、DZ9进行摇瓶发酵产酶实验,发酵产酶情况见图4。从图4中看出,在淡紫拟青霉发酵产酶过程中,前期进行菌丝生长,36 h开始产酶,55~70 h间产酶速度最快,70~78 h酶活性达到最高点,随后酶活性开始下降。DZ7的最高活性为0.17 U/mL,DZ9的最高活性为0.16 U/mL,DZ3的最高活性为0.145 U/mL,而未经诱变处理的原菌株最高活性为0.095 U/mL,与出发菌株相比,DZ7诱变处理使菌株产酶能力提高1.8倍。
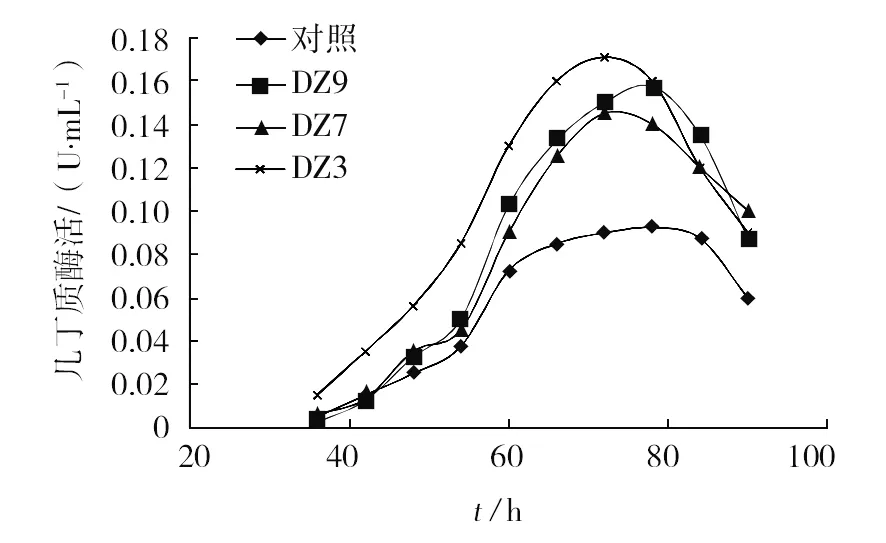
图4 淡紫拟青霉菌株发酵产几丁质酶情况Fig.4 Production situation of Paecilomyces lilacinus strain fermentation chitinase
3 讨 论
本研究利用等离子体诱变系统对淡紫拟青霉菌株进行处理时采用透明圈法进行菌株的初筛,虽然培养基中透明圈的大小与培养基的成分、浓度、培养基的厚度、培养时间等许多因素有关,但在相同条件下样品之间仍具可比性,采用透明圈法筛选菌种同摇床发酵测定酶活性的结果看,呈明显的正相关性,二者之间相关性系数接近1,因而采用透明圈法筛选淡紫拟青霉菌种切实可行,并且极大地提高了工作效率,方便、简洁。在诱变过程中,不同的诱变处理时间对淡紫拟青霉菌种死亡率的影响明显不同,而处理30~60 s死亡率提升很快,表明淡紫拟青霉对MPMS在此阶段处理时间非常敏感,对微生物细胞的损伤最大。样品的装量即样品的厚度对诱变处理的结果有一定的影响,厚度越大,死亡率越低,等离子诱变系统中培养基基质对等电离子的穿透还是有一定限制的。本研究采用不同的诱变处理时间、样品的装量等条件对微生物菌种进行处理发现,诱变菌株的正负突变率与诱变处理条件之间,没有明显的相关性,表明MPMS诱变处理微生物时,对细胞造成的损伤是随机的,没有一定的针对性,但负突变率明显高于正突变率约1.5~4.0倍。在遗传稳定性考察中发现诱变菌株的遗传稳定性不尽相同,需要进一步选育加以确定,部分菌株的稳定性较好。
采用MPMS多功能等离子体诱变系统对淡紫拟青霉进行微生物菌种的诱变过程中,效果明显,经过筛选的诱变菌株产生几丁质酶的活性同原菌株相比提高1.8倍。通过以上研究可看出,多功能等离子体诱变系统处理微生物时突变率与样品的厚度和处理时间关系密切,并且对微生物造成的损伤是随机的,由于修复机制的影响,负突变率要大于正突变率。
[1] 高淋淋,刘志明.植物根结线虫生物防治研究进展[J].广西植保,2015,28(1):32-35.
[2] 王曦茁,汪来发,孟繁丽,等.淡紫拟青霉航天诱变菌株对南方根结线虫的致病力[J].林业科学研究,2016,29(2):216-220.
[3] 王波,李红梅,王碧,等.淡紫拟青霉与放线菌代谢物复配对南方根结线虫的防治[J].南京农业大学学报,2009,32(1):55-60.
[4] 惠娜娜,马永强,王立,等.淡紫拟青霉、厚垣轮枝菌生防菌剂对当归“麻口病”的防治效果[J].植物保护,2015,(4):199-202.
[5] 赵培静,任文彬,缪承杜,等.淡紫拟青霉研究进展与展望[J].安徽农业科学,2007,35(30):9672-9674,9739.
[6] 王曦茁,汪来发,孟繁丽,等.淡紫拟青霉T-DNA插入突变体几丁质酶和蛋白酶活性及致病力的变化[J].四川农业大学学报,2016,34(1):78-84.
[7] 向荣华,詹晓北,朱莉,等.常压室温等离子体诱变绿色产色链霉菌及阿维拉霉素高产菌选育[J].中国抗生素杂志,2015,40(10):732-737.
[8] 夏书琴,刘龙,张东旭,等.大气压辉光放电低温等离子体诱变选育谷氨酰胺转胺酶高产菌株[J].微生物学通报,2010, 37(11): 1642-1649.
[9] 周扬,薛正莲,夏俊,等.常压室温等离子体(ARTP)诱变及高通量筛选那西肽高产菌株[J].工业微生物,2015, 45(2): 7-11.
[10]汪晨,蔡恒,张恒丽,等.高产琥珀酸菌株的等离子体诱变选育[J].南京工业大学学报,2013, 35(1): 57-60.
[11]蒋汶,张庆庆,汤文晶,等.紫外-等离子体复合诱变红曲霉产胞外多糖[J].食品与发酵工业,2016,42(1):64-69.
[12]董晓宇,滕虎,修志龙,等.高产1,3-丙二醇的等离子体诱变菌株选育及发酵动力学分析[J].过程工程学报,2011,11(2):304-311.
[13]张宇, 贺丹, 周鑫,等.产几丁质酶真菌菌株的筛选及产酶抑菌活性的检测[J].吉林大学学报,2010,36(1): 67-70.
[14]高倩,裴玲燕,汪强,等.淡紫拟青霉产几丁质酶发酵条件的优化[J].安徽农业科学,2013, 41(21): 8888-8890.
[15] 张建华,梁昌聪,刘磊,等.淡紫拟青霉E16液体发酵工艺研究[J].河南农业科学,2014,(11):87-92.
Screening of Chitinase Producing Strains from Plasma Mutagenesis ofPaecilomyceslilacinus
GU Jun1, ZHANG Xiao-yan1, MENG Li-qiang1, 3, SHA Chang-qing2
(1.Inst.ofMicrobiol.,Harbin150010; 2.HeilongjiangAcad.ofSci.,Harbin150001; 3.HarbinInst.ofTechnol.,Harbin150090)
The production capability of chitinase byPaecilomyceslilacinusfor bio-control was improved adopting strain mutation technology. TheP.lilacinuswas treated by mutation breeding by plasma technology at normal temperature and normal pressure (MPMS), the treated strain were initially screened adopting the method of transparent circle, then rescreened using fermentation method. The results showed that adopting MPMS method to mutateP.lilacinusto produce chitinase under 25 ℃, treated for 30 s. The treated sample volume at 60 μL, and 30.33% of lethality of mutation strain, the positive mutation ratio was at 14%. The chitinase activity of mutant strain was 0.17 U/mL after batch fermentation in shaking flask. It was concluded that after the mutagenic treatment ofP.lilacinus, a high-activity chitinase producing strain were obtained, with chitinase activity increased by 180%.
Paecilomyceslilacinus; mutation breeding; plasma mutation breeding technology
黑龙江省科学院科研基金项目(CZ14BGJV06)
谷军 男,研究员级高级工程师。研究领域为发酵工程技术。Tel:0451-84128758,E-mail:gujun64@163.com
* 通讯作者。女,高级工程师。研究领域为发酵工程技术。E-mail:zhangxiaoyan@163.com
2016-07-19;
2016-10-16
Q815
A
1005-7021(2017)03-028-05
10.3969/j.issn.1005-7021.2017.03.005

