损伤软骨的细胞提取、鉴定及生物学活性研究*
姚旺林,刘理金,徐训安,丛波,张加廷,张仲文
(武警总医院 骨科,北京 100039)
损伤软骨的细胞提取、鉴定及生物学活性研究*
姚旺林,刘理金,徐训安,丛波,张加廷,张仲文
(武警总医院 骨科,北京 100039)
目的 对从膝关节软骨损伤区分离出的细胞进行鉴定,并对其生长活性进行研究,以解决自体软骨细胞移植中软骨细胞来源不足的问题。方法 通过膝关节镜,在软骨损伤区取少量损伤软骨组织,不含正常软骨及软骨下骨为实验组;取正常软骨组织为对照组。在胰蛋白酶和Ⅱ型胶原酶作用下从实验组中提取细胞,对照组中提取正常软骨细胞。实验组细胞培养贴壁后在倒置相差显微镜下观察细胞的形态是否与对照组软骨细胞一致。实验组细胞行甲苯胺蓝染色鉴定,与对照组对比;噻唑蓝(MTT)法比较两组细胞生长活性;以具有专利知识产权的Ⅰ/Ⅱ型复合胶原膜为生长载体,培养实验组和对照组第3代软骨细胞,在电镜下观察两组生长活性。结果 从少量损伤的软骨组织中提取的细胞为活性正常的软骨细胞,其特征及生长活性与对照组比较,差异无统计学意义(P<0.05)。结论 软骨损伤过程中软骨细胞未发生变性,少量损伤的软骨组织仍可获得适量软骨细胞,MTT法和电镜扫描表明,其生长活性符合自体软骨细胞移植的要求,无需取正常软骨组织作为细胞来源。
损伤软骨;软骨细胞;自体软骨细胞移植
Abstract:Objective To identify the cells isolated from injured cartilage tissue and study their growth activity,in order to provide adequate cells for autologous chondrocyte transplantation.Methods Through the knee arthroscope,a small amount of injured cartilage tissue was taken in the cartilage damage zone as experimental group,which did not include the normal cartilage or the subchondral bone.The normal cartilage wastaken ascontrolgroup.The cellswere extracted from the experimentalgroup,and the normal chondrocytes were extracted from the control group by trypsin and typeⅡ collagenase.The cells of the experimental group were observed under inverted phase contrast microscope to dentify whether the cell morphology was consistent with the chondrocytes of the control group.The cells of the experimental group were identified with toluidine blue staining,and compared with the chondrocytes of the control group.Cell growth activity of the two groups was compared by MTT method.The third generation chondrocytes of the two groups were cultured on type Ⅰ/Ⅱ composite collagen membrane with patent intellectual property,and their growth activity was observed under electron microscope.Results The cells extracted from injured cartilage tissue were normal chondrocytes,and their characteristics and growth activity were not different from those of the control group (P<0.05).Conclusions In the process of cartilage injury,the cartilage cells do not degenerate.Appropriate amount of chondrocytes can be obtained from a small amount of injured cartilagetissue,it is proved that the growth activity is in accordance with the requirements of autologous chondrocyte transplantation by MTT method and electron microscopy.As a result,we do not need the normal cartilage tissue as a cell source.
Keywords:injured cartilage;chondrocyte;autologous chondrocyte transplantation
软骨损伤是一种常见的疾病,软骨损伤后不能自我修复[1-2],传统的治疗方法效果并不满意。自体软骨细胞移植技术受到医疗界的青睐[3-5],但软骨细胞来源却不丰富。正常、非负重膝关节区作为获得细胞重要来源[6],使患者受2次创伤。本研究在胰蛋白酶和Ⅱ型胶原酶作用下,从少量损伤软骨组织中提取软骨细胞,并对其进行鉴定和生物活性观察,验证软骨损伤区获得的细胞是否为正常软骨细胞,及其作为细胞移植种子细胞的可行性。
1 材料与方法
1.1 材料和试剂
实验室制备的Ⅰ/Ⅱ型复合胶原膜(武警实验中心自备,专利号:201310234061.X),改良Eagle培养液达尔伯克必需基本培养基(美国Hyclone公司),胎牛血清(美国Gibco公司),0.25%胰蛋白酶(北京雷根生物技术有限公司),0.2%Ⅱ型胶原酶(美国Sigma公司),磷酸盐缓冲溶液(phosphate buffer saline,PBS)、青霉素-链霉素混合液、台盼蓝染液、1%甲苯胺蓝染液、4%多聚甲醛(购自北京雷根生物技术有限公司),二甲基亚砜(dimethyl sulfoxide,DMSO)(北京索莱宝公司),无水乙醇(北京化工厂),2.5%戊二醛(济南汇丰达化工有限公司),1%锇酸(成都艾科达化学技术有限公司),噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]法(北京雷根生物技术有限公司)。
1.2 方法
1.2.1 损伤软骨的获取 关节镜下对膝关节进行探查,找到软骨损伤区,且选取未伤及软骨下骨区域为取材点,明确后对损伤区域表面以刨刀处理,去除表面毛絮,以确保获得的组织中软骨组织量。将获得的软骨组织放置于含PBS缓冲液的无菌离心管中,转移至实验室。见图1。
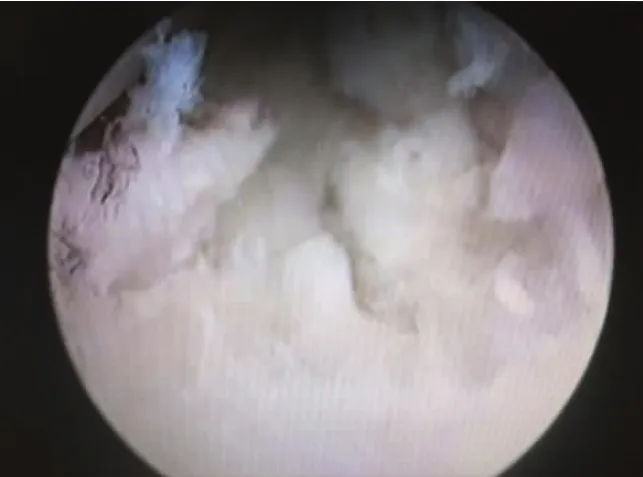
图1 关节镜下软骨损伤区
1.2.2 原代细胞的分离 将手术室取出的少量损伤软骨组织转移至无菌生物安全操作台。取10ml离心加PBS缓冲液至5 ml,放置天平称重,其重量计为W1;将取下的软骨组织放入离心管中,再次称重,其重量记为W2,软骨组织重量=W2-W1。步骤:①含双抗的PBS液漂洗3次后吸出PBS液,加入等体积的0.25%胰蛋白酶,放入震荡器,37℃、205 r/min震荡30 min;②向离心管内加入等体积培养基终止胰酶消化,1 300 r/min离心5 min,吸走液体获得沉淀的软骨组织;③离心管中加入2倍软骨体积的0.2%Ⅱ型胶原酶,放入震荡器,37℃、205 r/min 震荡 1 h,1 300 r/min离心5 min,将含细胞的上清液吸入另一10 ml离心管中,并加入等体积的培养基终止消化备用;④原有含软骨沉淀的离心管(B管)再加入2倍体积的0.2%Ⅱ型胶原酶,重复第3步直至软骨组织消化结束;⑤所有含细胞的上清液移至B管,1 800 r/min离心5 min,吸除液体获得沉淀的细胞,加10ml培养基,移液枪均匀吹打后取2滴液体用细胞计数器计数。存活率测定:取2滴液体至细胞计数板上,加台盼蓝染液于细胞计数板,死亡细胞为蓝色,活细胞无色,存活率=4大格活细胞数/4大格细胞总数×100%;⑥将细胞按8 000 cm2接种于25 cm2的细胞培养瓶,置于37℃、0.5%二氧化碳CO2培养箱中培养。对照组正常的软骨组织重量、提取方法、时间应控制与实验组一致。
1.2.3 细胞的传代 当细胞成密集集落生长或融合至<80%时,将细胞传代。移液枪吸除培养液,PBS液漂洗3次,加入2 ml 0.25%胰蛋白酶,消化约3 min,在显微镜下监测细胞是否脱落。细胞从瓶壁脱落后加入2 ml培养基终止消化,移液枪吹打瓶壁,液体吸入10 ml离心管后,1 800 r/min离心5 min,吸除液体,保留细胞沉淀物。重复原代细胞分离第5、6步。
1.2.4 细胞形态观察 两组原代细胞培养48 h后和传代贴壁后,均放倒置显微镜下观察细胞形态,实验组和对照组进行比较是否符合软骨细胞生长特性,实验组应注意观察有无长梭形的纤维样细胞。
1.2.5 甲苯胺蓝染色鉴定 将实验组培养至第2代的细胞传代后,放入含盖玻片的培养皿中培养24 h。PBS缓冲液清洗爬片2次,4%多聚甲醛溶液固定15~20 min、0.1%甲苯胺蓝染液浸泡2 h,90%无水乙醇漂洗,镜下观察。
1.2.6 MTT法 为保证足够数量的细胞完成实验,实验组和对照组细胞第2、3代测吸光度值(optical density,OD),每代细胞均按2×104个/ml接种至6块96孔板,100 μg/(ml.孔),每板分为实验组和对照组,每组接种6孔。每隔2天换液,每隔1天取1块96孔板分别测实验组和对照组每孔OD值,测1次/(板.孔),共测6次。加入MTT溶液(5 mg/ml)10 μl/孔,培养箱孵育4 h后加入100 μl DMSO,在摇床上低速震荡10 min,在酶联免疫吸附检测仪490 nm处测各孔吸光度值,取每组平均值。
1.2.7 电镜 电镜观察比较两组细胞生长情况。两组细胞分别取第3代细胞,接种至含有Ⅰ/Ⅱ型复合胶原膜的培养皿中培养3 d[7],细胞悬液铺满培养皿底。3 d后,将复合胶原膜从培养皿中取出,PBS缓冲液漂洗,2.5%戊二醛、1%锇酸双固定,浓度逐级增高的乙醇脱水、临界点干燥,喷金导电后扫描电镜观察。
1.3 统计学方法
数据分析采用SPSS 16.0统计软件,计量资料以均数±标准差(±s)表示,用两独立样本的t检验,P<0.05为差异有统计学意义。
2 结果
2.1 软骨细胞计数及存活率
实验组软骨重量约为85 mg,细胞浓度约为2.7136×104个/ml;对照组软骨重量约为85 mg,细胞浓度约为3.5248×104个/ml;从软骨组织中获得细胞比率:实验组∶对照组的细胞提取比率1.0000∶1.2989。实验组台盼蓝染色测定细胞存活率约为90%,对照组约为93%。
2.2 两组细胞形态观察
两组原代细胞在倒置显微镜下观察均呈球形,大小无明显差异,均悬浮于培养基中,具有折光性。培养48 h后,两组细胞均呈三角形或多角形,实验组未见长梭形纤维样细胞;两组细胞均表现为集落生长,原代约8 d后出现接触抑制现象,成“铺路石”样结构,达到传代条件。两组传代的细胞均于24 h内贴壁,时间较原代细胞缩短,细胞形态仍呈三角形或多角形,未见去分化;增殖速度加快,两组第1代培养周期约5 d,2、3代约3、4 d,即可达传代条件。见图2。
2.3 两组细胞染色结果比较
两组细胞均被染成同一色,细胞核呈深蓝色,细胞质颜色则较浅,细胞界限清楚,轮廓清晰,呈多边形,提示为软骨细胞。见图3。
2.4 两组细胞生长活性比较
通过以相同的浓度种植,实验组第2、3代细胞相对原代细胞均表现为增殖速度加快,2代生长活性分别保持一致,活性无明显减低,与对照组第2、3代细胞生长活性比较,差异无统计学意义(P>0.05)(见表1、2)。实验组第2代与第3代细胞生长活性结果比较:第2天比较,差异无统计学意义(P>0.05);在第3、4天细胞增殖加快期,第3代活性较第2代好(P<0.05);到达平台接触抑制期后,第5、6天活性比较差异无统计学意义(P>0.05);实验组细胞在传代过程中同样表现出第3代较第2代增殖速度加快的现象,即其增殖能力在第3代比较好(见表3)。可认为实验组和对照组生长活性无明显差异,且实验组在传代过程中活性未减低,第3代活性较好。
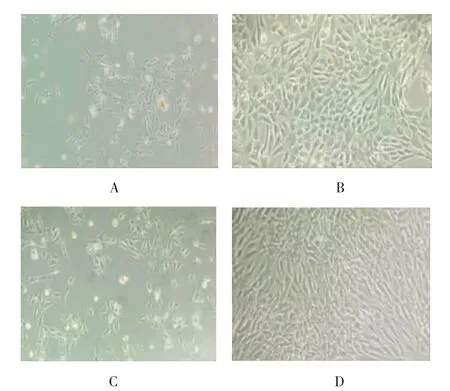
图2 软骨细胞形态 (倒置显微镜)
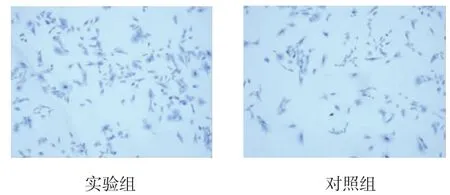
图3 两组第3代细胞 (甲苯胺蓝染色×400)
表1 两组第2代细胞O D值比较 (n=6,±s)
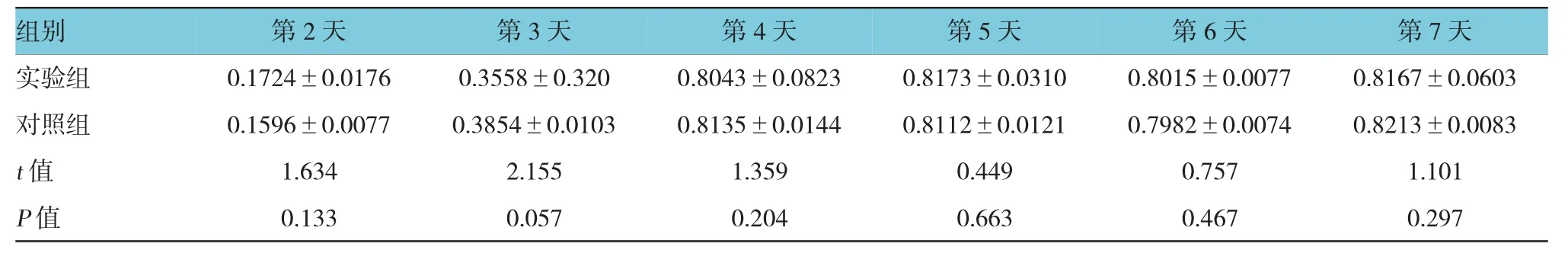
表1 两组第2代细胞O D值比较 (n=6,±s)
组别 第2天 第3天 第4天 第5天 第6天 第7天实验组 0.1724±0.0176 0.3558±0.320 0.8043±0.0823 0.8173±0.0310 0.8015±0.0077 0.8167±0.0603对照组 0.1596±0.0077 0.3854±0.0103 0.8135±0.0144 0.8112±0.0121 0.7982±0.0074 0.8213±0.0083t值 1.634 2.155 1.359 0.449 0.757 1.101P值 0.133 0.057 0.204 0.663 0.467 0.297
表2 两组第3代细胞O D值比较 (n=6,±s)
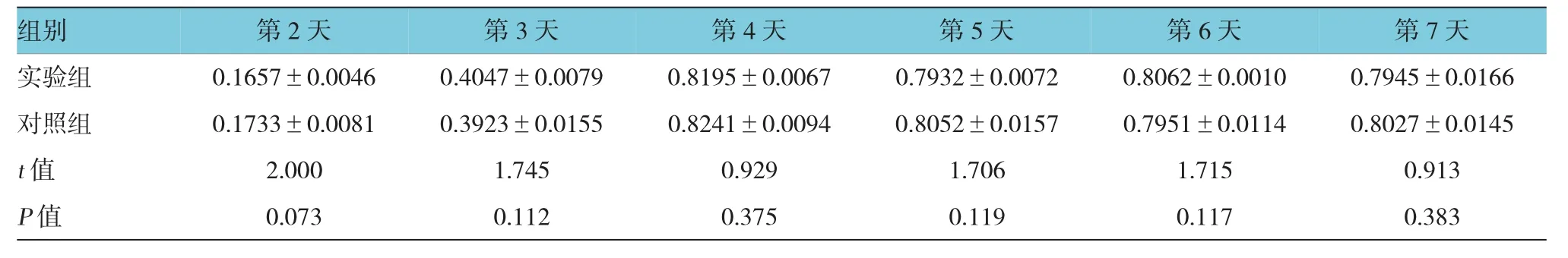
表2 两组第3代细胞O D值比较 (n=6,±s)
组别 第2天 第3天 第4天 第5天 第6天 第7天实验组 0.1657±0.0046 0.4047±0.0079 0.8195±0.0067 0.7932±0.0072 0.8062±0.0010 0.7945±0.0166对照组 0.1733±0.0081 0.3923±0.0155 0.8241±0.0094 0.8052±0.0157 0.7951±0.0114 0.8027±0.0145t值 2.000 1.745 0.929 1.706 1.715 0.913P值 0.073 0.112 0.375 0.119 0.117 0.383
表3 实验组第2、3代细胞O D值比较 (n=6,±s)
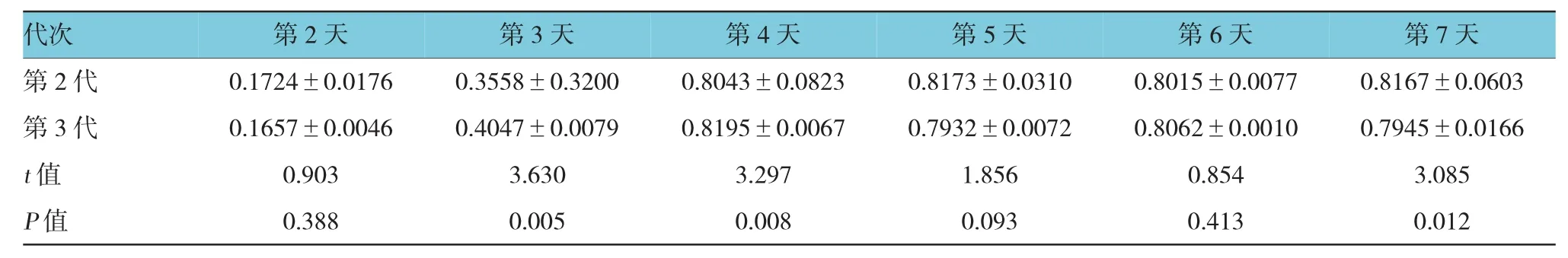
表3 实验组第2、3代细胞O D值比较 (n=6,±s)
代次 第2天 第3天 第4天 第5天 第6天 第7天第 2 代 0.1724±0.0176 0.3558±0.3200 0.8043±0.0823 0.8173±0.0310 0.8015±0.0077 0.8167±0.0603第 3 代 0.1657±0.0046 0.4047±0.0079 0.8195±0.0067 0.7932±0.0072 0.8062±0.0010 0.7945±0.0166t值 0.903 3.630 3.297 1.856 0.854 3.085P值 0.388 0.005 0.008 0.093 0.413 0.012
2.5 两组细胞生长状态比较
两组细胞均贴附复合胶原膜上,呈集落生长,生出伪足,细胞表面可见微绒毛、凸起等结构,生长良好,增殖状态佳。见图4。
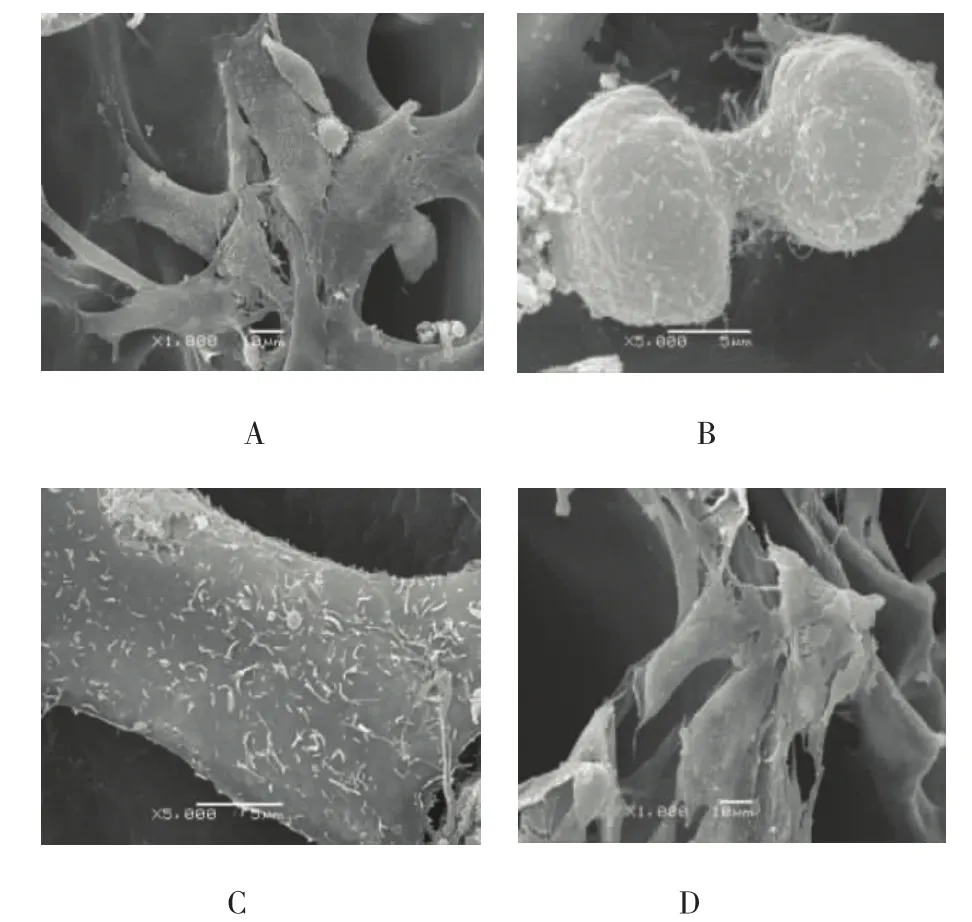
图4 软骨细胞 (电镜)
3 讨论
软骨细胞是自体软骨细胞移植技术的关键,如何从少量的软骨组织中,在体外获得足够数量且活性良好的的软骨细胞,一直困扰着研究者。目前多在关节的非负重、正常软骨区获得足够数量软骨组织,从而获得足够数量、表型稳定的软骨细胞。本实验在软骨损伤区取下少量损伤软骨组织,在体外进行分离、培养,通过建立正常软骨细胞对照组,探索软骨损伤区所含软骨细胞是否变性,是否能提取出正常软骨细胞,能否正常生长,是否能达到移植要求。
从软骨损伤软骨组织中提取出细胞是至关重要的一步,因此提取方法值得学者们探讨。为排除实验过程中其他因素影响,实验组和对照组的软骨组织重量、提取方法、消化时间、培养基成分、培养条件均一致。软骨组织主要为软骨细胞和Ⅱ型胶原组成,经Ⅱ型胶原酶消化细胞外基质后就可获得较纯的软骨细胞[8]。在关节镜下取的软骨组织纯度很高,可不用胰蛋白酶消化,但是实验组损伤的软骨组织表面含有滑膜或者结缔组织,因此需要在Ⅱ型胶原酶作用前,用胰蛋白酶去除软骨组织外其他杂质。为保证实验条件一致性,对照组同样用胰蛋白酶处理且时间均为30 min。胰蛋白酶和Ⅱ型胶原酶均能够对细胞造成损伤[9],因此浓度和消化时间必须控制好,本实验采用多次消化,每次消化时间短[10],Ⅱ型胶原酶消化时间均为1 h,共消化3次,最后将消化出的细胞合并在一起计数及培养。接种密度低,软骨细胞的旁分泌因子无法相互作用,容易出现去分化。合适的接种密度,细胞分泌的因子可相互影响,互相维持细胞的表型[11]。相关研究发现,合适的接种密度,在5代之前的软骨细胞为三角形或多边形,形态保持良好[12-13]。本实验多次、短时间消化可以获得足量的原代细胞,保证接种密度,从而保证细胞表型一致。
本实验观察贴壁后细胞形态、生长特性,以及用甲苯胺蓝染色对实验组细胞鉴定。对照组细胞是从正常软骨组织中提取,为正常软骨细胞。实验组细胞贴壁后,形态和生长特性方面与对照组一致,为聚集生长的三角形或多角形细胞,呈铺路石样改变;同时其甲苯胺蓝染色结果也一致[14],表明从损伤的软骨组织中所提取的细胞为软骨细胞,软骨损伤后其所含软骨细胞未发生变性。在验证实验组细胞为软骨细胞后,需进一步测定其生长活性,以判定其是否满足移植要求。
本实验采用MTT法[15]和电镜观察法对实验组软骨细胞的生长活性进行鉴定。值得强调的是进行MTT接种时应同样注意接种密度,本实验接种密度为2×104个/ml,100μg/(ml.孔),保证接种密度,维持细胞的表型。MTT法结果表明,实验组软骨细胞生长活性和正常软骨细胞活性相同,培养周期接近;电镜观察结果表明,实验组和对照组细胞一样生出伪足,表面同样可见微绒毛、凸起等结构,生长良好。结果提示,实验组的软骨细胞为活性正常的软骨细胞,可以满足自体软骨细胞移植要求。
通过原代细胞计数表明,软骨损伤后有一定量的软骨细胞丢失,但是其所含软骨细胞未发生变性,少量损伤软骨组织仍可通过采用多次、短时间二步酶消化法提取出数量合适、表型稳定的软骨细胞,其生长活性并未受到损伤因素及损伤后炎症的影响,与正常软骨细胞无明显差异,因此可以作为自体软骨细胞移植技术的软骨细胞来源之一,不必在非负重区取正常的软骨组织,避免人为因素对关节面完整造成的二次损伤。
[1] ESLAMINEJAD M B,POOR E M.Mesenchymal stem cells as a potent cell source for articular cartilage regeneration[J].World J Stem Cells,2014,6(3):344-354.
[2] CHEN F S,FRENKEL S R,DI CESARE P E.Chondrocyte transplantation and experimental treatment options for articular cartilage defects[J].Am J Orthop(Belle Mead NJ),1997,26(6):396-406.
[3] CLAVE A,POTEL J F,SERVIEN E.Third-generation autologous chondrocyte implantation versus mosaicplasty for knee cartilage injury:2-year randomized trial[J].J Orthop Res,2016,34(4):658-665.
[4] SCHINDLER O S.Cartilage repair using autologous chondrocyte implantation techniques[J].J Perioper Pract,2009,19(2):60-64.
[5] MUMME M,BARBERO A,MIOT S,et al.Nasal chondrocyte-based engineered autologous cartilage tissue for repair of articularcartilage defects:an observational first-in-human trial[J].Lancet,2016,388(10055):1985-1994.
[6] MARLOVITS S,ZELLER P,SINGER P,et al.Cartilage repair:generations of autologous chondrocyte transplantation[J].Eur J Radiol,2006,57(1):24-31.
[7] 丛波,姚旺林,张仲文,等.兔软骨细胞的分离及其与Ⅰ/Ⅱ型复合胶原膜共培养的实验研究[J].中国现代医学杂志,2016,26(7):4-8.
[8] 刘小荣,张笠,高武,等.新西兰兔关节软骨细胞分离培养与鉴定的实验研究[J].国际检验医学杂志,2012,33(19):2307-2312.
[9] 邵博,占琼,龚忠诚,等.软骨组织工程软骨细胞分离方式的优化[J].新疆医科大学学报,2016,39(9):1139-1146.
[10] 刘明东,盛天金,王万宗.胰蛋白酶及Ⅱ型胶原酶消化获取关节软骨细胞[J].中国组织工程研究与临床康复,2012,14(46):8551-8554.
[11] 余方圆,卢世璧,崔雪梅,等.兔关节软骨细胞聚集培养的生物学性状观察[J].中华外科杂志,2006,44(12):848-851.
[12] KANG S W,YOO S P,KIM B S.Effect of chondrocyte passage number on histological aspects of tissue-engineered cartilage[J].Biomed Mater Eng,2007,17(5):269-276.
[13] 童迅,赵海恩,张栋,等.人关节软骨细胞的体外分离、培养与鉴定[J].现代生物医学进展,2012,12(16):3040-3044.
[14] GONG Y Y,XUE J X,ZHANG W J,et al.A sandwich model forengineering cartilage with acellularcartilage sheetsand chondrocytes[J].Biomaterials,2011,32(9):2265-2273.
[15] van MEERLOO J,KASPERS G J,CLOOS J.Cell Sensitivity assays:the MTT assay[J].Methods Mol Biol,2011,7(31):237-245.
(童颖丹 编辑)
Isolation,identification and biological activity of chodrocytes from injured cartilage*
Wang-lin Yao,Li-jin Liu,Xun-an Xu,Bo Cong,Jia-ting Zhang,Zhong-wen Zhang
(Department of Orthopaedics,General Hospital of Chinese Armed Police Forces,Beijing 100039,China)
R687.3
A
10.3969/j.issn.1005-8982.2017.23.004
1005-8982(2017)23-0018-05
2016-11-03
首都临床特色应用研究(No:Z161100000516013)
张仲文,E-mail:zhang6816151@163.com;Tel:13716151868

