桂郁金对肝星状细胞TGF-β1/Smad信号通路的影响
张技,蒋淼,李白雪
桂郁金对肝星状细胞TGF-β1/Smad信号通路的影响
张技1,蒋淼2,李白雪1
目的:探讨桂郁金对肝纤维化的作用机制。方法:用血小板衍生生长因子(PDGF)诱导肝星状细胞HSC-T6活化,随后采用桂郁金醇提取物进行干预;采用ELISA法测定细胞上清液中Ⅰ型、Ⅲ型胶原的含量,采用半定量RT-PCR法检测细胞中TGF-β1、Smad2、Smad3 mRNA的表达水平。结果:与空白组相比,模型组中上清液中Ⅰ型、Ⅲ型胶原的含量明显增高(P<0.01),TGF-β1、Smad2、Smad3 mRNA的表达均呈现显著增高(P<0.01);与模型组相比,桂郁金醇提取物低浓度组、高浓度组上清液中Ⅰ型、Ⅲ型胶原含量均有所下降(P<0.05),TGF-β1 mRNA的表达水平存在差异(P<0.05),Smad3 mRNA的表达水平在高浓度组中存在差异(P<0.05)。结论:桂郁金可能通过抑制TGF-β1/Smad信号通络,起到抗肝纤维化的作用。
桂郁金;肝纤维化;转化生长因子-β1;Smad
肝纤维化(hepatic fibrosis, HF)是肝细胞受到炎症刺激或坏死时,肝星状细胞(hepatic stellate cells, HSC)被激活,进而增殖,合成并分泌大量的细胞外基质(extra cellular matrix, ECM),导致ECM沉积增多,形成肝纤维化。祖国传统医学并无肝纤维化的记载,现代医家根据其临床症状,将肝纤维化归于“积聚”、“胁痛”、“肝着”等病症的范畴。目前,在临床上,尚未开发出针对肝纤维化有效治疗的西药。已有研究显示,桂郁金对改善肝功能、抗肝纤维化有显著疗效,但其作用机制有待进一步研究[1~2]。本研究利用血小板衍生生长因子(platelet derived growth factor, PDGF)诱导肝星状细胞HSC-T6活化,随后采用桂郁金醇提取物进行干预,旨在研究桂郁金对转化生长因子β1(transforming growth factor - β1, TGF-β1)及其下游信号转导分子Smads表达水平的影响,以探讨桂郁金抗肝纤维化的作用机制。
1 材料
1.1 细胞株
本实验采用肝星状细胞株HSC-T6,购自四川大学华西医院生物治疗国家重点实验室
1.2 药物、试剂与仪器
桂郁金(购自广西钦州陆屋镇);新生小牛血清(兰州民海生物有限公司),DMEM培养基(Gihco,Grand Island,NY,美国),Ⅰ型、Ⅲ型胶原试剂盒(上海森熊科技实业有限公司),TRIZOL Reagent试剂(Inicitrogen,CA),逆转录试剂盒(EasyScript First-Strand cDNA Synthesis Super Mix,北京全式金生物技术有限公司),PCR试剂盒(Fermentas);Powerwave XS型全波长扫描酶标仪(Bio-tek,美国),PCR仪(Bio-radiCycler,美国)
2 方法
2.1 实验分组
实验设定4组,分别为空白组、模型组、桂郁金醇提取物低浓度组、桂郁金醇提取物高浓度组。将HSC-T6接种于含10%小牛血清的DMEM培养液中,在37℃、5%CO2、95%湿度条件下培养。取对数生长期的HSC-T6细胞以1.0×105个/孔的密度接种于96孔板,在37℃、5% CO2的条件下,培养过夜。分别在模型组、桂郁金醇提取物低浓度组、高浓度组加入血小板衍生生长因子PDGF (终浓度5 μg﹒L-1),30 min后,在低、高浓度组分别加入桂郁金醇提取物(终浓度22.5 μmol﹒L-1、90 μmol﹒L-1),分别培养48 h。
2.2 HSC-T6上清液中胶原的含量的检测
HSC-T6细胞分组培养48 h后,收集上清液,用ELISA测定上清液中Ⅰ型、Ⅲ型胶原的含量。
2.3 半定量RT-PCR检测HSC-T6中TGF-β1、Smad2、Smad3 mRNA的表达水平
H S C-T 6细胞分组培养4 8 h后,采用TRIzol法抽提总RNA。TGF-β1 上游引物:5’-TGGAGTTGTCCGGCAGTGGC-3’,下游引物:5’-TGCTGTACTGTGTGTCCAGG-3’;Smad2上游引物:5’-TACCCACTCCATTCCA-3’,下游引物:5’-TGATAAACGGAATCAA -3';Smad3上游引物:5'-TTCCAGAAACCCCACCT-3',下游引物:5'-GACAGCCTCAAA-GCCCT-3';内源性参照引物β-a c t i o n R a c t i n 2 2 9 S:5’-CGGACTCATCGTACTCCTGCT-3’,Ractin229AS:5’-CGTAAAGACCTCTATGCCAACA-3’
2.4 统计学处理
数据分析采用SPSS 17.0,数据用表示,组间采用t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 HSC-T6上清液中胶原含量
与空白组相比,模型组中上清液中Ⅰ型、Ⅲ型胶原的含量明显增高;与模型组相比,桂郁金醇提取物干预48 h后,低浓度组、高浓度组上清液中Ⅰ型、Ⅲ型胶原含量均有所下降,具体结果见表1。
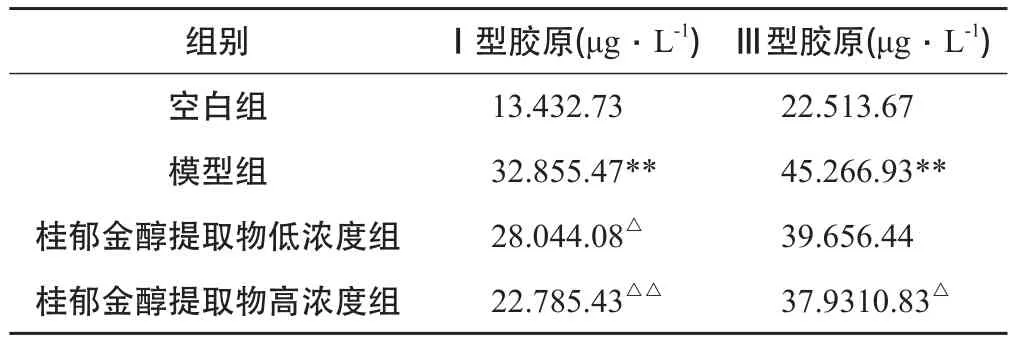
表1 各组HSC-T6上清液中胶原含量的比较
3.2 HSC-T6中TGF-β1、Smad2、Smad3 mRNA的表达水平
与空白组相比,模型组TGF-β1、Smad2、Smad3 mRNA的表达均呈现显著增高;与模型组相比,桂郁金醇提取物低浓度组、高浓度组中TGF-β1 mRNA的表达水平存在差异,Smad2 mRNA的表达水平差异不明显,Smad3 mRNA的表达水平在低浓度组中差异不明显,在高浓度组中存在差异,具体结果见表2。
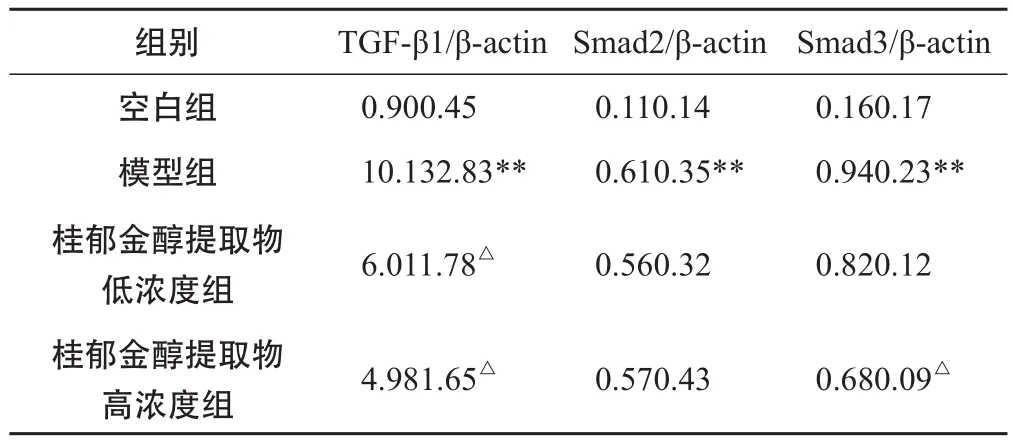
表2 各组HSC-T6中TGF-β1、Smad2、Smad3 mRNA表达水平的比较
4 讨论
HSC的活化增殖是肝纤维化发生的中心环节。活化的HSC 转化为肌成纤维细胞,合成大量ECM,导致ECM合成和降解失衡,促进了肝纤维化的发生[3~4]。因此,抑制HSC的活化增殖或促进活化的HSC凋亡是防治肝纤维化的重要手段。TGF-β是一类能够调节细胞生长和分化的多肽,具备多种生物作用,在肝纤维化发生发展过程中具有活化HSC,促进胶原基因表达,促进ECM合成与沉积等作用,是最重要的促肝纤维化细胞因子之一[5~6]。Smads蛋白是TGF-β受体复合物下游起重要作用的信号分子, TGF-β通过与Smad2、3等结合,使其发生磷酸化,随后引起靶基因的转录,Ⅰ型胶原等细胞外基质大量合成,进而促进肝纤维化[7]。
HSC激活增生转化是肝纤维化的中心环节,TGF-β是这一病理过程中必需的生物调节因子,Smads 又是TGFβ唯一的作用底物,故TGFβ- Smads信号通路对HSC产生的影响引起极大关注[8~9]。TGFβ-Smad信号转导通路在肝纤维化发病中起着举足轻重的作用,干预该信号通路就成为肝纤维化防治的理想选择[10]。
研究结果显示,HSC-T6在PDGF作用48 h后,引起了TGF-β1、Smad2、Smad3 mRNA表达水平的显著上调,同时在培养细胞上清液的检测中,发现Ⅰ型、Ⅲ型胶原含量显著升高,提示PDGF通过TGF-β1/Smad通路使肝星状细胞活化,促进HSC-T6分泌Ⅰ型、Ⅲ型胶原。同时,HSC-T6在PDGF作用30 min后,采用桂郁金醇提取物干预后发现,TGF-β1 mRNA的表达水平存在差异,且呈现出随剂量的增长差异更显著,Smad3 mRNA的表达水平在低浓度组中差异不明显,在高浓度组中存在差异,Smad2 mRNA的表达水平差异不明显;在培养细胞上清液的检测中,发现Ⅰ型、Ⅲ型胶原含量均有所下降,且随干预药物剂量的升高而降低。结果提示,桂郁金醇提取物可能通过TGF-β1/Smad通路,抑制HSC-T6的活化、增殖,进而起到抗肝纤维化的作用。
本研究虽然起到了相关的提示作用,但在TGF-β1/Smad通路中,有着大量信号因子,本实验仅检测了相关的TGF-β1、Smad2、Smad3 mRNA表达情况,数据不够全面。此外,在基因表达过程中,还会受到许多因素的调控,本实验中还未涉及到相关蛋白表达的测定,及调控因素的检测,这些都是在以后的实验中可进一步完善。
[1] 彭岳,吴光,韦燕飞,等.桂郁金提取物对人肝星状细胞增殖、细胞周期及凋亡影响的研究[J].时珍国医国药,2012,23(5):1076.
[2] 黎桂玉,李树民,彭岳,等.桂郁金成分分离及抗纤维化作用的研究进展[J].辽宁中医杂志,2016,43(9):2005.
[3] Alcolado R, Arthur MJ, Iredale JP. Patjogenesis of liver fi brosis[J]. Clin Sci, 1997,92(2):103.
[4] Gressner AM, Bachem MG. Cellular communications and cell matrix interactions in the pathogenesis of fibroproliferative disease:liver fibrosis as a paradigm[J]. Ann Biol Clin,1994,52(3):205.
[5] Sugawara K, Kizaki K, Herath CB, et al. Transforming growth factor beta family expression at the bovine fetomaternal interface[J]. Reprod Biol Endocrinol, 2010, 8(1):357.
[6] 张建伟,李培潮,苏东毅,等.基于转化生长因子-β1/Smads信号转导通路研究鳖甲煎丸防治肝纤维化的作用机制[J].甘肃中医学院学报, 2015, 32(1):6.
[7] Massague J, Blain SW, Lo RS. TGF-β signaling in growth conlrol, cancer,and heritable disorders[J].Cell,2000,103(2):295.
[8] 杨婷,谢汝佳,罗新华,等.丹芍化纤胶囊对肝纤维化大鼠肝脏Smads分子表达的影响[J].中国病理生理杂志,2010,26(9):1807.
[9] Zhang BB, Cai WM, Tao J, et al. Expression of Smad proteins in the process of liver fi brosis in mice infected with Schistosoma japonicum[J].Chin J Parasitol Parasit Dis,2013,31(2):89.
[10] Tian XP, Yin YY, Li X. Effects and mechanisms of acremoniumterricola milleretal mycelium on liver fibrosis induced by carbon tetrachloride in rats[J]. Am J Chin Med,2011, 39(3):537.
Effects and mechanism of Guangxi Yujin on TGF -β1/Smad signaling pathways in HSC-T6
/
ZHANG Ji1, JIANG Miao2,LI Bai-xue1//(1. School of Basic Medicine, Chengdu University of Traditional Chinese Medicine, Chengdu, 611137, Sichuan; 2.School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu, 611137, Sichuan)
Objective: To investigate the protective effects and mechanism of Guangxi Yujin on hepatic fibrosis. Method:HSC-T6 was activated by platelet-derived growth factor(PDGF), and then treated by alcohol extracts of Guangxi Yujin. The ELISA method was adopted to detect the contents of collagen Ⅰand Ⅲ in supernatant of hepatic stellate cell (HSC-T6). mRNA expressions of transforming growth factor (TGF)- β1, Smad2, Smad3 were measured by semiquantitative RT-PCR. Result: The contents of collagen Ⅰand Ⅲ in supernatant of HSC-T6, and the expressions of TGF- β1, Smad2, Smad3 mRNA in HSC-T6 were markedly higher (P<0.01) in the model group than those in the blank group. Compared with the model group, the contents of collagen Ⅰand Ⅲin supernatant of HSC-T6 ,and the expression of TGF- β1 in HSC-T6 were lower (P<0.05) in alcohol extracts of Guangxi Yujin group.Conclusion: Guangxi Yujin probably plays a role of anti-hepatic fi brosis by inhibiting TGF -β1/Smad signaling pathway.
Guangxi Yujin; hepatic fi brosis; transforming growth factor (TGF)- β1; Smad
R 285.5
A
1674-926X(2017)04-009-03
成都中医药大学校基金(NO. 030018031)
1.成都中医药大学 基础医学院,四川 成都 611137;2.成都中医药大学 药学院,四川 成都 611137
张技,女,博士研究生,主要从事中医证候的分子生物学研究Tel:13880552842 Email:27629565@qq.com
2017-02-19
(责任编辑:陈思敏)

