鸭坦布苏病毒甲基转移酶的序列分析和结构预测
武学东,张悦天,贾仁勇,3
鸭坦布苏病毒甲基转移酶的序列分析和结构预测
武学东1,2,张悦天1,2,贾仁勇1,2,3
为了确定鸭坦布苏病毒(duck Tembusu virus, DTMUV)发挥甲基转移酶(methyltransferase, MTase)功能的氨基酸序列。本研究运用生物信息学方法,以已知的黄病毒MTase的序列和结构为模板,对GenBank上注入的DTMUV MTase序列进行同源比对分析和结构预测。分析结果表明,DTMUV MTase与WNV,DENV-2,JEV三种病毒MTase的核酸序列同源性分别为64.76%,64.55%,67.33%,氨基酸序列同源性分别为74.71%,68.45%,75.15%;其可能结构含有SAM结合位点且具有典型的4个α螺旋和7个β折叠的黄病毒MTase的结构特点;同时,DTMUV MTase序列上存在黄病毒MTase经典保守位点K-D-K-E;从而为确定DTMUV MTase属于黄病毒MTase家族成员提供一些理论依据。
鸭坦布苏病毒;甲基转移酶;序列分析;结构预测
黄病毒RNA具有5′帽子结构,由于病毒在细胞质中复制而无法利用宿主内核加帽机制,这些病毒已经进化出了自己的甲基转移酶来进行基因组RNA的N7和2′-O甲基化。黄病毒NS5蛋白的N端约300个氨基酸是编码MTase的区域,催化病毒RNA帽子结构中腺苷酸核糖的N7和2′-O甲基化。N7和2′-O甲基化是基因组5′帽子结构形成过程中所必需的[1]。两步甲基化按照GpppA-RNA →m7Gppp A-RNA→m7Gppp Am-RNA先进行N7甲基化后进行2′-O甲基化,从而形成Ⅰ型帽子结构[2]。
鸭坦布苏病毒(DTMUV)属于黄病毒科,黄病毒属,基因组5′端具有Ⅰ型帽子结构,3′端无polyA尾巴结构[3-5]。在形成帽子结构过程中,必然有甲基转移酶(MTase)的参与。而DTMUV发挥MTase功能的蛋白序列还未确定。目前,DENV,WNV,YFV等黄病毒的MTase晶体结构均已被解析[6-8],从而可以为DTMUV MTase的序列分析和结构预测提供参考。晶体结构显示,黄病毒的MTase包括核心区,N端和C端的亚结构域。本研究参照其他黄病毒,运用生物信息学方法对GenBank上标注的DTMUV MTase序列进行分析和结构预测,对其发挥MTase功能的真实性和可靠性做出理论判断。进而,为DTMUV MTase的研究提供理论依据。
1 材料与方法
1.1DTMUV基因序列 DTMUV基因序列为本实验室分离的CQW1株DTMUV基因序列,序列号为KM233707.1。
1.2DTMUV MTase核酸序列同源比对分析 利用DNAMAN软件对CQW1株DTMUVMTase对应的核酸序列和在GenBank中随机抽取的DENV,JEV,WNV 3种病毒MTase对应的核酸序列进行同源比对分析。
1.3DTMUV MTase氨基酸序列的同源比对分析 利用DNAMAN软件对CQW1株DTMUVMTase对应的氨基酸序列和在GenBank中随机抽取的DENV,JEV,WNV 3种病毒MTase对应的氨基酸序列进行同源比对分析。
1.4DTMUV MTase结构预测 利用SWISS-MODEL在线软件和PyMOL软件对DTMUV MTase的三级结构进行预测。
2 结 果
2.1DTMUV基因组结构 DTMUV为黄病毒科,黄病毒属,恩塔雅病毒群。DTMUV病毒基因组为单股正链RNA,有一个ORF框编码3种结构蛋白和7种非结构蛋白以及一个含有23aa的2K蛋白。基因组5′端具有Ⅰ型帽子(m7GpppAmG)结构,其非编码区长为94 nt;3′端不具有polyA尾巴结构,其非编码区长为618 nt[3-4,9]。如图1所示。
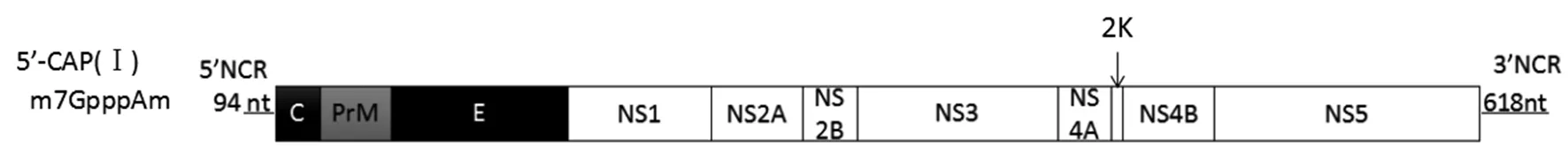
图1 DTMUV基因组结构Fig.1 Structure of the genome of DTMUV
2.2DTMUV MTase核酸序列同源比对分析 由本实验室分离的CQW1株DTMUVMTase对应的核酸序列和在GenBank中随机抽取的DENV,JEV,WNV 3种病毒MTase对应的核酸序列利用DNAMAN软件进行同源比对分析。根据比对结果发现四种病毒的MTase核酸同源性为79.04%,并且MTase的K61-D146-K182-E218经典保守位点[1,10-11]对应的密码子均相同(图2)(注:aaa和aag均能编码K赖氨酸)。同时,利用DNAMAN对4种病毒MTase核酸序列两两比对后,同源性分别为63.58%,70.87%,64.76%,65.54%,64.55%,67.33%(图4)。

注:***标注为K61-D146-K182-E218对应的密码子*** label to mark codons of K61-D146-K182-E218图2 MTase核酸序列同源比对分析Fig.2 Homologous analysis of MTase nucleic acid sequences
2.3DTMUV MTase氨基酸序列的同源比对分析
同样,由本实验室分离的CQW1株DTMUVMTase对应的氨基酸序列和从GenBank中随机抽取的DENV,JEV,WNV 3种病毒MTase对应的氨基酸序列利用DNAMAN进行比对分析。根据序列比对分析结果发现4种病毒的MTase氨基酸序列同源性较高为82.65%,经典保守位点K61-D146-K182-E218在4种病毒MTase氨基酸序列中均一致,非常保守(图3)。同时,利用DNAMAN对四种病毒MTase氨基酸序列两两比对后,同源性分别为68.82%,81.18%,70.83%,74.71%,68.45%,75.15%(图4)。

图3 MTase氨基酸序列同源比对分析Fig.3 Homologous analysis of MTase amino acid sequences
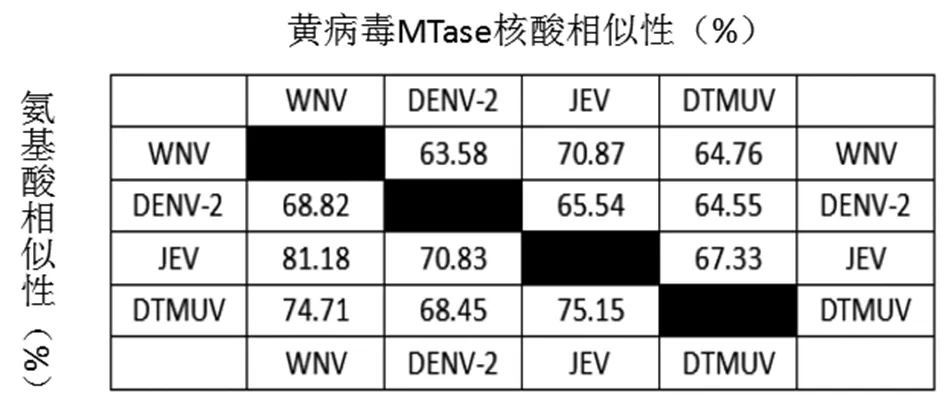
图4 黄病毒MTase核酸和氨基酸相似性Fig.4 Similarity of flaviviruses MTase in nucleotide and protein level
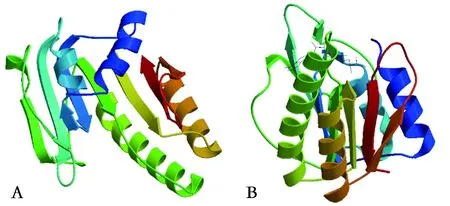
注:A: DTMUV; B: WNV(下同)A: DTMUV; B: WNV (The same below)图5 MTase核心区的三级结构Fig.5 Tertiary structure of MTase core region
2.4DTMUV MTase结构预测 利用SWISS-MODEL和PyMOL软件预测了DTMUV MTase序列的三级结构。结果显示,它展示的是DTMUV MTase的核心区结构,该区域是其功能区,与其他黄病毒MTase核心区的三级结构十分相似。DTMUV MTase的可能结构为4个α螺旋和7个β折叠,属于黄病毒MTase的特有结构,与DENV,WNV,JEV等黄病毒MTase核心区的结构基本一致(图5)。黄病毒MTase含有SAM结合位点,在甲基化过程中作为甲基供体的结合区域[8,12-13]。同时,SWISS-MODEL软件预测结果显示了在DTMUV MTase结构上同样含有SAM结合位点相似区,可推测该区域为甲基化过程中作为甲基供体的结合区域。在大多数细胞和病毒中,2′-O甲基转移酶的活性部位存在K-D-K-E氨基酸四分体且高度保守,它们在三级结构上聚集在一起形成活性口袋。同样的,黄病毒MTase在结构上具有由经典保守氨基酸四分体(K61-D146-K182-E218)位点形成的活性口袋且高度保守[11,14-15]。而利用PyMOL软件预测结果显示,在DTMUV MTase可能结构上也能发现氨基酸四分体K61-D146-K182-E218的存在,并在三级结构上聚集在一起形成活性口袋(图6)。
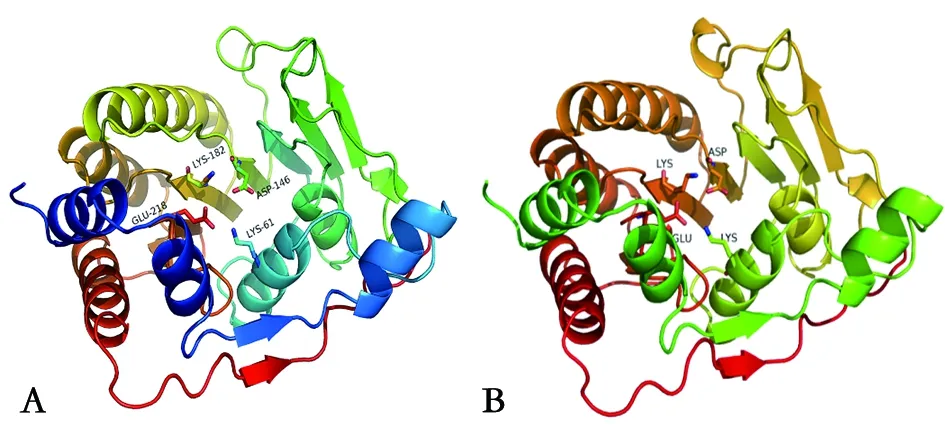
图6 MTase的三级结构Fig.6 Tertiary structure of MTase
3 讨 论
黄病毒含有I型帽子结构。因为黄病毒RNA是在细胞质中进行复制而不能利用宿主的酶系统,所以进化出了自身的酶系统,黄病毒的NS5蛋白N端具有甲基转移酶功能区域,其结构形成了黄病毒MTase的特有结构特征。本研究将DTMUV与DENV-2,JEV,WNV的MTase核心区的核酸序列和氨基酸序列同源比对及两两比对分析,能够得到较高的同源性。其构成酶活口袋的关键位点K-D-K-E在DTMUV MTase的序列上也很保守,从核酸序列和氨基酸序列的同源比对分析上能够初步提供DTMUV MTase属于黄病毒MTase家族成员的一些理论依据。利用SWISS-MODEL和PyMOL软件预测的DTMUV MTase核心区可能结构具有典型的黄病毒MTase 4个α螺旋和7个β折叠的结构特征,且含有一个SAM结构,进一步为DTMUV MTase能够发挥甲基转移酶功能提供了一些理论依据。然而,DTMUV MTase是否具有MTase功能需要实质性地去检测其酶活性。目前DENV,JEV,WNV等[2,15-16]黄病毒的体外酶活性已经被检测,为DTMUV MTase的酶活测定提供了参考。接下来的工作,我们将进行体外测定DTMUV MTase的酶活活性以及功能相关研究。
近年来,随着黄病毒MTase的研究逐渐深入,黄病毒MTase发挥的功能,在病毒中充当的角色及对宿主的影响已经有大量的研究报道。黄病毒MTase发挥功能的核心区是由SAM结合位点、RNA结合位点和GTP结合位点来执行其功能,SAM结合位点作为甲基供体的结合区域,GTP结合区结合m7G,RNA结合位点结合未加帽的病毒RNA。当SAM结构类似物存在时,会和SAM竞争该区域,从而影响甲基化活性;同时,该区域的保守位点突变会影响MTase活性[11,17]。GTP结合区既可以结合GTP的鸟苷部分进行鸟苷酸转移,也可以结合m7Gppp A-RNA的m7G进行甲基化反应;该区域位点突变会影响2′-O甲基化,但不影响N7甲基化[12,14];同时,在甲基化过程中,加入外源GTP会与m7G会发生竞争,相互拮抗对方结合GTP结合区[18]。RNA结合位点研究尚少,有报道称在GTase反应到MTase反应时,RNA需要重新定位[8]。在黄病毒MTase酶活口袋上存在经典保守位点K-D-K-E氨基酸四分体,该四分体的突变会影响MTase的N7和2′-O甲基化功能,当N7甲基化功能缺失后,突变病毒将不能复制[2];当2′-O甲基化功能缺失后,突变病毒复制能力有所下降但不影响病毒增殖,会降低病毒毒力,接种小鼠后能产生很好的免疫原性,作为疫苗免疫小鼠能够起到很好的保护效果[15-16]。最近又有重大发现,MTase使病毒RNA形成与宿主细胞mRNA非常相似的帽子结构,从而导致宿主天然免疫系统无法识别和清除,形成天然免疫逃逸[19-20]。并且有研究表明,黄病毒2′-O甲基转移酶甲基化形成5′帽子结构的病毒能够逃逸IFIT1的抗病毒作用[21]。从另一个角度发现,IFIT1优先结合2′-O未甲基化的病毒RNA,使真核翻译起始因子无法结合病毒RNA,最终抑制病毒的复制和翻译[22-23]。目前为止,黄病毒MTase的大量研究报道有效的阐明了MTase在病毒侵染与宿主抗病毒之间所起的重要作用;而鸭坦布苏病毒MTase的研究将会丰富黄病毒MTase的研究内容。使用生物信息学的方法只能将前人大量的试验结果进行总结,从而便于对未知结构和功能的蛋白质进行预测。但是,要验证鸭坦布苏病毒MTase的具体功能还需具体试验数据来提供更为可靠的依据。
[1] Zhou Y, Ray D, Zhao Y, et al. Structure and function of flavivirus NS5 methyltransferase[J]. J Virol, 2007, 81(8):3891-3903.
[2] Ray D, Shah A, Tilgner M, et al. West Nile virus 5′-cap structure is formed by sequential guanine N-7 and ribose 2′-O methylations by nonstructural protein 5[J]. J Virol, 2006, 80(17): 8362-8370.
[3] Liu P, Lu H, Li S, et al. Duck egg drop syndrome virus: an emerging Tembusu-related flavivirus in China[J]. Sci China Life Sci, 2013, 56(8):701-710.
[4] Liu P, Lu H, Li S, et al. Genomic and antigenic characterization of the newly emerging Chinese duck egg-drop syndrome flavivirus: genomic comparison with Tembusu and Sitiawan viruses[J]. J General Virol, 2012, 93(10):2158-2170.
[5] Wang J, Liu W, Meng G, et al. Isolation and genome characterization of a novel duck Tembusu virus with a 74 nucleotide insertion in the 3′ non-translated region[J]. Avian Pathol, 2015, 44(2): 92-102.
[6] Geiss BJ, Thompson AA, Andrews AJ, et al. Analysis of flavivirus NS5 methyltransferase cap binding[J]. J Mol Biol, 2009, 385(5): 1643-1654.
[7] EgloffMP,BenarrochD,SeliskoB, et al. An RNA cap (nucleoside‐2′‐O‐)‐methyltransferase in the flavivirus RNA polymerase NS5: crystal structure and functional characterization[J]. Embo J, 2002, 21(11): 2757-2768.
[8] Yap LJ, Luo D, Chung KY, et al. Crystal structure of the dengue virus methyltransferase bound to a 5′-capped octameric RNA[J]. PLoS One, 2010, 5(9): e12836.
[9] Tang Y, Diao Y, Gao X, et al. Analysis of the complete genome of Tembusu virus, a flavivirus isolated from ducks in China[J]. Transbound Emerg Dis, 2012, 59(4):336-343.
[10] Dong H, Fink K, Züst R, et al. Flavivirus RNA methylation[J]. J General Virol, 2014, 95(4):763-778.
[11] Kroschewski H, Lim SP, Butcher RE, et al. Mutagenesis of the dengue virus type 2 NS5 methyltransferase domain[J]. J Biologic Chem, 2008, 283(283):19410-19421.
[12] Dong H, Ren S, Zhang B, et al. West Nile virus methyltransferase catalyzes two methylations of the viral RNA cap through a substrate-repositioning mechanism[J]. J Virol, 2008, 82(9): 4295-4307.
[13] Egloff MP, Decroly E, Malet H, et al. Structural and functional analysis of methylation and 5′-RNA sequence requirements of short capped RNAs by the methyltransferase domain of dengue virus NS5[J]. J Mol Biol, 2007, 372(3): 723-736.
[14] Dong HP, Chang DC, Xie XP, et al. Biochemical and genetic characterization of dengue virus methyltransferase[J]. Virology, 2010, 405(2):568-578.
[15] Züst R, Dong H, Li XF, et al. Rational design of a live attenuated dengue vaccine: 2′-O-methyltransferase mutants are highly attenuated and immunogenic in mice and macaques[J]. PLoS Pathog, 2013, 9(8): e1003521.
[16] Li SH, Dong H, Li XF, et al. Rational design of a flavivirus vaccine by abolishing viral RNA 2′-O methylation[J]. J Virol, 2013, 87(10): 5812-5819.
[17] Chung KY, Dong H, Chao AT, et al. Higher catalytic efficiency of N-7-methylation is responsible for processive N-7 and 2′-O methyltransferase activity in dengue virus[J]. Virology, 2010, 402(1):52-60.
[18] Benarroch D, Egloff MP, Mulard L, et al. A structural basis for the inhibition of the NS5 dengue virus mRNA 2′-O-methyltransferase domain by ribavirin 5′-triphosphate[J]. J Biologic Chem, 2004, 279(34):35638-35643.
[19] Daffis S, Szretter KJ, Schriewer J, et al. 2′-O methylation of the viral mRNA cap evades host restriction by IFIT family members[J]. Nature, 2010, 468(7322):452-456.
[20] Züst R, Cervantesbarragan L, Habjan M, et al. Ribose 2′-O-methylation provides a molecular signature for the distinction of self and non-self mRNA dependent on the RNA sensor Mda5[J]. Nat Immunol, 2011, 12(2):137-143.
[21] Szretter KJ, Daniels BP, Cho H, et al. 2′-O methylation of the viral mRNA cap by West Nile virus evades Ifit1-dependent and -independent mechanisms of host restriction in vivo[J]. PLoS Pathog, 2012, 8(5):e1002698.
[22] Habjan M, Hubel P, Lacerda L, et al. Sequestration by IFIT1 impairs translation of 2′O-unmethylated capped RNA[J]. PLoS Pathog, 2013, 9(10):e1003663.
[23] Kimura T, Katoh H, Kayama H, et al. Ifit1 inhibits Japanese encephalitis virus replication through binding to 5′ capped 2′-O unmethylated RNA[J]. J Virol, 2013, 87(18):9997-10003.
SequenceanalysisandstructurepredictionofthemethyltransferaseofduckTembusuvirus
WU Xue-dong1,2, ZHANG Yue-tian1,2, JIA Ren-yong1,2,3
(1.ResearchCenterforAvianDiseases,CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China;2.InstituteofPreventiveVeterinaryMedicine,CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China;3.KeyLaboratoryofAnimalDiseasesandHumanHealthofSichuanProvince,SichuanAgriculturalUniversity,Chengdu611130,China)
In order to determine the amino acid sequence of functionthat play a role of methyltransferase (MTase) activity in duck Tembusu virus (DTMUV),we have made sequence analysis and structure prediction of the MTase in DTMUV by bioinformatics methods, as well as using the sequence and structure of MTase in other flaviviruses which have been reported. The bioinformatical analysis results showed that the MTase and the MTase of other three kinds of flaviviruses had the higher homology in nucleotide sequence and amino acid sequence, for 64.76%, 64.55%, 67.33% and 74.71%, 68.45%, 75.15% respectively, and the same basic structural characteristics which contained SAM binding site and had a typical of 4 alpha screw and 7 beta folding. At the same time, there were classical conservative sites K-D-K-E of flavivirus MTase in DTMUV MTase sequence. In conclusion, they imply that the MTase of DTMUV might belong to MTase family of flaviviruses .
duck Tembusu virus; methyltransferase; sequence analysis; structure prediction
Jia Ren-yong, Email: jiary@sicau.edu.cn
10.3969/j.issn.1002-2694.2017.10.005
四川省科技厅应用基础研究项目资助 (No.2017JY0014)
贾仁勇,Email:jiary@sicau.edu.cn
1.四川农业大学禽病防治研究中心, 成都 611130;
2.四川农业大学预防兽医研究所, 成都 611130;
3.动物疫病与人类健康四川省重点实验室, 成都 611130
373
A
1002-2694(2017)10-0877-05
Funded by the Application and Base Research Project of Sichuan Science and Technology Department (No.2017JY0014)
2017-06-30编辑李友松

