48株鲍曼不动杆菌氨基糖苷类抗生素耐药基因检测
郭 普,乔 艳,李 竟
48株鲍曼不动杆菌氨基糖苷类抗生素耐药基因检测
郭 普1,乔 艳2,李 竟1
目的了解鲍曼不动杆菌氨基糖苷类抗生素耐药基因分布情况。方法收集蚌埠医学院第一附属医院2015年1月至12月临床分离的48株泛耐药鲍曼不动杆菌,VITEK 2 Compact进行鉴定和药敏实验。PCR法检测12个氨基糖苷类修饰酶基因和3个甲基化酶基因以及外排泵基因adeB。结果在实验的16个基因中,共检出4种氨基糖苷类抗生素耐药基因aac(6′)-Ib、armA、adeB和ant(3″)-Ia,其中aac(6′)-Ib检出率为39.6%(19/48),armA基因检出率为89.6%(43/48),adeB检出率89.6%(43/48),ant(3″)-Ia检出率为10.4%(5/48),其余基因均未检出;存在两种以上耐药基因的共39株,检出率为81.3%(38/48)。结论aac(6′)-Ib、armA基因以及外排泵adeB是介导我院鲍曼不动杆菌氨基糖苷类抗生素耐药的主要基因。
鲍曼不动杆菌;氨基糖苷类抗生素;耐药
鲍曼不动杆菌(Acinetobacterbaumannii)是医院感染常见的条件致病菌,其引起的感染已跃居非发酵菌的首位[1-2]。特别是泛耐药鲍曼不动杆菌引起的感染呈逐年上升的趋势,给临床抗感染治疗带来很大的挑战[3]。氨基糖苷类抗生素可以联合舒巴坦、替加环素等抗生素治疗多重耐药鲍曼不动杆菌引起的感染。然而,随着氨基糖苷类抗生素的临床应用,其耐药性也有所上升。为探明我院鲍曼不动杆菌氨基糖苷类抗生素耐药机制,笔者对我院临床分离的48株泛耐药的鲍曼不动杆菌进行常见的12个氨基糖苷类修饰酶(aminoglycoside-modifying enzymes, AMEs)基因、3个16S rRNA甲基化酶基因和1个外排泵基因进行检测分析。现报道如下。
1 材料与方法
1.1菌株来源 2015年蚌埠医学院第一附属医院临床分离的48株泛耐药的鲍曼不动杆菌(剔除重复菌株)。
1.2菌株鉴定和药敏 采用VITEK 2 compect全自动细菌鉴定药敏分析仪进行细菌鉴定和药敏实验,结果判读根据CLSI 2015版标准。
1.3 特异性基因PCR扩增和序列分析
1.3.1引物 12个氨基糖苷类修饰酶基因(ant(2″)-Ia, ant(3″)-Ia, ant(4′)-Ia, aac(3)-I, aac(3)-IIc. aac(6′)-Ib, aac(6′)-II, aph(2″)-Ib, aph(2″)-Ic, aph(2″)-Id, aph(3′)-IIIa, aph(4)-Ia)和3个甲基化酶基因(rmtB, rmtC, armA)以及外排泵基因adeB参照文献[4-5],由上海生工生物工程有限公司合成,引物序列及产物大小见表1。
1.3.2PCR扩增 PCR反应体积为50 μL,反应体系:EX Taq酶0.5 μL、dNTP Mixture 4 μL、10×PCR Buffer(Mg2+plus)5 μL、模板DNA 2 μL、上下游引物各1 μL、H2O补足至50 μL。循环参数:94 ℃预变性5 min,94 ℃ 30 s、退火30 s(退火温度见表1)、72 ℃延伸60 s,30个循环、最后72 ℃ 10 min、4 ℃恒温。将扩增产物进行凝胶电泳,成像,分析结果,同时设空白为阴性对照,阳性对照为阳性基因菌株。阳性基因菌株由安徽医科大学第一附属医院沈继录博士惠赠。
1.4质控菌株 ATCC25922大肠埃希菌ATCC25922购自卫生部临检中心。
表1 各基因型片段引物序列、退火温度及产物长度
Tab.1 Primer sequences annealing temperature and products size of the genotypes

GenotypesPrimersequences(5′→3′)Annealingtemperature/℃Productssize/bpant(2″)⁃IaF:GCTCACGCAACTGGTCCAGAR:GGCACGCAAGACCTCAACCT58719ant(3″)⁃IaF:TCCAAGCAGCAAGCGCGTTAR:CCGACTACCTTGGTGATCTC58887aac(3)⁃IF:TTACGCAGCAGCAACGATGTR:GTTGGCCTCATGCTTGAGGA58420aac(3)⁃IIcF:ACGCGGAAGGCAATAACGGAR:TAACCTGAAGGCTCGCAAGA55854ant(4′)⁃IaF:CTGCTAAATCGGTAGAAGCR:CAGACCAATCAACATGGCACC55172aac(6′)⁃IbF:CATGACCTTGCGATGCTCTAR:GCTCGAATGCCTGGCGTCTT58490aac(6′)⁃IIF:TTCATGTCCGCGAGCACCCCR:GACTCTTCCGCCATCGCTCT55178aph(2”)⁃IbF:CTTGGACGCTGAGATATATGAGCACR:GTTTGTAGCAATTCAGAAACACCCTT55867aph(2”)⁃IcF:CCACAATGATAATGACTCAGTTCCCR:CCACAGCTTCCGATAGCAAGAG55444aph(2”)⁃IdF:GTGGTTTTTACAGGAATGCCATCR:CCCTCTTCATACCAATCCATATAACC55641aph(3′)⁃IIIaF:GGCTAAAATGAGAATATCACCGGR:CTTTAAAAAATCATACAGCTCGCG55278aph(4)⁃IaF:CTGAACTCACCGCGACGTCTR:TCCACTATCGGCGAGTACTT58977rmtBF:GCTTTCTGCGGGCGATGTAAR:ATGCAATGCGCGGCTCGTAT55173armAF:ATTCTGCCTATCCTAATTGGR:ACCTATACTTTATCGTCGTC55315rmtCF:CGAAGAAGTAACAGCCAAAGR:ATCCCAACATCTCTCCCACT55711adeBF:AAAGACTTCAAAGAGCGGACTAR:ATTGTCACCTTGTGGCAACCCT49273
2 结 果
48株鲍曼不动杆菌中共检出氨基糖苷类修饰酶aac(6′)-Ib19株,检出率为39.6%(19/48),ant(3″)-Ia5株,检出率为10.4%。16SrRNA甲基化酶armA基因和外排泵基因adeB各检出43株,检出率为89.6%(43/48),其余基因均为阴性,见表2。部分菌株PCR扩增结果见图1,2。
表2 48株鲍曼不动杆菌氨基糖苷类抗生素耐药基因阳性率
Tab.2 Identification of resistance genes for aminoglycosides in Acinetobacter baumannii 48 strains
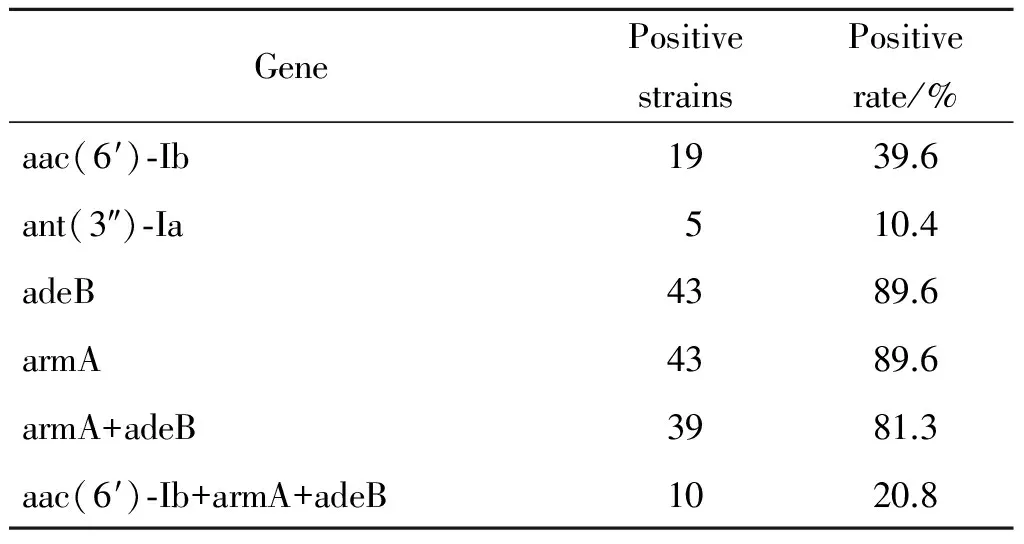
GenePositivestrainsPositiverate/%aac(6′)⁃Ib1939.6ant(3″)⁃Ia510.4adeB4389.6armA4389.6armA+adeB3981.3aac(6′)⁃Ib+armA+adeB1020.8
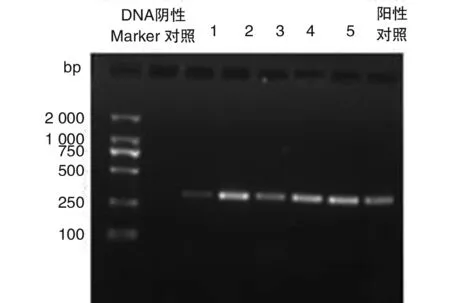
注:泳道1-5:临床分离的菌株。Lane1-5: Acinetobacter baumannii isolated from patients图1 armA基因型PCR检测结果Fig.1 PCR analysis of armA genotype
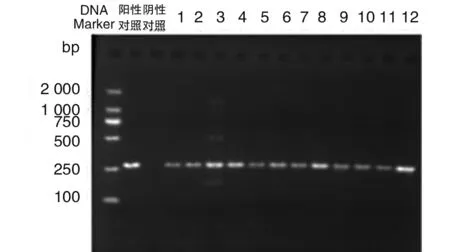
注:泳道1-12:临床分离的菌株。Lane1-12: Acinetobacter baumannii isolated from patients图2 adeB基因型PCR检测结果Fig.2 PCR analysis of adeB genotype
3 讨 论
鲍曼不动杆菌是医院感染常见重要的条件致病菌,常引起呼吸机相关性肺炎、尿路感染、创伤感染、血流感染和继发性脑膜炎等[6]。近年来,临床大量广谱抗菌素的使用、机械通气等侵入性诊疗活动的增加,外科手术、医院内的交叉感染等因素,使鲍曼不动杆菌感染率逐年增加,耐药性也不断上升[3,6]。特别是碳青霉烯类抗菌素耐药菌株多为多重耐药或泛耐药菌株,给临床抗感染治疗带来极大的挑战。
2012年中国鲍曼不动杆菌感染诊治与防控专家共识指出氨基糖苷类抗生素联合舒巴坦或替加环素等抗生素可以作为多重耐药鲍曼不动杆菌的治疗选择[7]。氨基糖苷类抗生素具有广谱性、高效性的特点,被广泛应用于治疗临床革兰阴性杆菌所致的感染,其主要是通过作用于细菌30S核糖体的16SrRNA解码区A部位,抑制细菌蛋白质的合成或诱导合成错误蛋白,抑制已经合成蛋白的释放,而导致细菌的死亡[8]。近年来,氨基糖苷类抗生素对鲍曼不动杆菌耐药率也有所上升,2014年中国CHINET耐药监测网数据显示鲍曼不动杆菌对阿米卡星耐药率为47.4%[2]。喻华等[9]对四川省2012年细菌耐药性研究数据显示鲍曼不动杆菌对于阿米卡星耐药率为42.9%。郭普等[10]对蚌埠医学院第一附属医院2014年病原菌耐药性监测研究发现鲍曼不动杆菌对于阿米卡星的耐药率为33.7%。
鲍曼不动杆菌对于氨基糖苷类抗生素的耐药机制主要为氨基糖苷修饰钝化酶以及16S rRNA甲基化酶的产生,细菌外膜蛋白的丢失和外排泵的高表达也参与了细菌的耐药[11]。本研究显示:我院临床分离的48株泛耐药鲍曼不动杆菌中检出2种氨基糖苷类修饰酶,aac(6′)-Ib19株,检出率为39.6%;ant(3″)-Ia5株,检出率为10.4%;与唐朝贵等[12]报道的主要产生aac(2')-Ib、aac(3)-I、aac(6')-Ib、ant(3'')-I、aph(3')-I 型修饰钝化酶有所不同,这可能是各地区抗生素选择压力不同导致耐药性的差异。16S rRNA甲基化酶是近年来发现的一种由质粒介导的耐药机制,它能甲基化修饰氨基糖苷类药物的作用靶位16S rRNA,使得药物无法结合,导致氨基糖苷类抗生素高水平耐药,编码16S rRNA甲基化酶的基因主要是armA、rmtB,其中armA基因主要见于鲍曼不动杆菌。本研究的48株菌中armA基因携带率达到了为89.6%(43/48),与刘晓庆等[13]报道相近,表明其是引起鲍曼不动杆菌对氨基糖苷类药物耐药的重要原因。adeB 属于外排系统的RND超家族,它与 AdeA、AdeC形成三聚体结构,参与对氨基糖苷类等多种药物的外排转运。48株鲍曼不动杆菌中43株携带外排泵adeB基因,检出率为89.6%(43/48),与蒯守刚等报道一致[5],提示外排泵adeB基因可能是介导我院鲍曼不动杆菌氨基糖苷类抗生素耐药的又一个重要因素。有待于进一步用RT-PCR检测其表达量,探明其在介导耐药中的作用。此外,有39株鲍曼不动杆菌同时携带adeB和armA基因,10株同时携带aac(6′)-Ib、adeB和armA基因,说明这些菌株氨基糖苷类抗生素耐药是由多种耐药基因共同作用的结果。
综上所述 ,我院临床分离的鲍曼不动杆菌携带多种氨基糖苷类耐药基因,应关注鲍曼不动杆菌对氨基糖苷类抗生素的耐药性,加强耐药机制监测,了解耐药株流行情况,为延缓细菌耐药性产生,控制耐药菌株的播散和流行,临床合理选用抗菌药物以及为新型抗菌药物的研发提供可靠的实验室依据。
[1] Hang J, Chen EZ, Qiu HP, et al. Sources of multidrug-resistantAcinetobacterbaumanniiand its role in respiratory tract colonization and nosocomial pneumonia in intensive care unit patients[J]. Chin Med(Engl), 2013, 126(10): 1826-1831.
[2] Hu FP, Zhu DM, Wang F, et al. 2014 CHINET surveillance of bacterial resistance in China[J]. Chin J Infect Chemother, 2015, 15(5): 401-410.DOI: 10.3969/j.issn.1009-7708.2015.05.001(in Chinese)
胡付品,朱德妹,汪复,等.2014年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2015,15(5):401-410.
[3] Inchai J, Liwsrisakun C, Theerakittikul T, et al. Risk factors of multidrug-resistant, extensively drug-resistant and pandrug-resistantAcinetobacterbaumanniiventilator-associated pneumonia in a Medical Intensive Care Unit of University Hospital in Thailand[J]. J Infect Chemother, 2015, 21(8): 570-574.DOI: 10.1016/j.jiac.2015.04.010
[4] Nie L, Lv Y, Yuan M, et al. Genetic basis of high level aminoglycoside resistance inAcinetobacterbaumanniifrom Beijing, China[J]. Acta Pharm Sin B,2014, 4(4): 295-300. DOI: 10.1016/j.apsb. 2014.06.004.
[5] Kuai SG, Huang LH, Pei H, et al. Study on the molecular mechanism of aminoglycoside resistance toAcinetobacterbaumannii[J]. Lab Med, 2012, 27(8): 619-623.DOI: 10.3969/j.issn.1673-8640.2012.08.001 (in Chinese)
蒯守刚,黄利华,裴豪,等.鲍曼不动杆菌对氨基糖苷类药物耐药机制研究[J].检验医学,2012,27(8):619-623.
[6] Fu Q, Ye H, Liu S. Risk factors for extensive drug-resistance and mortality in geriatric inpatients with bacteremia caused byAcinetobacterbaumannii[J]. Am J Infect Control, 2015, 43(8): 857-860.DOI: 10.1016/j.ajic.2015.03.033.
[7] Chen BY,He LX,Hu BJ. Consensus of the Chinese specialists for diagnosis, treatment & control ofAcinetobacterbaumanniiinfection[J].Natl Med J China,2012, 92(2): 76-85. DOI: 10.3760/cma.j.issn.0376-2491.2012.02.002 (in Chinese)
陈佰仪,何礼贤,胡必杰,等.中国鲍曼不动杆菌感染诊治与防控专家共识[J]. 中华医学杂志, 2012, 92(2): 76-85.
[8] Xiao SZ,Han LZ,Chu HQ, et al. Detection of aminoglycoside resistance related genes in multidrug-resistantAcinetobacterbaumanniiisolated from a single institute of Shanghai, China[J]. Panminerva Med,2015, 57(1): 49-53.
[9] Yu H, Liu H, Huang WF, et al. Sichuan Provincial Antimicrobial Resistant Investigation Net 2012 annual report: Bacterial drug resistance surveillance in Sichuan[J]. Chin J Antibiotics, 2014, 39(5): 332-337. DOI: 10.3969/j.issn.1001-8689.2014.05.003 (in Chinese)
喻华,刘华,黄文芳,等.四川省细菌耐药监测网2012年细菌耐药性监测[J].中国抗生素杂志,2014,39(5):332-337.
[10] Guo P, Qiao Y, Zhang HT, et al. Surveillance of antibiotic resistance in clinical isolates from the First Affiliated Hospital of Bengbu Medical College during 2014[J]. Chin J Antibiotics, 2015,40(10): 760-765. DOI: 10.3969/j.issn.1001-8689.2015.10.009 (in Chinese)
郭普,乔艳,张海涛,等.2014年蚌埠医学院第一附属医院病原菌耐药性监测[J].中国抗生素杂志,2015,40(10):760-765.
[11] Aghazadeh M,Rezaee MA,Nahaei MR, et al. Dissemination of aminoglycoside-modifying enzymes and 16S rRNA methylases amongAcinetobacterbaumanniiandPseudomonasaeruginosaisolates[J]. Microb Drug Resist,2013, 19(4): 282-288.DOI: 10.1089/mdr.2012.0223
[12] Tang CG, Li QH, Lin T. Spread of aminoglycoside modifying enzyme gene: aac(2')-Ib in drug-resistantA.baumannii[J]. Chin J Antibiotics, 2014, 39(11): 844-848. DOI: 10.3969/j.issn.1001-8689.2014.11.009 (in Chinese)
唐朝贵,李前辉,林涛,等.氨基糖苷类修饰酶基因aac(2')-Ib型在耐药鲍曼不动杆菌中流行[J].中国抗生素杂志,2014,39(11):844-848.
[13] Liu XQ, Chen J, Li H, et al. Study of aminoglycoside drug-resistant gene on the plasmid ofAcinetobacterbaumannii[J]. Chin J Antibiotics, 2012, 37(5): 335-356. DOI: 10.3969/j.issn.1001-8689.2012.05.003 (in Chinese)
刘晓庆,陈娇,李华,等.鲍曼不动杆菌质粒上氨基糖苷类耐药基因的研究[J].中国抗生素杂志,2012,37(5):335-356.
AminoglycosideresistancegenesofAcinetobacterbaumannii
GUO Pu1, QIAO Yan2, LI Jing1
(1.DepartmentofClinicalMedicalLaboratory,theFirstAffiliatedHospitalofBengbuMedicalCollege,Bengbu233004,China;2.DepartmentofInfeetionsDiseases,theFirstAffiliatedHospitalofBengbuMedicalCollege,Bengbu233004,China)
To investigate the distribution of the resistance genes ofAcinetobacterbaumanniito aminoglycoside, 48 strains of extensively drug resistantAcinetobacterbaumanniiwere collected from the First Affiliated Hospital of Bengbu Medical College from January to December,2015. The drug sensitivity test and identification were performed by VITEK 2 compact automatic microorganism instrument. Twelve aminoglycosides modifying enzymes, three 16SrRNA methylase genes and efflux pump abeB gene were detected from these isolates by PCR. Results showed that among these experimental 16 genes, aac(6′)-Ib gene was detected from 19 of 48 isolates (39.6%), botharmA andadeB genes were 43 (89.6%), ant(3″)-Ia gene was from 5 (10.4%), while the other genes were not found.And more than two gene types were amplified from 39 of 48 strains (81.3%). In conclusion,the aac(6′)-Ib, armA gene and efflux pump adeB may play a key role in drug resistance to aminoglycosides antibiotics ofAcinetobacterBaumanniin our hospital.
Acinetobacterbaumanni; aminoglycosides antibiotics; drug resistance
10.3969/j.issn.1002-2694.2017.10.012
1.蚌埠医学院第一附属医院检验科,蚌埠 233004;
2.蚌埠医学院第一附属医院感染性疾病科,蚌埠 233004
378.2
A
1002-2694(2017)10-0912-04
2017-04-05编辑张智芳

