29种毒力基因在91株食源性单核细胞增生李斯特氏菌中的分布
, , , , ,
·论著·
29种毒力基因在91株食源性单核细胞增生李斯特氏菌中的分布
李秀娟,赵冬,潘琢,高伟利,徐保红,秦丽云
目的了解河北省食源性单核细胞增生李斯特菌(Listeriamonocytogenes,Lm)毒力基因分布特征。方法采用普通PCR方法对Lm的29个毒力基因(包括毒力岛Ⅰ在内的6个位点:prfA、plcA、plcB、hlyA、mpl和actA;内化素家族的10个位点:inlA、inlB、inlC、inlD、inlE、inlF、inlG、inlH/C2、inlI和inlJ;其他13个毒力相关位点:bsh、srtA、iap、sigB、virR、mprF、dltA、dltB、dltC、dltD、srtB、fbpA和hpt)进行检测。结果在91株Lm中,有23个毒力基因的检出率为100%。26株Lm的29种毒力基因全部检出,65株Lm存在inlD、inlF、inlG、inlH/C2、inlJ和mpl等6个毒力基因的不同缺失。缺失最严重的为inlG和inlF,缺失率分别为60.44%和54.95%;其次为mpl基因,缺失率为19.78%。根据毒力基因缺失情况,91株菌可分为10个基因型,优势毒力基因型为具有全部23种毒力基因的Ⅰ型。石家庄地区的毒力菌株缺失率(41/52)高于河北北部地区(11/22)。结论河北省食源性Lm的毒力基因携带率高,毒力基因缺失具有多样性且存在地域差异。
单核细胞增生李斯特菌;毒力基因;分布特征
单核细胞增生李斯特氏菌(Listeriamonocytogenes,Lm)是一种重要的食源性人兽共患病原菌,是一种兼性胞内寄生菌,可引起人和多种动物的胃肠炎、脑膜炎、败血症、流产等,新生儿、孕妇、老年人和免疫功能低下者更易感染发病。Lm可穿越宿主的3个屏障系统进入机体,引起侵袭性感染,而该侵袭性由多种毒力基因和酶有关,目前研究的毒力基因主要有与黏附和侵袭有关的因子、与胞内感染有关的因子,以及毒力调控因子和应答调控因子等。研究报道显示,Lm的毒力基因携带率较高,但也有不同程度的基因缺失现象,缺失情况各有不同[1-3]。为了能够进一步了解该菌毒力基因的分布特点,本研究对分离自河北省的91株食源性Lm进行了29个毒力基因的检测,为该菌致病性的评估和研究提供进一步参考。
1 材料和方法
1.1 材料
1.1.1菌株 本研究检测的91株食源性Lm,均于2005-2011年间(无2009年)分离自来源于河北省不同地区的生禽肉、生畜肉、水食产品、速冻米面制品及凉拌菜。其中52株Lm分离株由石家庄市疾病预防控制中心检出,其余39株Lm由河北省疾病预防控制中心馈赠。所有Lm菌株均经API Listeria 鉴定试剂条进行鉴定、确认, 并经多重PCR血清型分型[4], 其中 1/2a型(1/2a和3a) 41株、1/2b 型(1/2b、3b和7)30株、1/2c型(1/2c和3c)7株、4b 型(4b、4d和4e)13株。
1.1.2试剂 GoTaq○RColorless Master Mix(美国Promega公司,批号:00000390447);PCR 引物(大连TAKARA公司合成)。
1.1.3仪器9700型PCR仪(美国ABI公司);Qiaxcel 毛细管电泳仪(德国 Qiagen 公司)。
1.2 方法
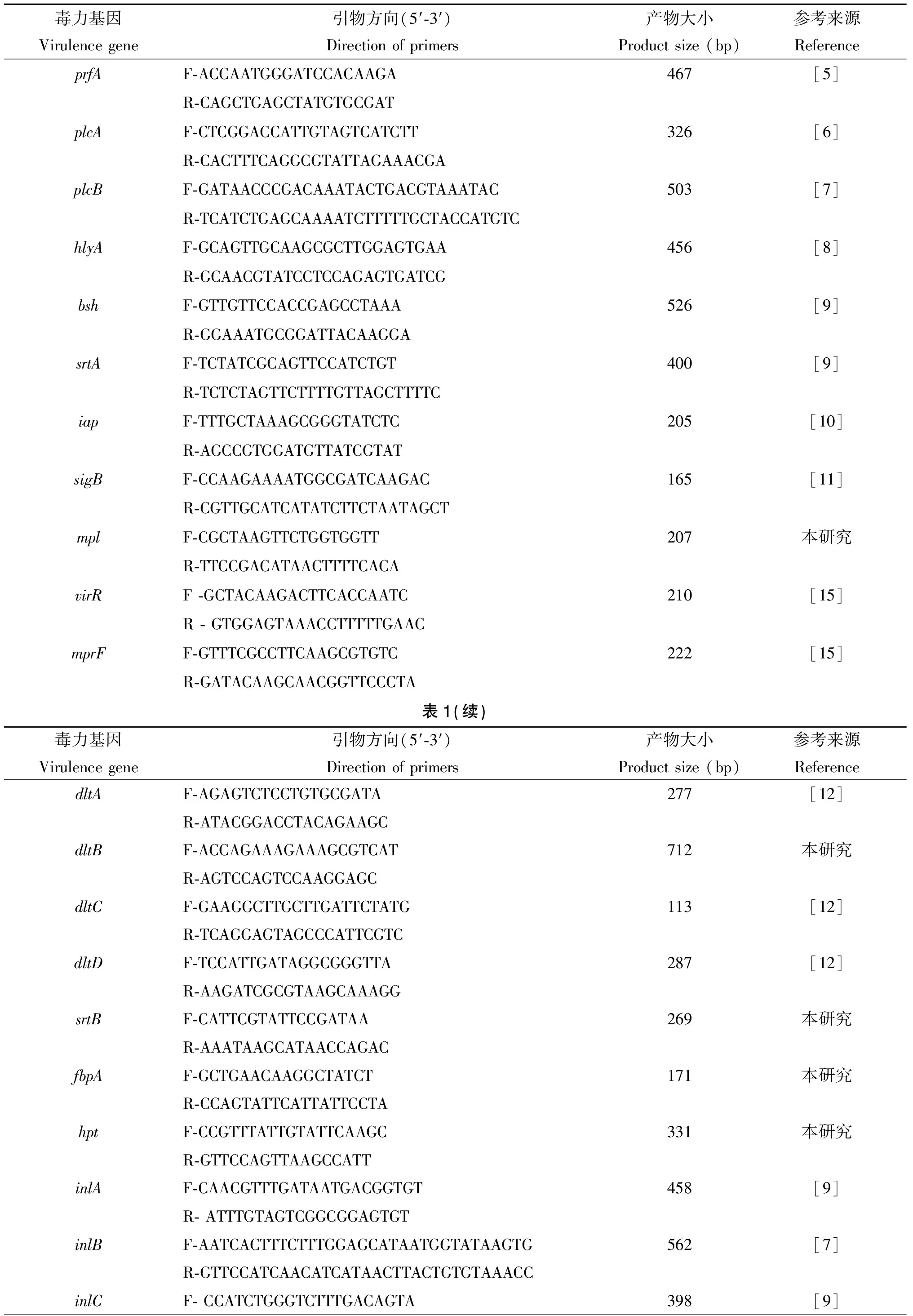
1.2.1毒力基因扩增引物 参考文献[5-14],筛选出29个毒力基因,包括毒力岛Ⅰ(IPL-1)在内的6个位点prfA、plcA、plcB、hlyA、mpl和actA;毒力岛Ⅱ(IPL-2)即内化素家族的10个位点inlA、inlB、inlC、inlD、inlE、inlF、inlG、inlH/C2、inlI和inlJ;其他与毒力相关的13个毒力位点:bsh、srtA、iap、sigB、virR、mprF、dltA、dltB、dltC、dltD、srtB、fbpA和hpt。引物设计采用Primer5.0软件,根据NCBI上已经公布的序列,选择保守性较高的区域作为引物设计区域(表1)。
表1 29种毒力基因检测用PCR引物
Tab.1 Primers of 29 virulence genes of Lm
毒力基因Virulencegene引物方向(5′⁃3′)Directionofprimers产物大小Productsize(bp)参考来源ReferenceprfAF⁃ACCAATGGGATCCACAAGA467[5]R⁃CAGCTGAGCTATGTGCGATplcAF⁃CTCGGACCATTGTAGTCATCTT326[6]R⁃CACTTTCAGGCGTATTAGAAACGAplcBF⁃GATAACCCGACAAATACTGACGTAAATAC503[7]R⁃TCATCTGAGCAAAATCTTTTTGCTACCATGTChlyAF⁃GCAGTTGCAAGCGCTTGGAGTGAA456[8]R⁃GCAACGTATCCTCCAGAGTGATCGbshF⁃GTTGTTCCACCGAGCCTAAA526[9]R⁃GGAAATGCGGATTACAAGGAsrtAF⁃TCTATCGCAGTTCCATCTGT400[9]R⁃TCTCTAGTTCTTTTGTTAGCTTTTCiapF⁃TTTGCTAAAGCGGGTATCTC205[10]R⁃AGCCGTGGATGTTATCGTATsigBF⁃CCAAGAAAATGGCGATCAAGAC165[11]R⁃CGTTGCATCATATCTTCTAATAGCTmplF⁃CGCTAAGTTCTGGTGGTT207本研究R⁃TTCCGACATAACTTTTCACAvirRF⁃GCTACAAGACTTCACCAATC210[15]R⁃GTGGAGTAAACCTTTTTGAACmprFF⁃GTTTCGCCTTCAAGCGTGTC222[15]R⁃GATACAAGCAACGGTTCCCTA表1(续)毒力基因Virulencegene引物方向(5′⁃3′)Directionofprimers产物大小Productsize(bp)参考来源ReferencedltAF⁃AGAGTCTCCTGTGCGATA277[12]R⁃ATACGGACCTACAGAAGCdltBF⁃ACCAGAAAGAAAGCGTCAT712本研究R⁃AGTCCAGTCCAAGGAGCdltCF⁃GAAGGCTTGCTTGATTCTATG113[12]R⁃TCAGGAGTAGCCCATTCGTCdltDF⁃TCCATTGATAGGCGGGTTA287[12]R⁃AAGATCGCGTAAGCAAAGGsrtBF⁃CATTCGTATTCCGATAA269本研究R⁃AAATAAGCATAACCAGACfbpAF⁃GCTGAACAAGGCTATCT171本研究R⁃CCAGTATTCATTATTCCTAhptF⁃CCGTTTATTGTATTCAAGC331本研究R⁃GTTCCAGTTAAGCCATTinlAF⁃CAACGTTTGATAATGACGGTGT458[9]R⁃ATTTGTAGTCGGCGGAGTGTinlBF⁃AATCACTTTCTTTGGAGCATAATGGTATAAGTG562[7]R⁃GTTCCATCAACATCATAACTTACTGTGTAAACCinlCF⁃CCATCTGGGTCTTTGACAGTA398[9]

R⁃CAAATAAGTGACCTTAGTCCTTinlDF⁃CTTGTGGTCCCTAATAACAT449本研究R⁃GAACGTATAGCCATCCTTCGinlEF⁃GGCCTTTCTGGTGAGCTT402本研究R⁃TGGTTCTTCGTTCTCAGTGinlFF⁃TGACTTATTTGCAGTTGGGGT1119[9]R⁃TTGGTTCAGGAATAAGCGCGinlGF⁃GTGAAGACGGAACTTGGAAA668[13]R⁃GCTTCTACTATCGGTTGAACAinlH/C2F⁃ATAGCTACTTTATCAGCATTT437[13]R⁃ATATCACTTATTTTATTATCATCinlIF⁃GTTTCCAGACGACAATCTTGCTA635[13]R⁃AATCGGTACAGTTACTCGCATCAinlJF⁃AAATCCAGCCCCTGAAAAAG545[9]R⁃CGCCTGTTTTTGGTAGGGTAactAF⁃TAGCGTATCACGAGGAGG539[14]R⁃TTTTGAATTTCATATCATTCACC
1.2.2DNA模板制备 从血平板上挑取过夜培养的Lm新鲜菌落至400 μL 1×TE(pH8.0)缓冲液中,震荡混匀,煮沸5 min后冰上冷却,10 000 r/min离心5 min,取上清于-20 ℃保存备用。
1.2.3毒力基因检测 29个位点均采用单重PCR检测,PCR体系为:2×Gotaq○RColorless Master Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板1 μL,加水补足体积至25 μL。PCR参数为:95 ℃ 4 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 40 s,35个循环;72 ℃ 7 min。采用QIAxcel DNA Screening Kit卡夹经全自动毛细管电泳仪检测PCR产物。
1.2.4PCR产物测序确认 29个毒力基因的部分阳性扩增产物送大连宝生物公司进行双向测序,并对测序结果进行序列比对,确认扩增产物为目的基因。
1.2.5统计分析 利用Bionumerics Version 7.6软件,采用Categorical UPGMA方法进行缺失毒力基因聚类分析,采用SPSS 21.0软件对不同地区分离的菌株毒力基因缺失差异情况进行χ2检验,以Plt;0.05为差异有统计学意义。
2 结 果
2.1毒力基因检测结果 在91株Lm中,有23个毒力基因的检出率均为100%。其中26株Lm的29种毒力基因全部检出,65株Lm分别存在inlD、inlF、inlG、inlH/C2、inlJ和mpl等6个毒力基因的不同缺失。49株Lm菌株出现2种及2种以上毒力基因的缺失。
表2 91株Lm毒力基因检测结果
Tab.2 Results of 29 virulence genes in 91 foodborne Lm

毒力基因Virulencegenes阳性菌株数(株)No.ofpositivestrains检出率(%)DetectionratesinlD8492.31inlG3639.56inlF4145.05inlH/C28997.80inlJ8492.31mpl7380.22prfA、plcA、plcB、hlyA、actA、inlA、inlB、inlC、inlE、inlI、bsh、srtA、iap、sigB、virR、mprF、dltA、dltB、dltC、dltD、srtB、fbpA、hpt91100.00
2.2毒力基因分型分析 根据不同毒力基因缺失情况进行聚类分析(图1),91株Lm可分为10个毒力基因型别,其中型别最多的Ⅰ型,由具有全部29个毒力基因的26株菌株组成,占28.57%,其次为同时缺失InlF和InlG毒力基因的Ⅵ型(23株)以及不仅缺失InlF和InlG毒力基因,还缺失mpl毒力基因的Ⅸ型(17株),分别占25.27%和18.68%。
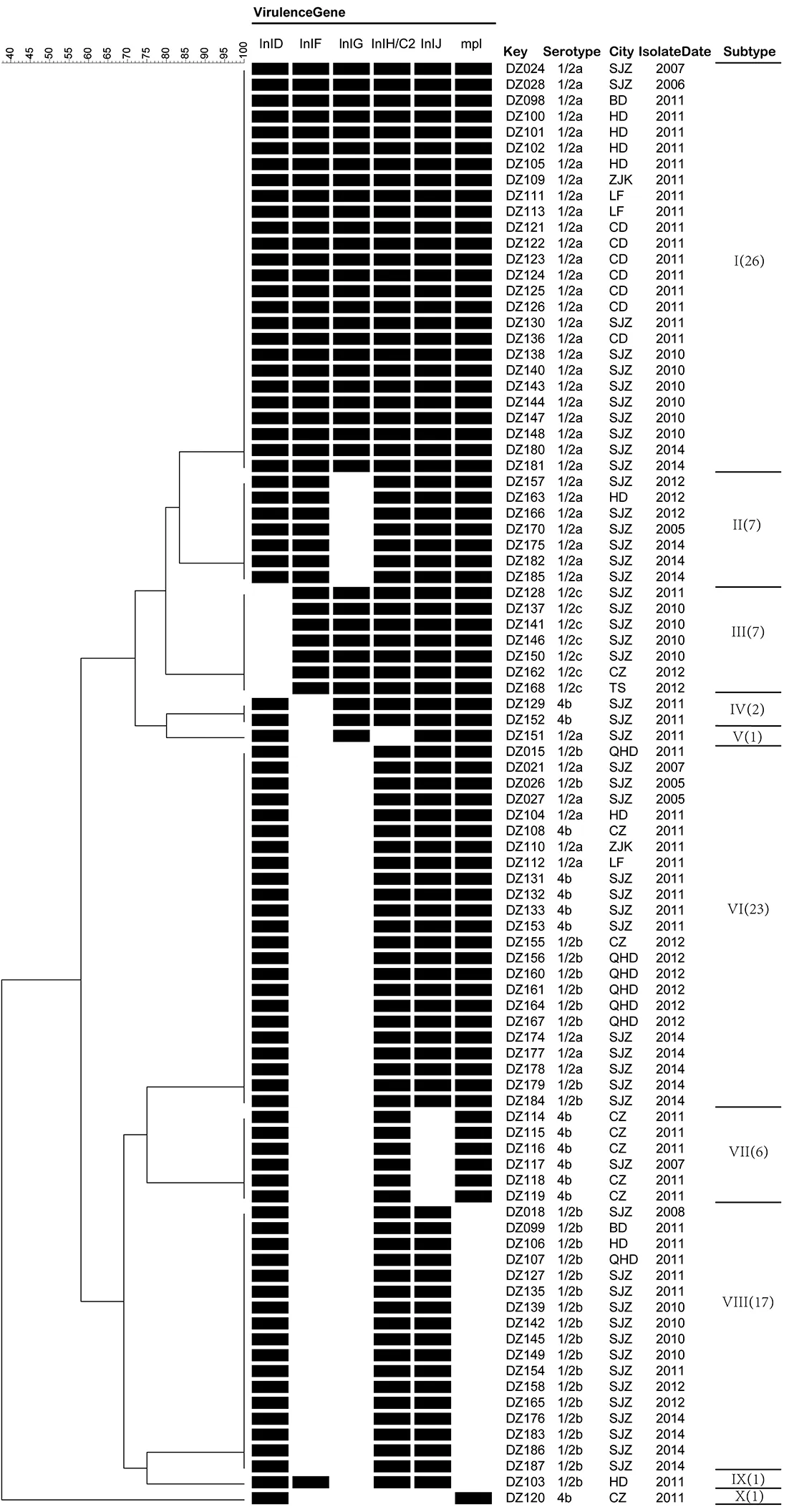
图1 缺失毒力基因聚类分析图Fig.1 Clustering analysis of deletion virulence genes
2.3毒力基因缺失与分子血清型关系 29种毒力基因全部检出的26株菌株均为1/2a血清型。在出现缺失的6个毒力基因中,inlD缺失菌株全部为1/2c型(7/7);inlJ缺失菌株全部为4b型(7/13);mpl缺失菌株全部为1/2b型(18/30)。1/2a型菌株主要缺失inG和/inlF基因;1/2b型菌株主要为inG、inlF和mpl基因的缺失;1/2c型菌株主要缺失inlD;4b型菌株主要为inlF、inlG和inlJ3种毒力基因的缺失。在10个毒力基因型中,除了Ⅵ型中包含有1/2a、1/2b和4b血清型外,其余各型均只有1种血清型(图1、表3)。
2.465株毒力基因缺失菌株分离地区分析 为方便计算,本研究将65株毒力基因缺失菌株按地区来源不同分为3大地区,其中石家庄地区41株,河北南部地区(邯郸、衡水、沧州)13株,河北北部地区(保定、承德、廊坊、秦皇岛、唐山、张家口)11株,不同地区分离菌株毒力基因缺失差异有统计差异(χ2=6.125,P=0.043),石家庄地区分离的Lm菌株毒力基因缺失率(78.85%)高于河北北部地区(50%)(χ2=6.158,P=0.013)。河北北部地区和石家庄地区的主要分离株为1/2b型, 河北南部地区主要分离株为4b型。在河北北部和河北南部地区Lm分离株中,毒力基因型主要为Ⅶ(8)型,分别占8株和5株,主要缺失毒力基因为inlF和inlG。石家庄地区由于菌株最多,表现出更多的毒力基因型,主要毒力基因型为Ⅷ(14)、Ⅵ(12)、Ⅱ(6)和Ⅲ(5)型,缺失主要毒力基因inlF、inlG和mpl(表4)。
表3 65株毒力基因缺失菌株血清型
Tab.3 Serotype of 65 Lm strains with virulence genes deletion

缺失毒力基因Deletionvirulencegenes菌株数(株)No.ofstrains分子血清型(菌株数)Serotype(No.ofstrains)inlD71/2c(7)inlF501/2a(9);1/2b(28);4b(13)inlG551/2a(14);1/2b(30);4b(11)inlH/C224b(1);1/2a(1)inlJ74b(7)mpl181/2b(18)
表4 不同地区分离Lm菌株的分子血清型与毒力基因型别分布
Tab.4 Regional distribution of serotype and subtype of virulence genes in 91 Lm strains

地区District菌株总数No.ofstrains毒力基因缺失菌株数No.ofstrainswithvirulencegenesdeletion缺失毒力基因菌株分子血清类型Serotypeofstrainswithvirulencegenedeletion1/2a1/2b4b1/2c河北北部NorthernHebei2211Ⅵ(2)Ⅵ(6)Ⅷ(2)lt;FounderNodename=""value=""/gt;Ⅲ(1)河北南部SouthernHebei1713Ⅱ(1)Ⅵ(1)Ⅸ(1)Ⅷ(2)Ⅵ(1)Ⅶ(5)Ⅹ(1)Ⅲ(1)石家庄Shijiazhuang5241Ⅱ(5)Ⅴ(1)Ⅵ(5)Ⅱ(1)Ⅵ(4)Ⅷ(14)Ⅳ(2)Ⅵ(3)Ⅶ(1)Ⅲ(5)合计Total9165Ⅱ(6)Ⅴ(1)Ⅵ(8)Ⅱ(1)Ⅸ(1)Ⅵ(10)Ⅷ(18)Ⅳ(2)Ⅵ(4)Ⅶ(6)Ⅹ(1)Ⅲ(7)
3 讨 论
Lm一般经胃肠道感染,侵入肠上皮细胞后被单核巨噬细胞吞噬,并随其扩散到局部淋巴结,最后到达内脏器官,引起全身性感染。整个感染过程由一系列的步骤组成,包括内化、逃离吞噬泡、Lm在宿主细胞内的极向运动与细胞间传播,需要许多毒力蛋白因子和酶参与其中。Lm的致病性与其毒力基因密切相关,缺失毒力基因将导致其致病性的消失或下降。通过检测毒力基因,可掌握这些基因在Lm中的分布,从而为评估Lm分离株的致病性强弱,进行相关监测提供实验室支持。
本研究对91株河北省食源性Lm进行了29个毒力基因的检测,包括毒力岛Ⅰ(Listeriamonocytogenespathogenicity islands,LIPI-1)在内的6个基因、内化素家族的10个基因位点inlA、inlB、inlC、inlD、inlE、inlF、inlG、inlH/C2、inlI和inlJ,以及其他目前研究较多的13个毒力相关位点:bsh、srtA、iap、sigB、virR、mprF、dltA、dltB、dltC、dltD、srtB、fbpA和hpt。研究结果显示河北省食源性Lm具有很高的毒力基因携带率,29个毒力基因中有23个位点检出率为100%,仅6个毒力基因出现不同程度的缺失,具有较高的潜在致病性,该结果与目前报道一致[1,3,10,16],因此我国应加强食品中该病菌的监测,临床治疗中应增强对李斯特菌病的重视和培训,从而更好的发现和防控李斯特菌病。
在91株Lm中,有65株Lm有1-4种毒力基因的缺失,毒力基因缺失菌株比例较高,总缺失率为71.43%。根据缺失毒力基因的聚类分析,91株菌株分为10个毒力基因型,具有较高的多态性。除毒力基因Ⅵ型含有1/2a、1/2b和4b血清型以外,其余9个型别都仅有一种血清型,提示了毒力基因型别与血清型具有较高的相关性,其内在关系还需进一步研究。我国食品中Lm分离株主要为1/2a血清型[17],而引起食源性疾病最多的血清型也是1/2a血清型[18],本次检测结果也显示63.4%的1/2a菌株具有全部29个毒力基因,菌株的致病力较强,较易引发食源性疾病。
LIPL-1毒力岛与Lm的致病性密切相关,是细菌在细胞内的生存必不可少的,具有高度保守性[19]。本次检测的91株Lm中,IPL-1中的6个毒力基因,除了mpl基因以外,均具有较高的稳定性。mpl基因编码锌依赖金属蛋白酶(Zinc metalloprotease),参与Lm在细胞间的直接传递,可避免自身被体液免疫系统清除,此外,该酶还介导毒力因子卵磷脂磷脂酶C(PC-PLC)(由plcB基因编码)的前体在吞噬体中的活性,是LIPL-1中的一个重要的毒力因子。本次研究显示在60%的1/2b血清类型菌株(18/30)中出现缺失或变异,提示在该血清类型菌株具有较大的毒力缺陷,致病性较弱。
内化素是Lm毒力相关基因编码的一个蛋白质家族,介导细菌侵入无吞噬能力的上皮细胞,其N端都含有富含亮氨酸的串联重复区域,该区域被认为与蛋白质-蛋白质相互作用及多种功能相关,参与黏附、配体-受体相互作用以及信号传导等过程。InlA、InlB以及InlC是研究较多的内化素蛋白,分别在黏附、侵袭以及胞内生存和扩散方面具有重要作用[20-23]。内化素基因容易发生碱基突变,具有多态性,还容易发生水平基因转移和重组[24]。本研究检测的10个内化素家族成员中有5个基因发生了变异和缺失,inlG和inlF2个基因的缺失率均高于50%,inlD、inlH/C2和inlJ等3个基因也发生了不同程度的缺失。本研究还发现,除了1/2a血清型外,其余3种血清类型,每一种血清类型均出现了一种特定内化素基因的缺失,如所有1/2b血清型菌株均缺失inlG基因,所有4b菌株均缺失inlF基因,所有1/2c菌株均缺失inlD基因;另外还有一些基因的缺失仅出现在某一种特定血清型的菌株中,如inlD缺失仅见于1/2c型菌株;inlJ基因缺失也是只在部分4b型菌株中出现。这两种不同形式的内化素基因缺失状况,显示出内化素基因的缺失与血清型具有一定的相关性,可能是该血清型中一些菌株的毒力基因发生了变异,还需要进一步研究。
在本研究检测的13种毒力相关基因中,bsh和sigB与细菌耐受环境的压力应答有关,srtB与逃避巨噬细胞吞噬有关,srtA、fbpA与细菌的侵袭、粘附相关,iap、mprF与抵抗宿主防御有关,hpt与细胞内增值有关,dltA、dltB、dltC、dltD与细胞感染相关,virR具有调控功能,是一种应答调控因子,调控包括mprF、dltA、dltB等在内的12 个毒力基因。这13种毒力基因是细菌耐受环境压力、细胞内生存、逃逸以及细胞感染有关的基础基因,具有一定的保守型。本研究结果也显示该13种毒力相关基因在91株菌株中均存在,进一步证明该13种基因在Lm菌株中的高度保守性,其缺失将可能会明显影响菌株的生存。
本研究通过对91株食源性Lm中29个毒力基因的检测,证明了一些毒力基因对于Lm生存感染是必须的,具有高度的保守性;另有一些毒力基因如内化素家族成员基因和mpl基因则具有一定的多态性,容易发生变异和缺失。曾有文献报道hlyA、inlA和plcB3个毒力基因的检出情况与Lm的MLST分型聚类有较一致的关系,可为分析Lm毒力强弱提供参考意义[25],本研究发现毒力基因缺失菌株具有一定的地域差异,毒力基因缺失变异与菌株的血清类型也具有一定联系,因此进一步研究毒力基因缺失变异的地域特点以及与血清类型的关系对于制定防控策略以及分析Lm的毒力强弱同样具有重要的参考意义。
[1] He CY, Wang Y, Wang TS, et al. Distribution of virulence-related genes of selected Listeria monocytogenes strains isolated from food samples in China[J]. Dis Surveill, 2013, 28(5): 384-388. (in Chinese)
贺春月,王艳,王天姝,等.中国部分食品来源单增李斯特菌中致病相关基因的分布研究[J]. 疾病监测, 2013, 28(5): 384-388.
[2] Yang Y, Fu P, Guo YC, et al. Virulent gene prevalence of foodborneListeriamonocytogenesin China in 2005[J]. Chin J Prev Med, 2010, 44(12): 1097-1101. (in Chinese)
杨洋,付萍,郭云昌,等. 2005年中国食源性单核细胞增生李斯特菌毒力基因分布[J].中华预防医学杂志, 2010, 44(12): 1097-1101.
[3] Zhang LR, Wang Y, Zhang Y, et al. Biological and molecular epidemiological characteristics ofListeriamonocytogenesisolated in Tongzhou, Beijing[J]. Dis Surveill, 2007, 27(7): 562-564. (in Chinese)
张兰荣,王艳,张扬,等. 2007-2011年北京市通州区分离单增李斯特菌的生物学及分子流行病学特征[J].疾病监测, 2007, 27(7): 562-564.
[4] Doumith M, Buchrieser C, Glaser P, et al. Differentiation of the majorListeriamonocytogenesserovars by multiplex PCR[J]. J Clin Microbiol, 2004, 42(8): 3819-3822. DOI: 10.1128/JCM.42.8.3819-3822.2004
[5] Bubert A, Sokolovic Z, Chun SK, et al. Differential expression ofListeriamonocytogenesvirulence genes in mammalian host cells[J]. Mol Gen Genet, 1999, 261(2): 323-336. DOI: 10.1007/PL00008633
[6] Lomonaco S, Patti R, Knabel SJ,et al. Detection of virulence-associated genes and epidemic clone markers inListeriamonocytogenesisolates from PDO Gorgonzola cheese[J]. Int J Food Microbiol, 2012, 160(1): 76-79. DOI: 10.1016/j.ijfoodmicro.2012.09.011
[7] Volokhov D, Rasooly A, Chumakov K, et al. Identification ofListeriaspecies by microarray-based assay[J]. J Clin Microbiol, 2002, 40(12): 4720-4728. DOI: 10.1128/JCM.40.12.4720-4728.2002
[8] Paziak-Domańska B, Bogusawska E, Wieckowska-Szakiel M, et al. Evaluation of the API test, phosphatidylinositol- specific phospholipase C activity and PCR method in identification ofListeriamonocytogenesin meat foods[J]. FEMS Microbiol Lett, 1999, 171(2): 209-214. DOI: 10.1111/j.1574-6968.1999.tb13434.x
[9] Lomonaco S, Chen Y, Knabel SJ. Analysis of additional virulence genes and virulence gene regions inListeriamonocytogenesconfirms the epidemiologic relevance of multi-virulence-locus sequence typing[J]. J Food Prot, 2008, 71(12): 2559-2566. DOI: 10.4315/0362-028X-71.12.2559
[10] Gong ZL, Zhu RF, Ye CY, et al. Detection of virulence genes in 118 strains of ChinaListeriamonocytogenes[J]. Dis Surveill, 2007, 22(5): 299-301. (in Chinese)
宫照龙,祝仁发,叶长芸,等. 118株单核细胞增生李斯特菌的毒力基因检测[J]. 疾病监测,2007, 22(5): 299-301.
[11] Kalliopi R, Marios M, Valentina A, et al. Expression of virulence genes ofListeriamonocytogenesin food[J]. J Food Safety, 2012, 32 (2): 161-168. DOI: 10.1111/j.1745-4565.2011.00363.x
[12] Li XH. Distribution and pathogenicity to virulence genes of foodborneListeriamonocytogenes[D]. Shijiazhuang: Agricultural University of Hebei, 2012: 1-45. (in Chinese)
李欣华.食源性单核增生性李斯特氏菌毒力基因分布及致病力的研究[D].石家庄:河北农业大学, 2012:1-45.
[13] Chen J, Luo X, Jiang L, et al. Molecular characteristics and virulence potential ofListeriamonocytogenesisolates from Chinese food systems[J]. Food Microbiol, 2009, 26(1): 103-111. DOI: 10.1016/j.fm.2008.08.003
[14] Wiedmann M, Bruce JL, Keating C, et al. Ribotypes and virulence gene polymorphisms suggest three distinctListeriamonocytogeneslineages with differences in pathogenic potential[J]. Infect Immun, 1997, 65 (7): 2707-2716.
[15] Li XH, Han J, Yu HW, et al. Distribution of virR and mprF genes inListeriamonocytogenesfrom different food sources[J]. J Agr Univ Hebei, 2012, 35(3): 86-89. (in Chinese)
李欣华,韩军,于宏伟, 等.单核细胞增生性李斯特氏菌virR和mprF基因分布[J].河北农业大学学报, 2012, 35(3):86-89.
[16] Chen JS, Jiang LL, lü YH, et al. Molecular epidemiology and pathogenic potential ofListeriamonocytogenesin aquatic products[J]. J Chin Institute Food Sci Technol, 2013, 13(9): 182-189. (in Chinese)
陈建舜,江玲丽,吕永辉,等. 水产品中单增李斯特菌的分子流行病学特征与致病力研究[J]. 中国食品学报, 2013, 13(9):182-189.
[17] Shen J, Rump L, Zhang Y, et al. Molecular subtyping and virulence gene analysis ofListeriamonocytogenesisolates from food[J]. Food Microbiol, 2013, 35(1): 58-64. DOI: 10.1016/j.fm.2013.02.014
[18] Kathariou S.Listeriamonocytogenesvirulence and pathogenicity, a food safety perspective[J]. J Food Prot, 2002, 65(11): 1811-1829. DOI: 10.4315/0362-028X-65.11.1811
[19] Vázquez-Boland JA, Kuhn M, Berche P, et al.Listeriapathogenesisand molecular virulence determinants[J]. Clin Microbiol Rev, 2001, 14(3): 584-640. DOI: 10.1128/CMR.14.3.584-640.2001
[20] Mengaud J, Ohayon H, Gounon P, et al. E-cadherin is the receptor for internalin, a surface protein required for entry of L. monocytogenes into epithelial cells[J]. Cell, 1996, 84(6):923-932. DOI: 10.1016/S0092-8674(00)81070-3
[21] Braun L, Dramsi S, Dehoux P, et al. InlB: an invasion protein ofListeriamonocytogeneswith a novel type of surface association[J]. Mol Microbiol, 1997, 25(2): 285-294. DOI: 10.1046/j.1365-2958.1997.4621825.x
[22] Dussurget O. New insights into determinants ofListeriamonocytogenesvirulence[J]. Int Rev Cell Mol Biol, 2008, 270: 1-38. DOI: 10.1016/S1937-6448(08)01401-9
[23] Ren JJ, Yang MW, Chen YF, et al. Biological characters and pathogenicity ofListeriamonocytogenesΔinlA/ΔinlB double gene deletion strains[J]. Chin J Zoonoses, 2016, 32 (6): 529-534. (in Chinese)
任静静,杨铭伟,陈云飞,等.单增李斯特菌inl A/ inl B双基因缺失株生长特性观察及对小鼠致病性研究[J].中国人兽共患病学报, 2016, 32 (6): 529-534.
[24] Tsai YH, Orsi RH, Nightingale KK, et al.Listeriamonocytogenesinternalins are highly diverse and evolved by recombination and positive selection[J]. Infect Genet Evol, 2006, 6(5): 378-389. DOI: 10.1016/j.meegid.2006.01.004
[25] Liu EL, Yuan MY, Lü YZ, et al. Development of triplex TaqMan MGB-probe real-time PCR assay for detection ofListeriamonocytogenesand the distribution of virulence gene in isolates[J]. Chin J Zoonoses, 2016,32 (5): 451-456. (in Chinese)
刘二龙,袁慕云,吕英姿,等.单增李斯特菌三重实时荧光PCR检测的建立及其毒力基因在分离菌株中分布[J].中国人兽共患病学报, 2016, 32 (5): 451-456.
Distributioncharacterizationof29virulencegenesin91foodborneListeriamonocytogenesstrains
LI Xiu-juan, ZHAO Dong, PAN Zhuo, GAO Wei-li, XU Bao-hong, QIN Li-yun
(DepartmentofMicrobiology,ShijiazhuangCenterforDiseaseControlandPrevention,Shijiazhuang050011,China)
In order to study the distribution of virulence genes ofListeriamonocytogenes(Lm) in Hebei Province, 29 virulence genes ofLm, includingListeriamonocytogenespathogenicity islands Ⅰ(LIPI-Ⅰ:prfA,plcA,plcB,hlyA,mplandactA), 10 internalins genes (inlA,inlB,inlC,inlD,inlE,inlF,inlG,inlH/C2,inlIandinlJ) and the other 13 virulence-associated genes (bsh,srtA,iap,sigB,virR,mprF,dltA,dltB,dltC,dltD,srtB,fbpAandhpt) were detected by PCR. Results showed that in the 91 Lm strains, the detection rate of 23 virulence genes were 100%. The 29 virulence genes of 26 Lm strains were all detected, and 65Lmstrains had different deletion of 6 virulence genesinlD,inlF,inlG,inlH/C2,inlJandmpl. The deletion rate ofinlGandinlFwere 60.44% and 54.95%, respectively, following by mpl gene, with a deletion rate of 19.78%. According to the absence of virulence genes, 91 strains could be divided into 10 subtypes, and the dominant virulence subtypes was type Ⅰwith all 23 virulence genes.The deletion rate of virulent genes in Shijiazhuang was higher than that in northern Hebei. It is suggested that the rate of virulence gene of food-borneLmin Hebei Province is high, and the virulence gene deletion patterns has diversity and regional differences.
Listeriamonocytogenes; virulence genes; distribution characteristics
10.3969/j.issn.1002-2694.2017.11.005
河北省医学科学研究重点课题(No. ZL20140244)
石家庄市疾病预防控制中心,石家庄 050011
Email:wsws1120@126.com
R378.99
A
1002-2694(2017)11-0972-07
Supported by the Hebei Medical Scientific Research Fund Project(No. ZL20140244)
2017-02-20编辑张智芳

