温度对黄颡鱼无水保活工艺的影响
王立红,李韬,刘悦,李含笑,张甜甜,张长峰,聂小宝,*
(1.山东省农产品贮运保鲜技术重点实验室,山东济南250103;2.山东师范大学,山东济南250014;3.国家农产品现代物流工程技术研究中心,山东济南250103;4.山东商业职业技术学院,山东济南250103)
黄颡鱼属鲶形目,鲿科的黄颡鱼属,俗称昂刺、黄姑、黄蜡丁、黄鳍鱼等[1]。黄颡鱼具有高蛋白、低脂肪,肉质细嫩,味道鲜美,营养丰富等特点,且无肌间刺,养殖简单,此外,黄颡鱼还有滋补作用,具有一定的药用价值,是出口创汇的优良品种,主要出口日本、韩国、东南亚等国家[2-3]。目前,黄颡鱼的运输方式主要为有水保活运输,但其存在运输距离短、载水量大、运输量小、成活率低等诸多劣势[4-5]。因此,研究温度对黄颡鱼无水保活工艺的影响,对提高黄颡鱼的经济价值和成活率具有重要的意义,为黄颡鱼无水保活技术的实施提供理论依据。
低温无水保活运输是一种低成本、高存活率、长时间、高品质,且优于其它相关技术的绿色保活方法[6]。近年来,国内学者对水产品无水保活运输技术进行了广泛的研究和探索。上世纪九十年代末,刘淇等[10]选用2龄人工养殖牙鲆,采用生态冰温学原理,研究了温度对牙鲆无水保活的影响。认为采用低温法,牙鲆无水保活52 h,成活率100%,60 h,成活率90%,低温法明显优于TMS麻醉法。直至2008年以后,国内学者在该领域的研究逐渐展开。徐若等[11]将泥蚶放在冷藏温度为4、8℃和冰块堆积条件下进行无水低温保活效果研究,结果显示无水冰温保藏效果最好,4℃保活效果较好。韩利英等[9]研究认为鲫鱼无水保活条件下临界温度为6℃~7℃,同时,梯度降温速率也是影响鲫鱼无水保活时间的主要因子。刘伟东等[7]研究了低温条件下大菱鲆有水和无水保活过程中生理生化变化情况,结果表明:有水保活的大菱鲆血液中1BUN、CR、UA和GLU显著低于无水保活。张观科等[12]以毛蚶为研究对象进行饥饿无水保活实验,探索了不同温度条件下ATP的变化情况,结果表明:在不同保活温度下毛蚶ATP含量差异显著。聂小宝等[8]探索了泥鳅在0、5、10℃下无水保活成活率以及机体生化指标变化情况,表明5℃为泥鳅最佳无水保活温度。上述研究均表明在无水保活过程中其环境温度是至关重要的影响因素之一。因此,本文以黄颡鱼为研究对象,探索了0、3、6℃无水保活条件下其存活率、O2消耗量、CO2含量、肌糖原含量、ATP含量和乳酸含量等指标的变化,旨在为黄颡鱼无水保活运输实践提供理论参考。
1 材料与方法
1.1 材料与处理
1.1.1 材料
黄颡鱼:从济南海鲜大市场购买,挑选体格健壮,色泽光亮,新鲜而活跃,个体大小均匀,健康无疾病的黄颡鱼用于试验。每尾全长约(15±5)cm,体质量约(100±10)g。
1.1.2 主要仪器与设备
MAP-Q7200扎口气调包装机:苏州森瑞保鲜设备有限公司;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;OXYBABYM+O2/CO2氧气分析仪:上海众林机电设备有限公司;UPR-11-10T纯净水器:四川优普超纯科技有限公司;电子万用炉:北京市永光明医疗仪器厂;离心机:德国Hettich科学仪器有限公司;METTLER TOLEDO EL204-IC电子天平:梅特勒-托利多仪器(上海)有限公司。
1.1.3 处理方法
购买160尾黄颡鱼放入水温为25℃的暂养桶中进行暂养,对暂养桶连续充氧,停止投饵,暂养48 h后,调节温度调控系统并以2℃/h降温速率降至0℃时,留3尾黄颡鱼在暂养桶中做空白,将其他鱼打捞出桶,分别移至不同的塑料袋中,排除空气,充入纯氧,采用橡皮筋进行密封处理,以每40尾一组,分别移入0、3℃和6℃,3个不同温度的冷库中进行无水保活(分别记为0℃组,3℃组和6℃组),其中20尾黄颡鱼用来测定黄颡鱼在保活第12、24、36 h和48 h时的成活率和O2和CO2含量,同时,另外20尾黄颡鱼在保活第 12、24、36、48 h,分别取出 3 尾,采集背部肌肉。
1.1.4 样品的制备
肌肉样品的制备:将黄颡鱼取完血液后,用剪刀剪取其的背部肌肉,去除其表皮和脊柱,用蒸馏水冲洗干净,再用滤纸吸干背部肌肉上的水分;放置-20℃低温冰箱中暂存。用于肌糖原、乳酸和ATP含量的测定。
1.2 测定项目及方法
1.2.1 存活率的确定
每一个时间段统计一下每一组温度下鱼存活的数量,计算存活率。
存活率/%=(存活数/样品总数)×100
1.2.2 O2和CO2含量的测定
采用OXYBABYM+O2/CO2氧气分析仪进行分析,从一开始到结束一直使用相同的两条进行测定,并做好标记。
1.2.3 肌糖原的测定
采用南京建成生物工程研究所肌糖原试剂盒法测定。
1.2.4 ATP含量的测定
采用南京建成生物工程研究所ATP含量测定试剂盒。
1.2.5 乳酸
采用南京建成生物工程研究所乳酸试剂盒。
1.3 数据处理
采用orignPro2016 64bit进行绘图,利用SPSS 21.0进行相关性分析,显著性水平设置为P<0.05。
2 结果与分析
2.1不同温度对黄颡鱼无水保活过程中存活率的影响
不同温度对黄颡鱼无水保活过程中存活率的影响见图1。
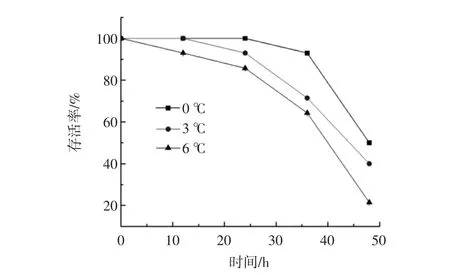
图1 不同温度对黄颡鱼无水保活过程中存活率的影响Fig.1 Effect of different temperature on the survival rate of yellow catfish in the process of keeping alive without water
存活率是表明活鱼保活效果的关键指标,其高低直接说明保活方法是否可行[13]。由图1可知,随着无水保活时间的延长,不同温度无水保活下的黄颡鱼存活率逐渐降低。其中,6℃组随保活时间的增加其死亡速率最快。0℃组在保活的24 h内始终无死亡率,3℃组在保活24 h时,成活率仍能够达到93%,而6℃在24 h时黄颡鱼的存活率已达到85.71%。由图中数据可以得出,在0℃下黄颡鱼的无水保活效果最佳,能够维持较长的保活时间。因此,在对鱼类进行无水保活贮运时,温度不易过高或过低,应该选择适宜的低温进行保活,环境温度偏高或偏低均影响其存活时间及成活率。
2.2 不同温度对黄颡鱼无水保活过程中O2消耗量的影响
不同温度对黄颡鱼无水保活过程中O2消耗量的影响见图2。

图2 不同温度对黄颡鱼无水保活过程中O2消耗量的影响Fig.2 Different temperature preserving effect of O2consumption in the process of living on pelteobagrus fulvidraco anhydrous
鱼类在有水环境中,则是通过鳃盖的闭合使水流流过鳃丝,从而达到呼吸的目的,维持生命特征。当鱼类在无水保活贮运过程下,只能通过鳃的闭合直接与空气结合进行呼吸作用,但该方式的呼吸效率上不明确[14]。由图2可得,保活袋内的初始O2含量并不是100%而是84%左右,这是由于在充氧时充入的氧气不足导致的。从图2可知在0、3、6℃3个不同温度无水保活环境下的保活袋内O2的含量随保活时间地延长均呈下降趋势(P>0.05),且不同温度无水保活环境下,黄颡鱼呼吸消耗O2速率不同,其中,6℃无水保活环境下黄颡鱼呼吸消耗O2速率最快,在保活12 h时O2消耗量达到64.6%,保活36 h时O2消耗量达到56.8%;0℃无水保活环境下黄颡鱼呼吸消耗O2速率最慢,在保活12 h时O2消耗量达到71.9%,保活36 h时O2消耗量达到65.6%,且在相同时间内两个不同温度组均呈显著性差异(P<0.05)。综上可知,无水保活温度越低,黄颡鱼对O2的需求量就越少,则0℃相较于3℃和6℃更适合于黄颡鱼的无水保活运输。
2.3 不同温度对黄颡鱼无水保活过程中CO2含量的影响
不同温度对黄颡鱼无水保活过程中CO2含量的影响见图3。
保活袋中CO2含量的增加是因为黄颡鱼的呼吸作用产出的。由图3可看出,3个保活温度组CO2含量随保活时间的延长逐渐增多(P>0.05),其变化趋势与O2的消耗量呈现相反的变化趋势。6℃时CO2含量增长最快且保活袋中的CO2含量最多,0℃时CO2含量增长缓慢,且在整个保活过程中CO2含量最少。由此可见,温度越低黄颡鱼呼吸产出的CO2越少。因此,0℃是无水保活的最适温度。
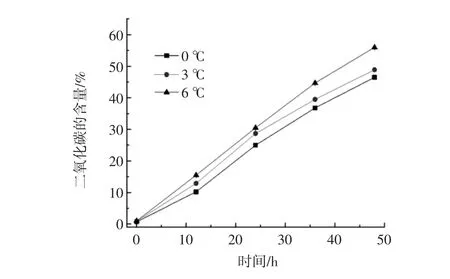
图3 不同温度对黄颡鱼无水保活过程中CO2含量的影响Fig.3 Effects of different temperature and CO2content in the process of living on pelteobagrus fulvidraco anhydrous
2.4 不同温度对黄颡鱼无水保活过程中肌糖原含量的影响
不同温度对黄颡鱼无水保活过程中肌糖原含量的影响见图4。
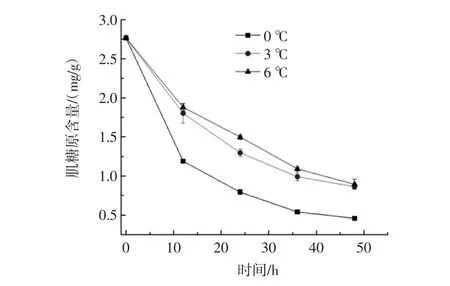
图4 不同温度对黄颡鱼无水保活过程中肌糖原含量的影响Fig.4 Effects of different temperature and muscle glycogen content in the process of living on pelteobagrus fulvidraco anhydrous
肌糖原是反应动物对外界环境应激程度的重要指标,其变化规律能够清晰的反应机体对环境的适应情况[15-17]。由图4可知,在0、3、6℃下无水保活的黄颡鱼随保活时间的延长肌糖原逐渐降低,且差异性显著(P<0.05)。在 0 h时肌糖原的含量为 2.766 mg/g,在12 h时0、3℃和6℃下的肌糖原含量分别为1.189、1.802、1.879 mg/g,由此可看出0℃下肌糖原下降的速度最快,6℃下肌糖原含量下降的最慢,从而表明了温度越低对黄颡鱼机体的影响越大,应激强度越大。
2.5 不同温度对黄颡鱼无水保活过程中ATP含量的影响
不同温度对黄颡鱼无水保活过程中ATP含量的影响见图5。
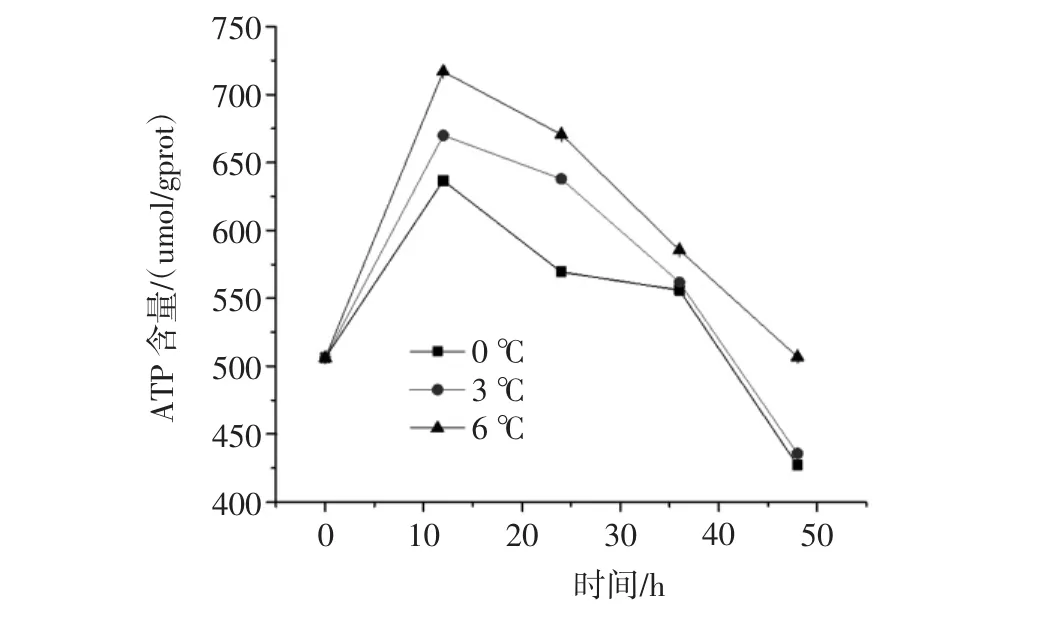
图5 不同温度对黄颡鱼无水保活过程中ATP含量的影响Fig.5 Effects of different temperature and ATP content in the process of living on pelteobagrus fulvidraco anhydrous
由图5可知,在0、3℃和6℃无水保活下黄颡鱼的ATP含量随保活时间的延长先增高后降低,且各组之间无明显差异(P>0.05)。在保活12 h之前ATP含量是逐渐增加的,无水保活6℃的黄颡鱼ATP含量上升速率最快,0℃下的ATP含量的上升速率最慢,且在相同的保活时间下两组有明显差异(P<0.05)。由此可说明在无水低温环境中,黄颡鱼的生命代谢受到影响,在无养分供给时,开始消耗ATP以供给生命的需要。12 h时ATP含量最高,说明其生命代谢比较旺盛,生命活动较强。在12 h后,ATP含量逐渐降低,黄颡鱼的代谢速率降低,使得最终的存活率降低,这与戴志远等[18]所做出的结论是一致的。由此可看出0℃下消耗的ATP最少,因此0℃是最佳的黄颡鱼无水保活的温度。
2.6 不同温度对黄颡鱼无水保活过程中乳酸含量的影响
不同温度对黄颡鱼无水保活过程中乳酸含量的影响见图6。
由图6可知,乳酸含量的变化趋势和ATP含量的变化趋势是相同的,乳酸含量随黄颡鱼保活时间的延长先上升后降低,且各组之间无明显差异(P>0.05)。乳酸的初始含量为0.949 ug/g,之后逐渐上升,到第12天时达到最高值,无水保活温度0、3℃和6℃下的乳酸含量分别为2.107、2.519、2.706 ug/g,在此时间点3个无水保活温度下的乳酸含量呈显著性差异(P<0.05),6℃乳酸含量最高,0℃乳酸含量最低。12 h后乳酸含量又逐渐下降,这是由于黄颡鱼在低温无水保活条件下,体内氧气供应不足,排泄系统也受到影响,造成肌肉乳酸含量上升,而后由于生命活动减弱,乳酸含量也随之下降[19]。因此,0℃是最适合黄颡鱼无水保活的温度。

图6 不同温度对黄颡鱼无水保活过程中乳酸含量的影响Fig.6 Effects of different temperature and the content of lactic acid in the process of living on pelteobagrus fulvidraco anhydrous
3 结论
本文主要研究黄颡鱼在0、3、6℃3个不同温度下无水保活48 h过程中存活率、O2消耗量、CO2含量、肌糖原含量、ATP含量和乳酸含量等指标的变化,试验结果表明:随着无水保活时间的延长,各组黄颡鱼存活率逐渐降低。其中,6℃组随保活时间的增加其死亡速率最快,在保活24 h时,0℃组无死亡,3℃组成活率仍能够达到93%,而6℃组存活率已达到85.71%。在保活48 h时,0℃组成活率仍最高。O2消耗量随着保活时间的延长逐渐降低,6℃组消耗O2速率最快,在保活12 h时O2消耗量达到64.6%,保活36 h时O2消耗量达到56.8%;0℃组消耗O2速率最慢,在保活12 h时O2消耗量达到71.9%,保活36 h时O2消耗量达到65.6%,且在相同时间内两个不同温度组均呈显著性差异(P<0.05)。由此可见,在整个无水保活过程中,环境温度越低,黄颡鱼对氧气的消耗量就越少,体内新陈代谢越缓慢。CO2含量随着保活时间的延长逐渐上升,因黄颡鱼呼吸要不断产生CO2。6℃组CO2含量增长最快,0℃组CO2含量增长缓慢。黄颡鱼肌糖原的含量随着保活时间的延长也逐渐降低,0℃组下降的速度最快,6℃组下下降的最慢。黄颡鱼在无水保活的过程中ATP含量和乳酸含量的变化趋势是一致的。在保活12 h之前ATP含量是逐渐增加的,无水保活6℃组的黄颡鱼ATP含量上升速率最快,0℃组的ATP含量的上升速率最慢,且在相同的保活时间下两组有明显差异(P<0.05),由此可说明,在无水低温环境中,黄颡鱼的生命代谢受到影响,在无养分供给时,开始消耗ATP以供给生命的需要。乳酸的初始含量为0.949 ug/g,之后逐渐上升,到第12天时达到最高值,在此时间点3个无水保活温度下的乳酸含量呈显著性差异(P<0.05),6℃组乳酸含量最高,0℃组乳酸含量最低。12 h后乳酸含量又逐渐下降。这是由于黄颡鱼在低温无水保活条件下,体内氧气供应不足,排泄系统也受到影响,造成肌肉乳酸含量上升,而后由于生命活动减弱,乳酸含量也随之下降。综上所述,黄颡鱼的最适保活温度是0℃。
[1]白艳龙,谭昭仪,邸向乾,等.黄颡鱼无水保活技术研究[J].食品工业科技,2013,34(1):334-337
[2]刘行彪,付熊,吴晗冰,等.黄颡鱼营养学的研究进展[J].水产学杂志,2011,24(1):55-59
[3]黄峰,严安生,熊传喜,等.黄颡鱼的含肉率及鱼肉营养评价[J].淡水渔业,1999(10):3-6
[4]何蓉,谢晶.水产品保活技术研究现状和进展[J].食品与机械,2012,28(5):243-246
[5]聂小宝,章艳,张长峰.水产品低温保活运输研究进展[J].食品研究与开发,2012,33(12):218-223
[6]汪之和.张饮江,李勇军.水产品保活运输技术[J].渔业现代化,2001(2):31-34
[7]刘伟东,薛长湖,殷邦忠,等.低温下大菱鲆有水和无水保活过程中生理生化变化的研究[J].渔业科学进展,2009(5):69-74
[8]聂小宝,刘淇,张长峰,等.泥鳅低温无水保活技术研究[J].湖南农业科学,2013(5):80-83
[9]韩利英,张慜.鲫鱼保活条件对存活率的影响[J].食品与生物技术学报,2009(5):642-646
[10]刘淇,殷邦忠,姚健,等.牙鲆无水保活技术[J].中国水产科学,1999(2):101-103
[11]徐若,曹井志,包建强.泥蚶无水低温保活技术研究[J].食品工业科技,2008,29(5):256-258
[12]张观科,刘红英,齐凤生,等.毛蚶保活过程中ATP含量的变化[J].食品科技,2011,36(1):120-123
[13]何蓉,谢晶,苏辉,等.不同温度对无水保活条件下的中华鳖肌肉营养成分及血液生化指标影响[J].食品科学,2014(6):194-199
[14]吴云辉,陈慧斌,叶福财,等.温度对半滑舌鳎无水保活的影响[J].食品工业,2016(1):177-180
[15]洪磊,张秀梅.环境胁迫对鱼类生理机能的影响[J].海洋科学进展,2004,22(1):114-121
[16]WENDELAAR BONGA S E.The stress response in fish[J].Physiological Reviews,1997(77):591-625
[17]周玉,郭文场,杨振国,等.鱼类血液指标研究进展[J].上海水产大学学报,2001,10(2):163-165
[18]戴志远,张燕平,张虹,等.紫贻贝低温无水保活过程中的生化变化[J].中国食品学报,2004,4(3):16-19
[19]Donaldson M R,Cooke S J,Patterson D A,et al.Cold shock and fish[J].Journal of Fish Biology,2008,73(7):1491-1530

