利用数字化实验探究氯离子对金属腐蚀速率的影响
张勇+邓伟+王文玉
摘要:氯离子对很多化学反应的反应速率产生影响,对金属腐蚀的影响更为明显。利用温度传感器、电流传感器、电势传感器和压力传感器测定氯离子对金属腐蚀的影响,通过对比实验,用实时、准确的数据说明氯离子能加快金属腐蚀速率的广泛性。氯离子对金属的腐蚀一是破坏金属物质表面的氧化膜等,二是与金属离子形成配合物促进金属溶解。氯离子对原电池电流和电势的影响,证明金属腐蚀以形成原电池的电化学腐蚀为主。
关键词:数字化实验;金属腐蚀;化学反应速率;氯离子
文章编号:1005–6629(2017)12–0065–03 中图分类号:G633.8 文献标识码:B
1 问题的提出
众所周知,在控制变量条件下,锌与相同pH的盐酸和硫酸反应,化学反应速率不同。锌与盐酸反应的化学反应速率明显大于锌与硫酸反应的化学反应速率,中学教师对其解释为Cl-对金属腐蚀反应速率有促进作用。
这一现象是个案还是具有普遍性,Cl-对金属的腐蚀速率有何影响,我们设计如下几个数字化实验,以期得到理想的结果。
2 实验仪器和药品
2.1 实验仪器
温度传感器(Vernier,型号:TMP-BTA;范围:-25~125℃)、电流传感器(Vernier,型号:DCP-BTA;范围:±0.6A)、电势传感器(Vernier,型号:DVP-BTA;范围:±6.0V)、压力传感器(Vernier,型号:GPS-BTA;范围:0到210kPa)、威尼尔数据采集器(Vernier Logger Pro 3)、计算机、电池槽、小烧杯、磁力加热搅拌器、20mL量筒、漏斗、小试剂瓶、药匙等
2.2 实验药品
铜片、锌片、铝片、镁条、铁粉、NaCl固体、0.1mol/L CuSO4溶液、0.1mol/L Fe2(SO4)3溶液、蒸馏水等
3 实验操作步骤
3.1 探究CI-对Mg和CuSO4溶液反应的影响
(1)取20mL 0.1mol/L CuSO4溶液于A、B两个相同的100mL小烧杯中,在B烧杯中加入5g NaCl固体使其溶解。
(2)将温度传感器、数据采集器、计算机连接好,并将温度传感器插入A烧杯中,测Mg与CuSO4溶液反应时温度的变化。
(3)打开计算机上的Logger Pro 3数据采集软件,显示如图1所示的时间——温度坐标图像。点击“采集”按钮进行数据采集,同时向CuSO4溶液中加入适量镁条,继续采集数据一段时间,点击“停止”按钮,实验图像见图1曲线1。
(4)将温度传感器洗涤干净后插入B烧杯中,向烧杯中加入等量的镁条,点击“采集”按钮进行数据采集,此时选择“保存最新实验数据”按钮,采集数据一段时间,点击“停止”按钮,保存数据。实验图像见图1曲线2。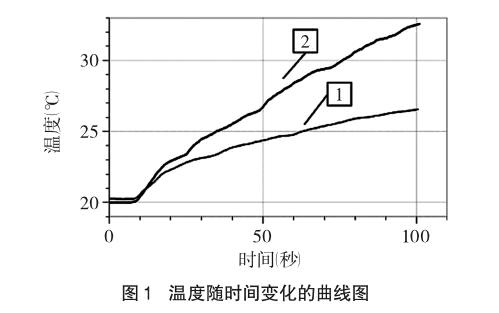
3.2 探究Cl-对Cu-Zn原电池反应的影响
(1)按图2连接好实验装置,连接计算机、数据采集器、电流传感器,打开计算机,进入Logger Pro 3数据采集软件系统。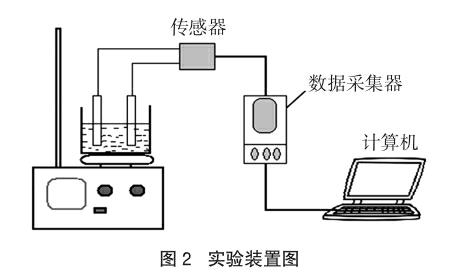
(2)向电池槽内加入适量0.1mol/L CuSO4溶液,放入磁子,开启磁力搅拌器,将铜片和锌片置入电池槽内,保持一定的距离并静止不动。
(3)点击“采集”按钮进行数据采集,约30s后,通过漏斗向电池槽内匀速加入少量NaCl固体,继续采集数据一段时间,点击“停止”按钮停止数据采集,保存数据。图像如图3所示。
(4)如图2连接好实验装置,只是把电流传感器换成电势传感器,打开计算机Logger Pro 3数据采集软件系统。
(5)操作同上述步骤3.2(3)和3.2(4)。记录单液Cu-Zn原电池电势在加入固体NaCl前后电势的变化。图像如图4所示。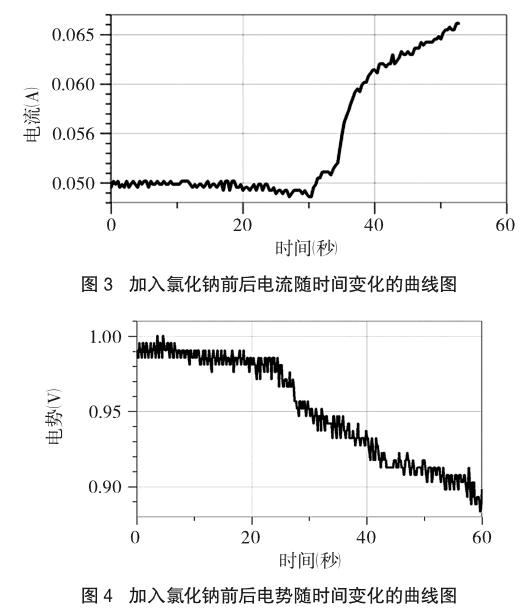
3.3 探究Cl-对Fe与Fe2(SO4)3溶液反应的影响。
(1)将压力传感器、数据采集器、计算机连接好,打开Logger Pro 3数据采集软件系统。
(2)取A、B两个相同小试剂瓶中,各加入等量铁粉,并在B瓶内加入2g NaCl固体。
(3)向A瓶内加入10mL 0.1mol/L Fe2(SO4)3溶液,迅速塞上连有压力传感器的橡胶塞。点击“采集”按钮进行数据采集,待压力达到130kPa以上时停止采集。压力随时间的变化曲线如图5曲线1所示。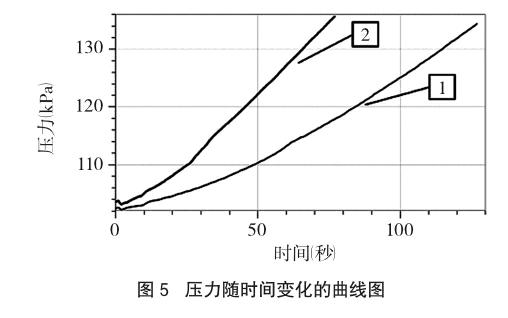
(4)向B瓶内加入10mL 0.1mol/L Fe2(SO4)3溶液,迅速塞上连有压力传感器的橡胶塞。点击“采集”按钮进行数据采集,待压力达到130kPa以上時停止采集。压力随时间的变化曲线如图5曲线2所示。
4 实验现象分析
(1)在实验探究一中,都是金属镁单质与硫酸铜溶液反应,因该反应是放热反应,用温度传感器测反应温度的变化。在控制变量的条件下,A烧杯没有加氯化钠,没有引入Cl-;B烧杯加有氯化钠,引入了Cl-。从反应曲线可以看出,加入Cl-可以加快Mg与CuSO4溶液反应的化学反应速率,温度升高较快。
目前比较权威的解释是[1]:氯离子能够破坏覆盖在镁表面的MgO或Mg(OH)2的紧密程度,使H+等更容易和镁发生化学反应,加快化学反应速率。endprint
(2)由于金属单质在水溶液中的反应大都伴随着原电池反应,因此,我们设计了一个原电池反应探究Cl-对原电池反应的电流及电势的影響。
从图3可以看出,在没有盐桥的单液Cu-Zn原电池中,如果在硫酸铜溶液加入固体NaCl后,随着固体NaCl的溶解,测得的电流会增大;而在图4中可以看出,向原电池的电解质溶液中加入固体NaCl后,随着固体NaCl的溶解,电势则会明显减小。
在原电池的电解质中加入氯化钠后,溶液中离子浓度增大,溶液的导电率也增大,这将有利于原电池反应的发生,体现在电流强度上也增大。
氯离子的引入,Cu-Zn原电池的电势减小,是因为溶液中的Cu2+与Cl-形成了配合物,降低了溶液中Cu2+的浓度,从而作为氧化型的Cu2+的氧化能力减弱了。根据能斯特方程,若氧化型金属离子浓度下降,则φ值会下降;因为此实验是单液原电池,并且测量时间较短(大约1分钟),溶液中Zn2+浓度较小,对φ(Zn2+/Zn)的影响可以忽略,因此测得的电势随着固体氯化钠的溶解而呈下降趋势。
综合电流和电势的变化,可以看出,尽管氯离子可以降低Cu-Zn原电池的电势,但由于电流增大,金属腐蚀速率会加快,金属腐蚀是以形成原电池的电化学腐蚀为主。

5 实验结论
(1)氯离子能加快金属的腐蚀速率是一种较普遍的现象。其腐蚀原理可以分为两种情况,第一种情况是因为氯离子半径较小和本身的性质,容易破坏金属表面的氧化膜等而加快金属的腐蚀[3]。第二种情况是氯离子作为配体和过渡元素形成金属配离子后,还原能力增强,氧化能力减弱,而加快金属的腐蚀速率[4]。
(2)在原电池反应中,如果氯离子和氧化型阳离子形成配离子后,尽管氧化型离子的氧化性减弱,电极电势减小,但若电解质溶液导电能力增大,电流增强,仍会加快负极金属的腐蚀速率。同时也证明了金属腐蚀以电化学腐蚀为主。
参考文献:
[1]严宣申.化学实验的启示与科学思维的训练[M].北京:北京大学出版社,1993:12.
[2]武汉大学,吉林大学等校编.无机化学(第三版,下册)[M].北京:高等教育出版社,1994:920.
[3]杨学宝,李瑞涛,张杰.氯离子与溴离子对金属腐蚀探究[J].工程技术,2014,(18):168~169.
[4]王程杰.关注氯离子效应在中学化学实验中的应用[J].化学教学,2015,(11):53~58.endprint

