miR-21、miR-29c和miR-182鉴别诊断良恶性胸腔积液
袁荣霞,李坚,金君,汪毅
(江苏大学附属医院1.呼吸内科,2.中心实验室,江苏镇江212001)
胸腔积液是多种疾病导致的胸膜腔液体渗出增多或回吸收障碍引起的临床综合征[1],可分为良性和恶性。恶性胸腔积液主要由肺癌、乳腺癌、卵巢癌等肿瘤的胸膜转移或恶性胸膜间皮瘤所致[2-4]。肿瘤发生胸膜转移形成恶性胸腔积液后,加重患者的临床症状及恶病质状态,预后不佳,尽早诊断和治疗可改善预后[5-6]。因此,良性和恶性胸腔积液的早期鉴别诊断极为重要。
恶性胸腔积液诊断的金标准包括胸腔积液脱落细胞检查、胸膜活检和胸腔镜活检病理检查[7]。但胸腔积液脱落细胞检查和胸膜活检的阳性率均较低,为40%~60%[8]。虽然胸腔镜检查阳性率高,但创伤性大、费用高,临床难以广泛开展应用[9]。胸腔积液肿瘤标志物检测用于恶性胸腔积液的诊断一直是人们的关注点[6,10-11]。与其他肿瘤标志物相比,癌胚抗原诊断恶性胸腔积液具有较高的敏感度,但特异度不够理想[7-8]。因此,探寻新的高敏感度和高特异度的肿瘤标志物用于恶性胸腔积液的诊断很有必要。
由于microRNAs存在于血清、尿液、胸腔积液等体液中,易于获取且具有较好的稳定性,近年来被广泛用于恶性肿瘤的诊断[12]。多项研究表明,miR-21、miR-29c和miR-182在肺癌、乳腺癌、卵巢癌、直肠癌、胃癌和食管癌等患者的癌组织或血浆中的表达与对应的癌旁组织及健康对照者血浆相比有显著差异[13-18],故有可能成为新的肿瘤生物标志物。上述3种microRNAs在良恶性胸腔积液中的表达尚不清楚,因此,我们通过分析65例恶性胸腔积液标本和61例良性胸腔积液标本中miR-21、miR-29c和miR-182表达水平的差异,探讨其在良恶性胸腔积液鉴别诊断中的意义。
1 病例与方法
1.1 研究对象
选取2015年4月至2017年6月在江苏大学附属医院呼吸内科、重症监护室和急诊科住院治疗的恶性胸腔积液患者65例,其中肺腺癌36例,肺鳞癌18例,小细胞肺癌5例,肺混合细胞癌1例,恶性胸膜间皮瘤1例,黏液纤维肉瘤、乳腺癌、前列腺癌及胰腺癌各1例。男42例,女23例,年龄38~93岁,平均69岁。所有患者均为初诊初治患者,原发肿瘤均经病理组织学检查确诊,胸腔积液的性质均由脱落细胞检查或胸膜活检病理检查明确。另选择同期住院的良性胸腔积液患者61例,其中结核性胸膜炎39例,肺炎旁胸腔积液10例,心功能不全8例,脓胸2例,类风湿性关节炎及乳糜胸各1例。男45例,女16例,年龄19~98岁,平均62岁。所有患者亦为初诊患者,原发疾病均符合该疾病最新诊断标准。同时选取20例健康者的血浆标本作为实验microRNA对照(样本microRNA校正值),其中男13例,女7例,年龄25~47岁,平均32岁。本研究符合人体试验伦理学标准,并得到医院伦理委员会批准,所有受试者在受试前签署知情同意书。
1.2 实验方法
1.2.1主要试剂及仪器 Trizol试剂、反转录试剂盒、荧光定量PCR试剂盒购自宝生物工程有限公司;PCR引物购自广州锐博生物公司;MyCycler PCR仪为美国BioRad公司产品;Mx3000P实时荧光定量PCR仪为美国Stratagene公司产品。
1.2.2标本处理 收集入组对象的胸腔积液标本200 mL,分装于含EDTA抗凝剂的试管中,留取10 mL送本院核医学科检测癌胚抗原;其余标本于半小时内以1 000×g离心5 min,弃上清液;加入等量红细胞裂解液,500×g离心5 min,弃上清液;最后加4 mL PBS,1 000×g离心洗涤5 min,弃上清液;加入1 mL Trizol,于-80℃保存待用。
1.2.3RNA提取 取“1.2.2”处理后的标本,解冻后加入200μL氯仿,震荡,12 000 r/min离心15 min;吸取上层水相至EP管中,加入异丙醇沉淀水相中的总RNA;用75%乙醇洗涤2次,可见羽毛状沉淀物;完全干燥后加入焦碳酸二乙酯处理过并经高温高压消毒的DEPC水溶解。用分光光度计测定RNA纯度[D(260 nm)/D(280 nm)]在1.8~2.0之间,浓度在200~300 ng/mL之间。
1.2.4反转录 将1μg RNA和2μL反转录引物工作液混合,加入DEPC水配制成11μL体系,离心混匀;70℃加热10 min,冰浴2 min。然后加入5×缓冲液5μL、反转录酶1μL以及无RNA酶的水8 μL,瞬时离心,避免产生气泡。于反转录仪设置如下反应程序:42℃60 min,70℃10 min。反应结束后于-20℃保存备用。
1.2.5实时荧光定量 PCR(RT-PCR)检测 miR-21、miR-29c和miR-182的表达 选取U6作为内参基因。加入cDNA 2μL,荧光染料9μL,miRNA正向引物0.8μL,反向引物 0.8μL,荧光校正液Ⅱ0.4 μL,无RNA酶的水7μL配制20μL体系(此步操作在冰上进行)。混匀,按照95℃预变性20 s;95℃变性10 s,60℃延伸20 s,进行40个循环。每个标本的每个基因重复测定3次,并设置空白对照。收集每个标本中U6、miR-21、miR-29c和miR-182的Ct值,用2-△△Ct方法计算各个 microRNA的相对表达量。
1.3 统计分析
应用SPSS 17.0进行统计分析,数据以均数±标准差(±s)表示,组间比较采用t检验或近似t检验,P<0.05为差异有统计学意义。构建受试者工作特征(ROC)曲线,获取曲线下面积(AUC),确定临界值,进而计算敏感度、特异度、阳性预测值、阴性预测值及准确度。
2 结果
2.1 良恶性胸腔积液中miR-21、miR-29c和miR-182的表达
与良性胸腔积液相比,恶性胸腔积液中miR-21和 miR-182相对表达水平明显增高(t=4.231,t′=3.738,P均 <0.05),miR-29c表达水平明显降低(t′=4.46,P<0.05)。见图1。
2.2 miR-21、miR-29c、miR-182和癌胚抗原诊断恶性胸腔积液的比较
ROC曲线显示,miR-21、miR-29c和miR-182诊断恶性胸腔积液的 AUC值分别为0.873(SE=0.033,95%CI:0.808~0.939)、0.856(SE=0.034,95%CI:0.790~0.920)和 0.841(SE=0.036,95%CI:0.772~0.911),均高于癌胚抗原诊断恶性胸腔积液的 AUC值(0.822,SE=0.043,95%CI:0.703~0.873)。联合检测 miR-21、miR-29c和 miR-182诊断恶性胸腔积液的 AUC值为0.949(SE=0.021,95%CI:0.908~0.989);联合 miR-21、miR-29c、miR-182和癌胚抗原检测诊断恶性胸腔积液的AUC值为0.986(SE=0.007,95%CI:0.972~1.000),均高于单独检测的AUC值(图2)。
根据ROC曲线分析结果分别取 0.193、0.036、0.008 96和 6.5作为 miR-21、miR-29c、miR-182和癌胚抗原诊断恶性胸腔积液的临界值,计算其单独及联合诊断恶性胸腔积液的敏感度、特异度、阳性预测值、阴性预测值和准确度,具体结果见表1。
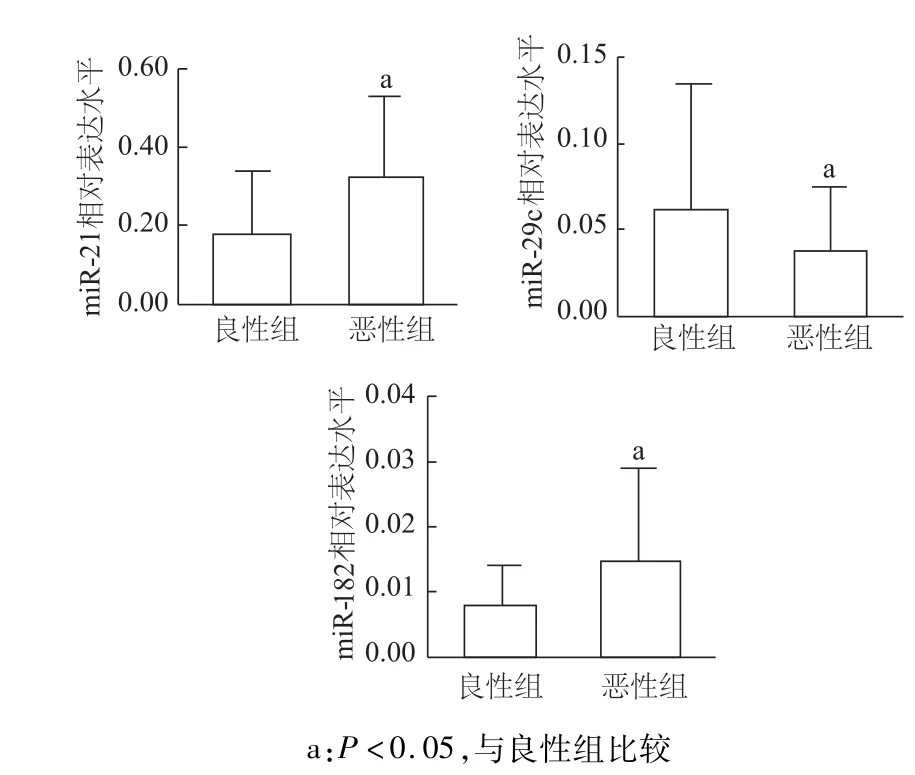
图1 m iR-21、m iR-29c和m iR-182在胸腔积液中的表达
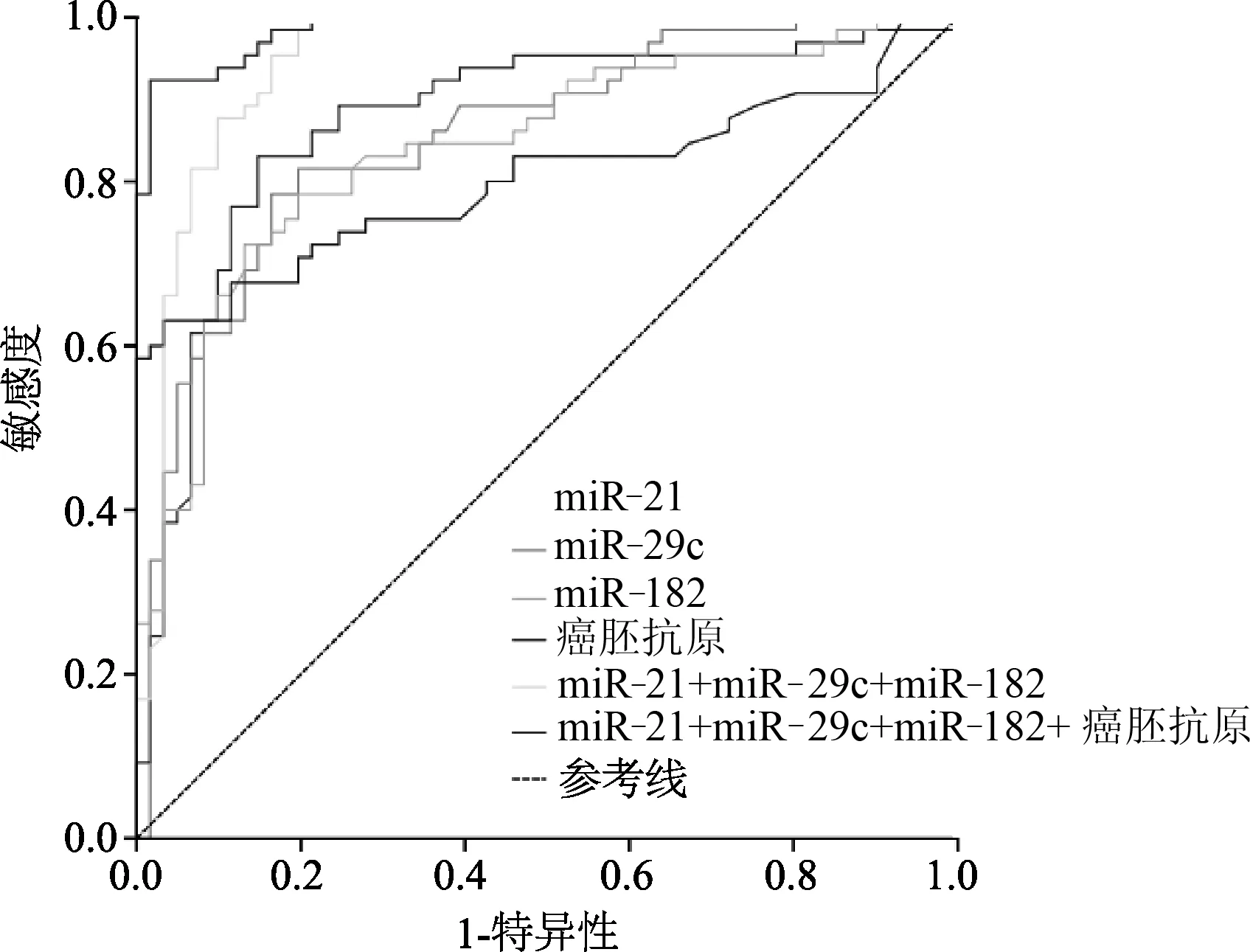
图2 m iR-21、m iR-29c、m iR-182和癌胚抗原的ROC曲线
3 讨论
microRNAs可于翻译水平抑制靶mRNAs,调节癌基因或抑癌基因的表达,从而参与肿瘤的发生、增殖和转移。其中,体液microRNAs被外泌体包裹,在低温、强酸和强碱等恶劣环境下可稳定存在[19]。Erbes等[20]发现检测尿液中 miR-155、miR-21、miR-125b、miR-2451的表达水平可作为乳腺癌筛查的非侵入性检查方法。另发现,检测血浆中miR-20a、miR-145、miR-21、miR-223和 miR-221对于非小细胞肺癌(NSCLC)的早期诊断具有较高准确性[21]。
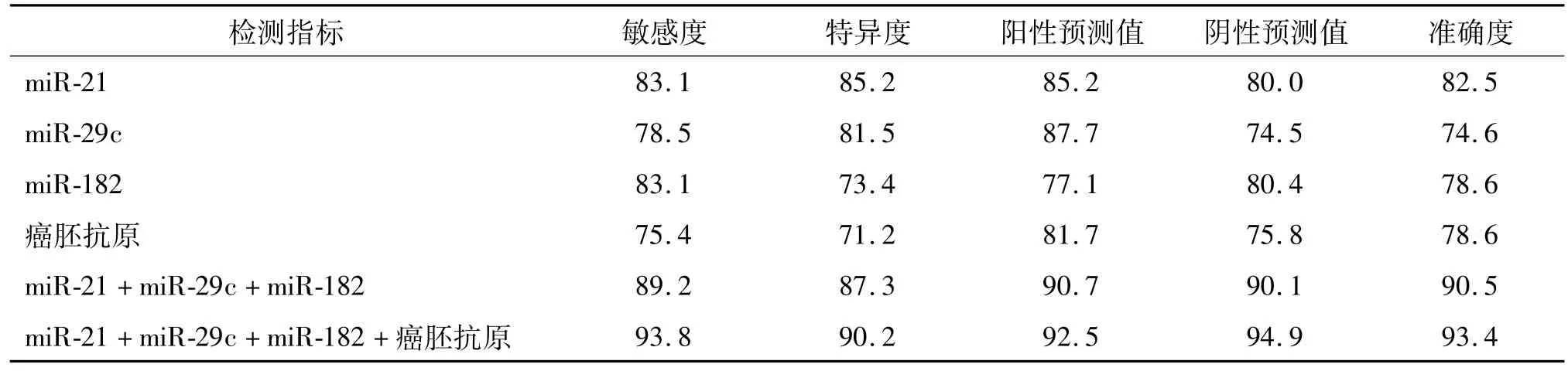
表1 胸腔积液中m iR-21、m iR-29c、m iR-182和癌胚抗原的检测对恶性胸腔积液的诊断效果 %
体内和体外实验均显示Ras癌基因通过两个下游信号通路上调细胞miR-21的表达,表明miR-21在Ras诱导的癌细胞增殖中发挥了重要作用[22]。Le等[23]报道肺癌患者血清miR-21水平明显高于健康者,并且患者术后血清miR-21水平明显低于术前,提示血清miR-21不仅可用于肺癌的诊断,还可作为监测肺癌患者术后肿瘤复发的标志物。另有研究发现NSCLC患者血浆中miR-21表达水平明显高于健康者,且表达水平与肿瘤TNM分期显著相关;其中接受含铂类药物化疗获得部分缓解的ⅢB和Ⅳ期患者血浆miR-21水平较获得稳定和进展的患者血浆miR-21水平低数倍之多,提示血浆miR-21既可作为NSCLC诊断的标志物,亦可用于预测NSCLC患者对含铂类方案的化疗疗效[24]。沉默miR-182的表达可致转化生长因子(TGF)信号转导中SMAD7的表达上调,从而抑制TGF诱导的上皮-间质转化和肿瘤侵袭,表明miR-182是参与肿瘤侵袭与转移的 TGF信号转导中的重要组成部分[25]。Wang等[26]报告胃癌患者血浆中miR-21和miR-182的表达水平明显高于健康者,且二者高表达与患者的生存时间呈负相关,体外实验证明miR-182高表达可促进胃癌细胞的增殖和迁移。上述研究结果表明,miR-21和miR-182参与肿瘤的发生、增殖及转移,其在血液中的表达可作为肿瘤诊断的标志物。本研究显示,miR-21和miR-182在恶性胸腔积液中的表达明显高于良性胸腔积液;此外,miR-21、miR-182诊断恶性胸腔积液的AUC值高于经典的肿瘤标志物癌胚抗原,且敏感度及特异度均优于癌胚抗原,与李威等[27]的研究结果基本吻合。由此表明,miR-21和miR-182可作为诊断恶性胸腔积液的生物标志物。
Chen等[28]研究发现miR-29c是p53的下游靶基因,并证明PH样结构域家族成员2(PHLDB2)是miR-29c的关键靶基因,p53通过促进miR-29c的表达下调PHLDB2,从而抑制结肠癌细胞的侵袭及转移,提示miR-29c在结肠癌的发生发展中起到抑癌基因的作用。Xu等[29]研究发现,食管鳞癌患者血清miR-29c表达明显低于健康对照者,表明测定血清miR-29c可作为食管鳞癌的无创筛选工具。然而Zhu等[30]报道,miR-29c在早期 NSCLC患者的肿瘤组织及血清中的表达分别高于对应的癌旁组织和健康者的血清,诊断敏感度及特异度高于血清癌胚抗原,提示血清miR-29c有可能作为诊断早期NSCLC的生物标志物。本研究显示miR-29c在恶性胸腔积液中的表达水平明显低于良性胸腔积液,且其诊断恶性胸腔积液的敏感度、特异度及准确度亦优于癌胚抗原。本结果与Xu等研究结果相似,而与Zhu等结果相异,其原因尚不清楚,分析可能因素如下:研究对象种族的不同,肿瘤类型的差别,检测标本不同等。由于本研究中NSCLC所致恶性胸腔积液占了入组病例的大多数,胸腔积液miR-29c测定结果与Zhu等不同,具体有待进一步研究。
此外,本研究证实联合检测胸腔积液miR-21、miR-29c和miR-182诊断恶性胸腔积液的敏感度和特异度优于3项指标的单独检测,三者与癌胚抗原联合测定可进一步提高诊断恶性胸腔积液的效能,表明联合检测胸腔积液中这些肿瘤标志物对于鉴别诊断良恶性胸腔积液具有更显著的价值。这与Zhu等[31]联合检测NSCLC患者血清miR-182和癌胚抗原可提高诊断效果的研究结果相似。
因此,胸腔积液miR-21、miR-29c和miR-182有可能成为新的肿瘤标志物用于恶性胸腔积液的临床诊断。
[参考文献]
[1]Hsieh WY,Kuan TC,Cheng KS,et al.ACE/ACE2 ratio and MMP-9 activity as potential biomarkers in tuberculous pleural effusions[J].Int J Biol Sci,2012,8(8):1197-1205.
[2]Ried M,Hofmann HS.The treatmentof pleural carcinosis with malignant pleural effusion[J].Dtsch Arztebl Int,2013,110(18):313-318.
[3]Tang Y,Xu L.Superiority and clinical significance of Lunx mRNA in the diagnosis ofmalignant pleural effusion caused by pulmonary carcinoma[J].J Exp Clin Cancer Res,2013,32(1):37.
[4]Agrawal A,Tandon R,Singh L,et al.Clinico-pathological profile and course ofmalignant pleural effusion in a tertiary care teaching hospital in western U.P.with special reference to lung cancer[J].Lung India,2015,32(4):326-330.
[5]Sriram KB,Relan V,Clarke BE,et al.Pleural fluid cell-free DNA integrity index to identify cytologically negativemalignant pleural effusions includingmesotheliomas[J].BMC Cancer,2012,12:428.
[6]Penz E,Watt KN,Hergott CA,et al.Management of malignantpleural effusion:challenges and solutions[J].Cancer Manag Res,2017,9:229-241.
[7]Antonangelo L,Sales RK,CoráAP,etal.Pleural fluid tumourmarkers inmalignant pleural effusion with inconclusive cytologic results[J].Curr Oncol,2015,22(5):e336-341.
[8]Hooper C,Lee YC,Maskell N,etal.Investigation of a unilateral pleural effusion in adults:British Thoracic Society Pleural Disease Guideline 2010[J].Thorax,2010,65(Suppl 2):ii4-ii17.
[9]Shojaee S,Lee HJ.Thoracoscopy:medical versus surgical-in themanagement of pleural diseases[J].J Thorac Dis,2015,7(Suppl 4):S339-S351.
[10]Psatha A,Makris D,Kerenidi T,etal.A Potential role for VEGF in the diagnostic approach of pleural effusions[J].JThorac Dis,2016,8(7):1681-1687.
[11]Lee SH,Park MJ,Choi SI,et al.Reactive oxygen speciesmodulator 1(Romo1)as a novel diagnostic marker for lung cancer-related malignant effusion[J].Medicine(Baltimore),2017,96(4):e5975.
[12]Cortez MA,Bueso-Ramos C,Ferdin J,et al.MicroRNAs in body fluids—themix of hormones and biomarkers[J].Nat Rev Clin Oncol,2011,8(8):467-477.
[13]Wang B,Zhang Q.The expression and clinical significance of circulatingmicroRNA-21 in serum of five solid tumors[J].JCancer Res Clin Oncol,2012,138(10):1659-1666.
[14]Guan P,Yin Z,Li X,et al.Meta-analysis of human lung cancermicroRNA expression profiling studies comparing cancer tissueswith normal tissues[J].JExp Clin Cancer Res,2012,31(1):54.
[15]Corcoran C,Friel AM,Duffy MJ,et al.Intracellular and extracellularmicroRNAs in breast cancer[J].Clin Chem,2011,57(1):18-32.
[16]Pass HI,Goparaju C,Ivanov S,etal.hsa-miR-29c*is linked to the prognosis ofmalignant pleuralmesothelioma[J].Cancer Res,2010,70(5):1916-1924.
[17]Han TS,Hur K,Xu G,et al.MicroRNA-29cmediates initiation of gastric carcinogenesis by directly targeting ITGB1[J].Gut,2015,64(2):203-214.
[18]Zhang QH,Sun HM,Zheng RZ,etal.Meta-analysis of microRNA-183 family expression in human cancer studies comparing cancer tissues with noncancerous tissues[J].Gene,2013,527(1):26-32.
[19]Qin X,Xu H,Gong W,et al.The tumor cytosolmiRNAs,fluid miRNAs,and exosome miRNAs in lung cancer[J].Front Oncol,2015,4:357.
[20]Erbes T,Hirschfeld M,Rücker G,et al.Feasibility of urinary microRNA detection in breast cancer patients and its potential as an innovative non-invasive biomarker[J].BMCCancer,2015,15:193.
[21]Geng Q,Fan T,Zhang B,et al.Five microRNAs in plasma as novel biomarkers for screening of early-stage non-small cell lung cancer[J].Respir Res,2014,15(1):149.
[22]Frezzetti D,De Menna M,Zoppoli P,et al.Upregulation of miR-21 by Ras in vivo and its role in tumor growth[J].Oncogene,2011,30(3):275-286.
[23]Le HB,Zhu WY,Chen DD,et al.Evaluation of dynamic change of serum miR-21 and miR-24 in pre-and post-operative lung carcinoma patients[J].Med Oncol,2012,29(5):3190-3197.
[24]Wei J,GaoW,Zhu CJ,et al.Identification of plasma microRNA-21 as a biomarker for early detection and chemosensitivity of non-small cell lung cancer[J].Chin JCancer,2011,30(6):407-414.
[25]Yu J,Lei R,Zhuang X,et al.MicroRNA-182 targets SMAD7 to potentiate TGFβ-induced epithelial-mesenchymal transition andmetastasis of cancer cells[J].Nat Commun,2016,7:13884.
[26]Wang X,Wang R,Li F,et al.Relationship between miR-21 and miR-182 levels in peripheral blood and gastric cancer tissue[J].Oncol Lett,2017,14(2):1427-1432.
[27]李威,陈燕明,陈晓军,等.胸腔积液中 miRNA-21和miRNA-155表达的诊断价值[J].江苏医药,2012,38(16):1882-1884.
[28]Chen G,Zhou T,Li Y,et al.p53 targetmiR-29c-3p suppresses colon cancer cell invasion and migration through inhibition of PHLDB2[J].Biochem Biophys Res Commun,2017,487(1):90-95.
[29]Xu H,Yao Y,Meng F,et al.Predictive value of serum miR-10b,miR-29c,andmiR-205 as promising biomarkers in esophageal squamous cell carcinoma screening[J].Medicine(Baltimore),2015,94(44):e1558.
[30]Zhu W,He J,Chen D,et al.Expression of miR-29c,miR-93,and miR-429 as potential biomarkers for detection ofearly stage non-small lung cancer[J].PLoSOne,2014,9(2):e87780.
[31]Zhu WY,Zhou K,Zha Y,etal.Diagnostic value of serum miR-182,miR-183,miR-210,and miR-126 levels in patients with early-stage non-small cell lung cancer[J].PLoSOne,2016,11(4):e0153046.

