国产血浆游离DNA提取试剂盒的性能评价
潘杰,吴玉梅,*,赵琪,赵兰静,吴茵,朱菊平,黄学文
(1.华东疗养院检验科,江苏无锡214065;2.南京医科大学附属无锡人民医院检验科,江苏无锡214023)
游离 DNA(free circulating/cell-free DNA,cfDNA)是一种无细胞状态的、片段化的胞外DNA,主要存在于血液、滑膜液和脑脊液等体液中。目前cfDNA在无创产前检测和肿瘤的液态活检方面应用较广。除此之外,cfDNA在器官移植、脑卒中、自身免疫病和心肌梗死等疾病上的应用价值也日益清晰[1-3]。目前,对cfDNA提取质量缺乏统一的评价标准[4-5]。cfDNA在血浆内的含量极低,大致范围在15~40 ng/mL,在如此低丰度的情况下,采用紫外波长等传统方法得到的定量结果往往不准确[6-8]。因此,如何正确评价cfDNA的提取质量是急需解决的问题之一。目前硅胶膜吸附柱提取方法是cfDNA提取量最大最纯的一种方法,市场上最主要的产品为Qiagen公司的QIAamp游离核酸提取试剂盒(Qiagen CNA kit),其在cfDNA提取领域具有非常大的垄断性。本研究将从cfDNA的提取效率、cfDNA的片段分布以及不同片段DNA的回收率等方面评价国产cfDNA提取试剂盒的性能,以期掌握更好更经济的cfDNA提取方法。
1 材料与方法
1.1 对象
选取200例2016年10月20日来华东疗养院体检的人员作为志愿者,平均年龄42.6岁(35~55岁)。全部志愿者乙型肝炎病毒血清标志物和丙型肝炎病毒血清抗体均为阴性,肝肾功能、血脂和尿酸等生化指标正常,超声波检查证实肝、胆、脾、胰、肾无异常,X线、CT及内窥镜检查均正常。
1.2 方法
1.2.1血浆池A的制备 所有志愿者均于体检时空腹抽取静脉血4 mL,加入含EDTA的BD抗凝管中。1 900×g离心10 min,转移上层血浆至新1.5 mL EP管中,16 000×g离心10 min。吸取上清液,将所有上清液混合构成血浆池A,-80℃保存备用。
1.2.2cfDNA提取 用 Qiagen CNA kit和游离DNA大量提取试剂盒(江苏昱安生物科技有限公司),按照说明书分别提取1、2、3和5 mL血浆池A中的cfDNA 3次。4 mL血浆池每天提取2次,10 d共提取20次。提取物-80℃保存备用。
1.2.3cfDNA浓度检测 根据文献[4]报道,血浆中的β-球蛋白基因浓度可以代表血浆中cfDNA浓度,因此用102 bp的β-球蛋白基因片段的荧光定量PCR的Ct值代表cfDNA浓度。用TaqMan qPCR体系(TaKaRa公司)在荧光定量PCR仪上(ABI ViiATM7DX荧光定量PCR仪)检测血浆池A提取物中β-球蛋白基因含量。具体步骤:2×PCR缓冲液12.5μL,10μmol/L的 β-球蛋白基因上下游引物各0.5μL,10μmol/L的 TaqMan-BHQ1探针0.75μL,50×ROX液 0.25μL,DEPC水 0.5μL,提取物 10 μL,总体积25μL。扩增条件为95℃ 30 s,1个循环;95℃ 5 s,60℃ 40 s,40个循环。β-球蛋白基因的上、下游引物及TaqMan-BHQ1探针由上海英骏公司合成,序列见表1。
1.2.4PCR分析 cfDNA片段 在 ABIVERITI梯度PCR仪上,用普通PCR体系(江苏昱安生物科技有限公司)分别扩增4 mL血浆池A提取物中102和268 bp的β-球蛋白基因片段以及402和1 204 bp的p53基因片段。具体步骤:2×PCR缓冲液12.5 μL,10μmol/L的上下游引物各 0.5μL,提取物 5 μL,DEPC水6.5μL,总体积 25μL。扩增条件:94℃ 1 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,共 35个循环;72℃延伸5 min。1.5%琼脂糖凝胶电泳观察结果。上下游引物由上海英骏公司合成,序列见表1。

表1 引物及探针序列
1.2.5PCR产物纯化及定量 用PCR产物纯化试剂盒(江苏昱安生物科技有限公司)分别纯化102、268和402 bp的PCR产物,核酸测定仪分别测定浓度。各取50μL纯化后的102、268和402 bp片段混合,核酸测定仪测定浓度。
1.2.6血浆池B1-B4的制备 在0.94 mL血浆池A中分别加入60μL已知浓度的片段长度为102、268和402 bp的纯化后的PCR产物及其混合物,形成1 mL血浆池B1-B4。
1.2.7血浆池B1-B4中不同DNA片段的回收率计算 用Qiagen CNA kit和游离DNA大量提取试剂盒(江苏昱安生物科技有限公司),按照说明书分别提取1 mL血浆池B1-B4中的cfDNA,每个血浆池每天重复提取cfDNA 2次,10 d共提取20次。以1 mL血浆池 A的提取物调零,核酸测定仪(NV3000C,VASTECH公司)分别测定核酸浓度,计算回收率,回收率=回收后所获得DNA量/回收前加入的DNA量。同时,用1.5%琼脂糖凝胶电泳观察回收效果。
1.3 统计学处理
应用SPSS 20.0软件进行统计分析,计量资料以均数±标准差(±s)表示,两组比较采用t检验;血浆用量与cfDNA的Ct值关系分析采用线性相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 两种试剂盒提取的血浆池A中cfDNA浓度比较
荧光定量PCR结果表明,4 mL血浆池A血浆中,Qiagen和国产提取物中cfDNA含量的平均Ct值分别为27.94±0.423和27.41±0.356,两种方法的Ct值差异明显(t=4.29,P<0.01)。Qiagen和国产提取物中 cfDNA含量的 CV值分别为1.51%和1.30%。
2.2 两种试剂盒提取的血浆池A中cfDNA片段分析
PCR结果表明,两种方法的提取物在102、268和402 bp处均出现明显条带,而1 204 bp片段未出现。电泳结果还表明,国产试剂在102、268和402 bp处的条带强度明显高于Qiagen产品(图1)。

图1 血浆游离DNA片段长度分析结果
2.3 血浆池B1-B4中不同片段DNA的回收率比较
结果见表2,两者在102 bp和268 bp片段的回收率上差异显著(t=5.69,P<0.01;t=3.44,P<0.01),而在402 bp及混合物的回收率上无明显差异(t=0.47,P>0.05;t=1.39,P>0.05)。Qiagen CNA kit和国产试剂盒回收率的平均CV值为6.28%和6.09%。同时,电泳结果进一步证明了不同片段DNA的回收效果(图2、图3)。

表2 两种试剂对血浆池B1-B4中不同DNA片段回收率的比较

图2 国产提取试剂不同DNA片段回收前后电泳结果

图3 两种提取试剂不同DNA片段回收后电泳结果比较
2.4 血浆用量与cfDNA的Ct值关系分析
1、2、3、4和5 mL血浆池A血浆中提取的cfDNA定量分析结果表明,Qiagen和国产试剂盒的血浆用量与Ct值存在负相关,线性方程式分别为Y=-0.468X+29.85,r2=0.979(P<0.01);Y=-0.432X+29.35,r2=0.963(P<0.01)。见图4。
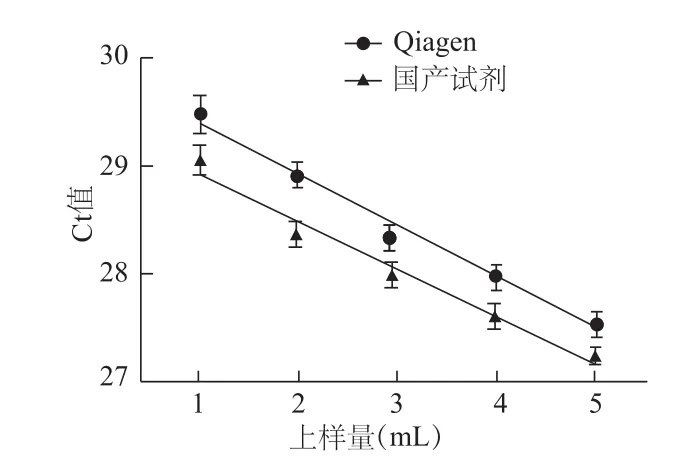
图4 两种试剂上样量与cfDNA的Ct值的关系
3 讨论
cfDNA正在成为产前检测、癌症诊断和监测的重要临床分析物。因为获得相对容易及无创性特点,cfDNA作为“液体组织”已经显示出了非常重要的临床应用前景[1-3]。目前,妨碍cfDNA成为一种强大的临床分析物的主要因素之一就是提取物缺乏标准化和适当的质量控制。最近,在影响分析效果的样品前处理和储存等方面取得了进展[9-11],但提取方法和定量方法仍然是实验误差的主要来源[4]。cfDNA在血浆(血清)中含量非常低,一般只有15~40 ng/mL,其提取质量对分析方法的敏感性至关重要。因此,需要质量控制来测量提取效率、片段大小以及提取物对下游检测的影响。研究表明,不同方法提取效率可能有很大差异[5-7]。文献报道Qiagen CNA kit是目前市场上最好的cfDNA提取方法之一[8],我们通过与Qiagen试剂盒的比较,评价国产cfDNA提取试剂盒的性能。
血浆cfDNA的片段长度多集中在100~400 bp,基本无大于1 000 bp的cfDNA片段,而肿瘤来源的 cfDNA主要集中在 200~400 bp之间[12-13],胎儿cfDNA通常比母体 cfDNA片段更小[14]。因此,cfDNA片段大小分析是评价cfDNA提取试剂盒的关键,所有方法提取的cfDNA必须体现血浆中cfDNA高度片段化的特征[15-16]。本研究对国产试剂盒进行cfDNA片段大小的分析结果表明,国产试剂提取的cfDNA在102、268和402 bp处均出现明显条带,而1 204 bp片段未出现,结果与血浆中cfDNA高度片段化的特征相一致。且国产试剂在102、268和402 bp处的条带强度明显高于Qiagen产品,说明国产试剂盒在提取效率上可能高于Qiagen产品。
在许多cfDNA研究中使用的提取方法,最初被开发主要是用于从血细胞或病毒粒子中提取高度完整的基因组DNA,而不是高度片段化的cfDNA。因此,不同提取方法可能对不同片段DNA具有不同的提取效果。为了评价国产试剂盒对小片段DNA的提取效果,本研究在血浆池A加入固定浓度不同长度的DNA片段,观察国产试剂对不同长度DNA片段的提取效率。结果表明,本研究结果与文献报道的Qiagen CNA kit的cfDNA回收率约为90%相一致[10]。同时,国产试剂盒在短片段的提取效率上要优于Qiagen CNA kit,而在稍大片段的DNA提取效率上与Qiagen CNA kit无异。另外,cfDNA提取的稳定性和重复性也是评价试剂盒优劣的一个指标。据文献报道[8],Qiagen CNA kit的平均 CV值小于10%,其他一些试剂盒的平均CV值可能高达50%。本实验的结果表明Qiagen CNA kit的平均CV值为6.28%,国产试剂的平均CV值为6.09%。说明国产试剂盒同样具有很高的提取稳定性和重复性。
除了提取回收效率之外,cfDNA总量分析也十分重要。cfDNA的总量变化在胎儿非整倍体分析[17]和癌症相关拷贝数变化中应用广泛[6]。为了定量分析cfDNA的浓度,我们用荧光定量PCR方法分析了提取物中cfDNA浓度。结果表明,4 mL血浆池A国产和Qiagen的提取物中β-球蛋白基因的Ct值分别为27.41±0.356和27.94±0.423,两种方法的Ct值差异明显。国产和Qiagen的提取物中β-球蛋白基因Ct值的CV值分别为1.30%和1.51%。结果进一步证明国产试剂在提取效率和提取稳定上均有很好的效果。
cfDNA提取血浆用量通常为1 mL,为了监测提取效率和提取产率的线性,我们分析了不同血浆用量与cfDNA浓度的关系。结果表明,国产试剂盒与Qiagen的上样量与Ct值均存在负相关,血浆用量增加,总cfDNA产量增加,在5 mL范围内血浆用量与cfDNA产量呈线性关系。
综上所述,本研究建立了一种评价cfDNA提取优劣的方法,为选择cfDNA提取试剂盒提供了依据;研究同时表明,国产cfDNA提取方法在各项评价性能上均可与Qiagen产品媲美。
[参考文献]
[1]Stroun M,Anker P,Lyautey J,et al.Isolation and characterization of DNA from the plasma of cancer patients[J].Eur JCancer Clin Oncol,1987,23(6):707-712.
[2]Page K,Hava N,Ward B,et al.Detection of HER2 amplification in circulating free DNA in patients with breast cancer[J].Br JCancer,2011,104(8):1342-1348.
[3]Benn P,Cuckle H,Pergament E.Non-invasive prenatal testing for aneuploidy:current status and future prospects[J].Ultrasound Obstet Gynecol,2013,42(1):15-33.
[4]Fleischhacker M,Schmidt B,Weickmann S,et al.Methods for isolation of cell-free plasma DNA strongly affect DNA yield[J].Clin Chim Acta,2011,412(23/24):2085-2088.
[5]Repiska G,Sedlackova T,Szemes T,etal.Selection of the optimalmanualmethod of cell free fetal DNA isolation from maternal plasma[J].Clin Chem Lab Med,2013,51(6):1185-1189.
[6]Page K,Guttery DS,Zahra N,et al.Influence of plasma processing on recovery and analysis of circulating nucleic acids[J].PLoSOne,2013,8(10):e77963.
[7]Holmberg RC,Gindlesperger A,Stokes T,etal.Akonni TruTip®and Qiagen®methods for extraction of fetal circulating DNA-evaluation by real time and digital PCR[J].PLoSOne,2013,8(8):e73068.
[8]Devonshire AS,Whale AS,Gutteridge A,et al.Towards standardisation of cell-free DNA measurement in plasma:controls for extraction efficiency,fragment size bias and quantification[J].Anal Bioanal Chem,2014,406(26):6499-6512.
[9]Barrett AN,Zimmermann BG,Wang D,et al.Implementing prenatal diagnosis based on cell-free fetal DNA:accurate identification of factors affecting fetal DNA yield[J].PLoSOne,2011,6(10):e25202.
[10]Wong D,Moturi S,Angkachatchai V,etal.Optimizing blood collection,transportand storage conditions for cell free DNA increases access to prenatal testing[J].Clin Biochem,2013,46(12):1099-1104.
[11]Hidestrand M,StokowskiR,Song K,etal.Influence of temperature during transportation on cell-free DNA analysis[J].Fetal Diagn Ther,2012,31(2):122-128.
[12]Wang BG,Huang HY,Chen YC,etal.Increased plasma DNA integrity in cancer patients[J].Cancer Res,2003,63(14):3966-3968.
[13]Giacona MB,Ruben GC,Iczkowski KA,et al.Cellfree DNA in human blood plasma:length measurements in patients with pancreatic cancer and healthy controls[J].Pancreas,1998,17(1):89-97.
[14]Jorgez CJ,Bischoff FZ.Improving enrichment of circulating fetal DNA for genetic testing:size fractionation followed by whole gene amplification[J].Fetal Diagn T-her,2009,25(3):314-319.
[15]Clausen FB,Krog GR,Rieneck K,et al.Improvement in fetal DNA extraction from maternal plasma.Evaluation of the NucliSensmagnetic extraction system and the QIAamp DSP virus kit in comparison with the QIAamp DNA blood mini kit[J].Prenat Diagn,2007,27(1):6-10.
[16]Xue X,Teare MD,Holen I,et al.Optimizing the yield and utility of circulating cell-free DNA from plasma and serum[J].Clin Chim Acta,2009,404(2):100-104.
[17]Lo YM,Lun FM,Chan KC,et al.Digital PCR for the molecular detection of fetal chromosomal aneuploidy[J].Proc Natl Acad Sci U S A,2007,104(32):13116-13121.

